名校
解题方法
1 . 下列有关化学用语的使用正确的是
A. 的电子式: 的电子式: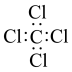 |
B.钠离子结构示意图 |
C.M²⁻核外有a个电子,b个中子,M的原子符号为 |
D.高氯酸的电离方程式 |
您最近一年使用:0次
名校
2 . 现有下列几种有机物:
(1)属于芳香烃的是___________ (填序号,下同)。
(2)②中的官能团的名称为___________ , 杂化的碳原子数为
杂化的碳原子数为___________ 。
(3)互为同分异构体的是___________ 。
(4)互为同系物的是___________ 。
(5)用系统命名法给⑦命名,其名称为___________ 。
(6)2,3-二甲基-4-乙基己烷的结构简式___________ 。
①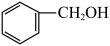 ②
②  ③
③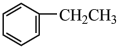 ⑥
⑥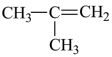 ⑤
⑤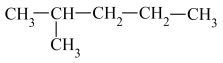
⑥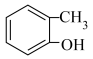 ⑦
⑦ ⑧
⑧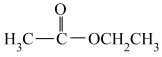
(1)属于芳香烃的是
(2)②中的官能团的名称为
 杂化的碳原子数为
杂化的碳原子数为(3)互为同分异构体的是
(4)互为同系物的是
(5)用系统命名法给⑦命名,其名称为
(6)2,3-二甲基-4-乙基己烷的结构简式
您最近一年使用:0次
名校
3 . 下列说法正确的是
A.按系统命名法,化合物 的名称是2,3,4,4-四甲基己烷 的名称是2,3,4,4-四甲基己烷 |
B. 分子中所有原子共面 分子中所有原子共面 |
C.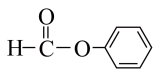 属于醛类,官能团为 属于醛类,官能团为 |
D.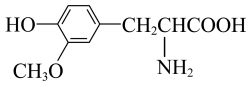 与 与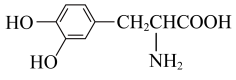 互为同系物 互为同系物 |
您最近一年使用:0次
2024-04-03更新
|
435次组卷
|
4卷引用:山东省枣庄市第八中学三校区2023-2024学年高二下学期联考化学试卷
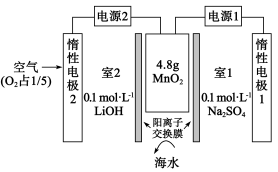
4 . 一种有效富集锂的电化学系统如图所示,中间区域设置有孔道结构的 ,可容纳
,可容纳 进出。向
进出。向 所在腔室通入海水,启动电源1,海水中
所在腔室通入海水,启动电源1,海水中 进入
进入 结构形成
结构形成 达到饱和;关闭电源1和海水通道,启动电源2,向电极2通空气,使
达到饱和;关闭电源1和海水通道,启动电源2,向电极2通空气,使 中的
中的 脱出完成富集。下列说法错误的是
脱出完成富集。下列说法错误的是
 ,可容纳
,可容纳 进出。向
进出。向 所在腔室通入海水,启动电源1,海水中
所在腔室通入海水,启动电源1,海水中 进入
进入 结构形成
结构形成 达到饱和;关闭电源1和海水通道,启动电源2,向电极2通空气,使
达到饱和;关闭电源1和海水通道,启动电源2,向电极2通空气,使 中的
中的 脱出完成富集。下列说法错误的是
脱出完成富集。下列说法错误的是
A.通入448mL(STP)空气恰好使 全部脱出,可得 全部脱出,可得 |
B.室2中阳极发生的反应为 |
| C.工作时电极1附近和电极2附近溶液的pH均增大 |
| D.电源1和电源2正负极都接反也能达到富集锂的目的 |
您最近一年使用:0次
2024-04-02更新
|
468次组卷
|
2卷引用:2024届山东省枣庄市高三下学期模拟考试(二调)化学试题
5 . GaN作为第三代半导体材料广泛应用于大功率充电器和5G通讯技术,某工厂利用炼锌矿渣[主要成分 、
、 、CuO和
、CuO和 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下:
ⅱ. 可溶于过量氨水生成
可溶于过量氨水生成
ⅲ.常温下,酸浸后浸出液中可能存在的各离子浓度、形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见下表:
(萃取率指进入有机层中金属离子的百分数; 难被萃取;离子浓度
难被萃取;离子浓度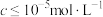 时即认为沉淀完全)
时即认为沉淀完全)
回答下列问题:
(1)“酸浸”过程中 发生反应的化学方程式为
发生反应的化学方程式为______________________________ 。
(2)滤液①中 的浓度为:
的浓度为:__________ ;从工业经济性考虑,电解滤液①得到的产物,可用于回收金属,还可用于__________ ;滤液①中的主要溶质之一可采用加热浓缩、降温结晶的方法提取,不同降温方法对析出固体的颗粒大小影响如图所示,若工业生产对产品粒径均一度有要求,则应选用__________ (填“快速”“缓慢”或“变速”)降温的方法,原因是______________________________ 。__________ 。反萃取过程中物质B会溶于水相分离,生成物质B的离子方程式为______________________________ ;若通过电解物质B的溶液可以得到单质Ga,则阴极电极反应式为______________________________ 。
 、
、 、CuO和
、CuO和 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下: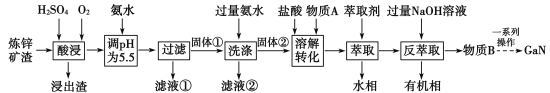
ⅱ.
 可溶于过量氨水生成
可溶于过量氨水生成
ⅲ.常温下,酸浸后浸出液中可能存在的各离子浓度、形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见下表:
金属离子 |
|
|
|
|
|
浓度 | — |
| 0.78 |
| 0.22 |
开始沉淀pH | 8.0 | 1.7 | 5.6 | 3.0 | 4.5 |
完全沉淀pH | 9.6 | 3.2 | 8.0 | 4.9 | a(a>5.5) |
萃取率/% | 0 | 99 | 0 | 97~98.5 | 93 |
 难被萃取;离子浓度
难被萃取;离子浓度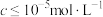 时即认为沉淀完全)
时即认为沉淀完全)回答下列问题:
(1)“酸浸”过程中
 发生反应的化学方程式为
发生反应的化学方程式为(2)滤液①中
 的浓度为:
的浓度为: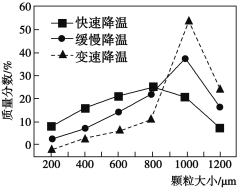
您最近一年使用:0次
2024-03-29更新
|
813次组卷
|
3卷引用:2024届山东省枣庄市高三下学期模拟考试(二调)化学试题
2024届山东省枣庄市高三下学期模拟考试(二调)化学试题山东省枣庄市2023-2024学年高三下学期一模化学试题(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
6 .  是原子序数依次增大的前四周期元素,A元素原子最高能级的不同轨道都有电子且自旋方向相同;B元素原子的价层电子排布式是
是原子序数依次增大的前四周期元素,A元素原子最高能级的不同轨道都有电子且自旋方向相同;B元素原子的价层电子排布式是 ;其中C元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法
;其中C元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法不正确 的是
 是原子序数依次增大的前四周期元素,A元素原子最高能级的不同轨道都有电子且自旋方向相同;B元素原子的价层电子排布式是
是原子序数依次增大的前四周期元素,A元素原子最高能级的不同轨道都有电子且自旋方向相同;B元素原子的价层电子排布式是 ;其中C元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法
;其中C元素的部分电离能如下表;含D元素的化合物焰色试验火焰呈紫色(透过蓝色钴玻璃)。下列说法| 元素 | 电离能 | |||
 |  |  |  | |
| C | 578 | 1817 | 2745 | 11575 |
A.离子半径大小: |
| B.C的最高价氧化物对应水化物可溶于D的最高价氧化物对应水化物的水溶液 |
C.化合物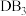 中含离子键和共价键 中含离子键和共价键 |
| D.元素D的核外电子运动具有10种不同的空间运动状态 |
您最近一年使用:0次
2024-03-05更新
|
410次组卷
|
5卷引用:山东省滕州市第一中学2023-2024学年高二下学期3月月考化学试题
解题方法
7 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
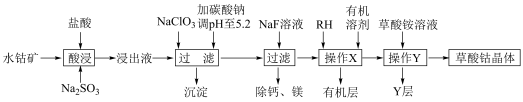
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液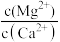 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
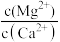 =
=
您最近一年使用:0次
名校
解题方法
8 . 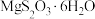 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。已知
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。已知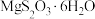 的摩尔质量是
的摩尔质量是 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法错误的是
,下列说法错误的是
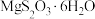 的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。已知
的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。已知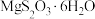 的摩尔质量是
的摩尔质量是 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,下列说法错误的是
,下列说法错误的是
| A.该晶体中存在的化学键包括共价键、离子键、氢键 |
B. 的空间结构为四面体形 的空间结构为四面体形 |
C. 的配位数为4 的配位数为4 |
D.该晶体的密度为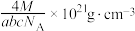 |
您最近一年使用:0次
2024-01-22更新
|
294次组卷
|
3卷引用:山东省枣庄市第十六中学等校2023-2024学年高三下学期5月(一模)考试化学试题
山东省枣庄市第十六中学等校2023-2024学年高三下学期5月(一模)考试化学试题河北省邢台市宁晋中学等校2023-2024学年高三上学期联测考试化学试题(已下线)山东师范大学附属中学2024届高三下学期考前预测化学试题
名校
9 . 填空。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为 的氢气和碘蒸气放入密闭容器中进行反应:
的氢气和碘蒸气放入密闭容器中进行反应: ,反应经过5分钟测得碘化氢的浓度为
,反应经过5分钟测得碘化氢的浓度为 ,碘蒸气的浓度为
,碘蒸气的浓度为 。前5分钟平均反应速率
。前5分钟平均反应速率
__________ , 的初始浓度是
的初始浓度是__________ 。
(2)某小组同学在室温下进行“碘钟实验”:将浓度均为 的
的 、
、 、KI、
、KI、 溶液及淀粉混合,一定时间后溶液变为蓝色。
溶液及淀粉混合,一定时间后溶液变为蓝色。
已知:“碘钟实验”的总反应的离子方程式为
反应分两步进行:
反应A:……
反应B:
①反应A的离子方程式是___________ 。对于总反应, 的作用是
的作用是___________ 。
②探究溶液变蓝快慢的影响因素,实验I、II.(溶液浓度均为 )
)
i.溶液从混合时的无色变为蓝色的时间:实验I是30min、实验II是40min。实验II中,x、y、z所对成的数值分别是___________ 、___________ 、___________ ;
ii.对比实验I、II,可得出的实验结论是___________ 。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为
 的氢气和碘蒸气放入密闭容器中进行反应:
的氢气和碘蒸气放入密闭容器中进行反应: ,反应经过5分钟测得碘化氢的浓度为
,反应经过5分钟测得碘化氢的浓度为 ,碘蒸气的浓度为
,碘蒸气的浓度为 。前5分钟平均反应速率
。前5分钟平均反应速率
 的初始浓度是
的初始浓度是(2)某小组同学在室温下进行“碘钟实验”:将浓度均为
 的
的 、
、 、KI、
、KI、 溶液及淀粉混合,一定时间后溶液变为蓝色。
溶液及淀粉混合,一定时间后溶液变为蓝色。已知:“碘钟实验”的总反应的离子方程式为

反应分两步进行:
反应A:……
反应B:

①反应A的离子方程式是
 的作用是
的作用是②探究溶液变蓝快慢的影响因素,实验I、II.(溶液浓度均为
 )
)| 用量试剂 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实验I | 5 | 4 | 8 | 3 | 0 |
| 实验II | 5 | 2 | x | y | z |
ii.对比实验I、II,可得出的实验结论是
您最近一年使用:0次
10 . 水煤气可以在一定条件下发生反应:  ,现在向 10L恒容密闭容器中充入 CO(g)和
,现在向 10L恒容密闭容器中充入 CO(g)和  ,所得实验数据如表所示。
,所得实验数据如表所示。
下列说法正确的是
 ,现在向 10L恒容密闭容器中充入 CO(g)和
,现在向 10L恒容密闭容器中充入 CO(g)和  ,所得实验数据如表所示。
,所得实验数据如表所示。| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(CO) | n(H₂O) | n(H₂) | ||
| ① | 700 | 0.40 | 0.10 | 0.09 |
| ② | 800 | 0.10 | 0.40 | 0.08 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A.该反应的反应物的总能量大于生成物的总能量 |
B.实验①中,若某时刻测得  ,则此时混合气体中 ,则此时混合气体中  的体积分数为8% 的体积分数为8% |
C.实验①和③中,反应均达到平衡时,平衡常数之比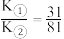 |
| D.实验④中,反应达到平衡时,CO的转化率为 60% |
您最近一年使用:0次