名校
1 .  恒容密闭容器中通入A、B各
恒容密闭容器中通入A、B各 ,在一定温度下进行反应:
,在一定温度下进行反应: ,
, ,
, 时达到平衡,生成
时达到平衡,生成 。下列说法不正确的是
。下列说法不正确的是
 恒容密闭容器中通入A、B各
恒容密闭容器中通入A、B各 ,在一定温度下进行反应:
,在一定温度下进行反应: ,
, ,
, 时达到平衡,生成
时达到平衡,生成 。下列说法不正确的是
。下列说法不正确的是A.①体系气体密度不变;②A的体积分数不变;③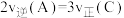 ,三种现象均可以说明该反应达到平衡 ,三种现象均可以说明该反应达到平衡 |
| B.①增加D的质量;②向体系中充入He;③抽出A减小体系压强,三种操作都不能增大逆反应速率 |
C.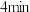 末时,C的平均反应速率为 末时,C的平均反应速率为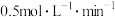 |
| D.保持其他条件不变,若换成1L的容器,平衡时A的转化率不变 |
您最近一年使用:0次
名校
2 . 已知化学反应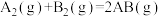 的能量变化如图所示,判断下列叙述中正确的是
的能量变化如图所示,判断下列叙述中正确的是
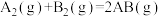 的能量变化如图所示,判断下列叙述中正确的是
的能量变化如图所示,判断下列叙述中正确的是
| A.每生成2分子AB吸收bkJ热量 |
B.该反应生成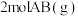 吸收的热量为 吸收的热量为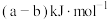 |
| C.该反应中反应物的总能量高于产物的总能量 |
D.断裂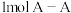 键和 键和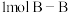 键,放出 键,放出 能量 能量 |
您最近一年使用:0次
3 . 有机物K是一种可用于肺癌治疗的药物。其一条合成路线如下: 。
。
回答下列问题:
(1)A的结构简式为___________ ,J中含氧官能团名称为___________ 。
(2)E与NaOH溶液反应的化学方程式为___________ 。
(3)反应①→⑤中属于取代反应的有___________ 个。
(4)设计A→B、C→D的目的是___________ 。
(5)符合下列条件的F的同分异构体有___________ 种,其中一种结构简式为___________ 。
(6)参照以上合成路线,以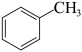 为原料设计
为原料设计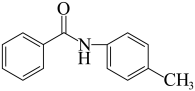 的合成路线
的合成路线___________ 。

ⅰ.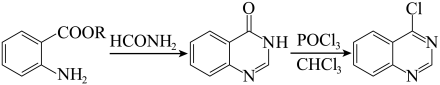 (R为烃基,下同)
(R为烃基,下同)
 。
。回答下列问题:
(1)A的结构简式为
(2)E与NaOH溶液反应的化学方程式为
(3)反应①→⑤中属于取代反应的有
(4)设计A→B、C→D的目的是
(5)符合下列条件的F的同分异构体有
①属于芳香族化合物,且不含有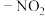 、
、 、
、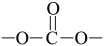 ;
;
(6)参照以上合成路线,以
 为原料设计
为原料设计 的合成路线
的合成路线
您最近一年使用:0次
名校
4 . 某镁铁合金是目前储氢密度最高的材料之一,其晶体的立方晶胞如图所示,晶胞边长为a pm。Mg原子占据Fe原子形成的所有四面体空隙。储氢后, 分子占据Fe原子形成的八面体空隙,化学式为
分子占据Fe原子形成的八面体空隙,化学式为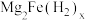 。下列说法正确的是
。下列说法正确的是
 分子占据Fe原子形成的八面体空隙,化学式为
分子占据Fe原子形成的八面体空隙,化学式为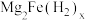 。下列说法正确的是
。下列说法正确的是
A.氢气储满后晶体的化学式为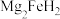 |
| B.该镁铁合金中Mg、Fe通过离子键结合 |
C.氢气储满后, 分子和 分子和 分子之间的最近距离为 分子之间的最近距离为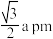 |
| D.该镁铁合金中,与1个Mg配位的Fe和与1个Fe配位的Mg均有4个 |
您最近一年使用:0次
2024-05-13更新
|
132次组卷
|
2卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
5 . 羰基硫(COS)存在于多种植物中,有显著的杀虫效果。它的结构与 、
、 相似,下列有关说法错误的是
相似,下列有关说法错误的是
 、
、 相似,下列有关说法错误的是
相似,下列有关说法错误的是| A.COS分子中的有2个σ键和2个π键 |
B. 、 、 和 和 分子中的键角均相等 分子中的键角均相等 |
| C.COS属于含有极性键的极性分子 |
D. 、COS、 、COS、 完全分解消耗的能量依次增大 完全分解消耗的能量依次增大 |
您最近一年使用:0次
2024-05-09更新
|
102次组卷
|
3卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
6 . 下列叙述中正确的
A. 区元素均有 区元素均有 轨道 轨道 |
| B.所有元素中,氟的第一电离能最大 |
| C.主族元素的电负性越大,其元素原子的第一电离能不一定越大 |
D.处于最低能量状态原子叫基态原子, 过程中形成的是吸收光谱 过程中形成的是吸收光谱 |
您最近一年使用:0次
2024-05-04更新
|
45次组卷
|
2卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
7 . 流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为 。
。
 。
。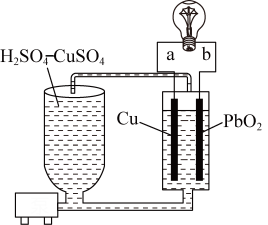
A. 为负极,a为正极 为负极,a为正极 |
B.该电池工作时,电流由电极a流向电极 |
C. 极的电极反应式为 极的电极反应式为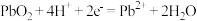 |
D.调节电解质溶液的方法是补充 |
您最近一年使用:0次
2024-04-29更新
|
165次组卷
|
2卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
8 . 从微粒结构角度分析,下列说法正确的是
A.三氧化硫有单分子气体和三聚分子固体(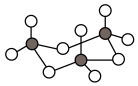 )两种存在形式,两种形式中S原子的杂化轨道类型相同 )两种存在形式,两种形式中S原子的杂化轨道类型相同 |
B. 中Al原子采用 中Al原子采用 杂化, 杂化, 离子的空间构型为平面正方形 离子的空间构型为平面正方形 |
C.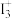 的空间结构为V形,中心原子的杂化方式为 的空间结构为V形,中心原子的杂化方式为 |
D. ( (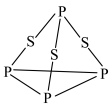 )中S和P原子最外层均满足8电子稳定结构 )中S和P原子最外层均满足8电子稳定结构 |
您最近一年使用:0次
2024-03-14更新
|
84次组卷
|
3卷引用:山东省威海一中2023-2024学年高一下学期5月期中考试化学试题
21-22高一·全国·课后作业
名校
9 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-02-22更新
|
79次组卷
|
6卷引用:山东省威海市文登新一中2021-2022学年高一上学期12月月考化学试题
山东省威海市文登新一中2021-2022学年高一上学期12月月考化学试题(已下线)第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河北省隆化存瑞中学2022-2023学年高一上学期第一次月考化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中质量检测化学试题黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题河南省周口市鹿邑县2023-2024学年高一上学期1月期末化学试题
10 . 氨是化肥工业的主要原料,其在国防、涂料等领域应用广泛。回答下列问题:
(1)合成氨反应 的活化能
的活化能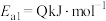 ,则氨分解反应
,则氨分解反应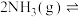
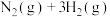 的活化能
的活化能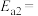
___________  (用含Q、a、b、c的关系式表示)。(已知相关化学键的键能数据如表所示)
(用含Q、a、b、c的关系式表示)。(已知相关化学键的键能数据如表所示)
(2)在体积为2L的密闭容器中充入1mol 和3mol
和3mol ,发生反应
,发生反应 。
。 、
、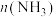 在
在 和
和 温度下的变化曲线如图所示。
温度下的变化曲线如图所示。
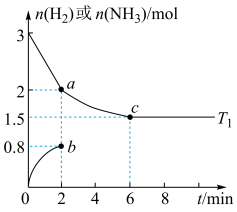
①在___________ (填“ ”“
”“ ”)温度下先达到平衡状态,判断的依据是
”)温度下先达到平衡状态,判断的依据是___________ 。
②a、b、c三点, 的转化率由大到小的顺序为
的转化率由大到小的顺序为___________ ,已知c点之后容器内的压强为P,且保持不变。合成氨反应在 温度下的
温度下的
___________ 。
(3)清华大学科研团队在电催化氮还原合成氨方面取得重大进展。两种条件下的反应历程如图甲所示。

①图乙对应的是图甲中的电催化___________ (填“Ⅰ”“Ⅱ”)。
②由图甲可见,不同历程中 的活化均为决速步骤,理由是
的活化均为决速步骤,理由是___________ 。
③碱性水溶液中,该电催化氮还原合成氨的电极反应式为___________ 。
(1)合成氨反应
 的活化能
的活化能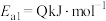 ,则氨分解反应
,则氨分解反应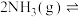
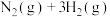 的活化能
的活化能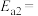
 (用含Q、a、b、c的关系式表示)。(已知相关化学键的键能数据如表所示)
(用含Q、a、b、c的关系式表示)。(已知相关化学键的键能数据如表所示)| 化学键 |  |  |  |
 | a | b | c |
(2)在体积为2L的密闭容器中充入1mol
 和3mol
和3mol ,发生反应
,发生反应 。
。 、
、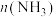 在
在 和
和 温度下的变化曲线如图所示。
温度下的变化曲线如图所示。
①在
 ”“
”“ ”)温度下先达到平衡状态,判断的依据是
”)温度下先达到平衡状态,判断的依据是②a、b、c三点,
 的转化率由大到小的顺序为
的转化率由大到小的顺序为 温度下的
温度下的
(3)清华大学科研团队在电催化氮还原合成氨方面取得重大进展。两种条件下的反应历程如图甲所示。

①图乙对应的是图甲中的电催化
②由图甲可见,不同历程中
 的活化均为决速步骤,理由是
的活化均为决速步骤,理由是③碱性水溶液中,该电催化氮还原合成氨的电极反应式为
您最近一年使用:0次



