解题方法
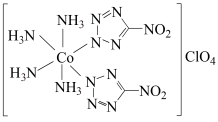
1 . 高性能炸药BNCP的结构如下所示,回答下列问题: 的基态价层电子排布图是
的基态价层电子排布图是_______ , 的配位数是
的配位数是_______ ,阴离子 的中心原子杂化类型是
的中心原子杂化类型是_______ 。
(2)
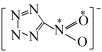 配体中的
配体中的 键的数目是
键的数目是_______ ,已知该配体是平面结构,图中标记的 原子与
原子与 原子之间的
原子之间的 键是由
键是由 原子的
原子的_______ 杂化轨道与O原子的_______ 轨道重叠形成的。
(3)比较 、
、 、
、 的键角大小:
的键角大小:_______ 。
(4)比较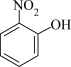 、
、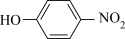 的沸点并说明理由:
的沸点并说明理由:_______ 。
(5)比较 与
与 的极性大小并说明理由:
的极性大小并说明理由:_______ 。
(6)2018年南京理工大学胡炳成团队合成全国首个全氮阴离子,全氮阴离子的盐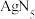 的晶体结构中:
的晶体结构中: 采取面心立方最密堆积,
采取面心立方最密堆积, 填在正四面体空隙中,从晶胞上方俯视的投影图如图所示。每个晶胞中含有的
填在正四面体空隙中,从晶胞上方俯视的投影图如图所示。每个晶胞中含有的 的数目是
的数目是_______ , 与
与 最近的距离是
最近的距离是_______ (用 表示)。
表示)。
 的基态价层电子排布图是
的基态价层电子排布图是 的配位数是
的配位数是 的中心原子杂化类型是
的中心原子杂化类型是(2)

 配体中的
配体中的 键的数目是
键的数目是 原子与
原子与 原子之间的
原子之间的 键是由
键是由 原子的
原子的(3)比较
 、
、 、
、 的键角大小:
的键角大小:(4)比较
 、
、 的沸点并说明理由:
的沸点并说明理由:(5)比较
 与
与 的极性大小并说明理由:
的极性大小并说明理由:(6)2018年南京理工大学胡炳成团队合成全国首个全氮阴离子,全氮阴离子的盐
 的晶体结构中:
的晶体结构中: 采取面心立方最密堆积,
采取面心立方最密堆积, 填在正四面体空隙中,从晶胞上方俯视的投影图如图所示。每个晶胞中含有的
填在正四面体空隙中,从晶胞上方俯视的投影图如图所示。每个晶胞中含有的 的数目是
的数目是 与
与 最近的距离是
最近的距离是 表示)。
表示)。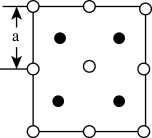
您最近一年使用:0次
2 . 回答下列问题:
(1)铅蓄电池的电池总反应式为:Pb+PbO2+4H++2SO
 2PbSO4+2H2O,当外电路通过1 mol电子时,理论上负极板的质量增加
2PbSO4+2H2O,当外电路通过1 mol电子时,理论上负极板的质量增加____ g。
(2)银锌电池电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。
(3)汽车发动机工作时会引发N2和O2反应,生成NOX等污染大气,其中生成NO的能量变化如图所示,若反应生成2molNO气体(填“吸收”或“放出”)________ 热量。___________ 口通入(填“A"或“B"),当外电路通过0.4mol的电子时,消耗O2的体积___________ L(标况下)。
(1)铅蓄电池的电池总反应式为:Pb+PbO2+4H++2SO

 2PbSO4+2H2O,当外电路通过1 mol电子时,理论上负极板的质量增加
2PbSO4+2H2O,当外电路通过1 mol电子时,理论上负极板的质量增加(2)银锌电池电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。
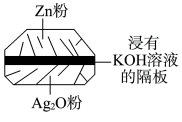
| A.在使用过程中,电解质KOH被不断消耗 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
(3)汽车发动机工作时会引发N2和O2反应,生成NOX等污染大气,其中生成NO的能量变化如图所示,若反应生成2molNO气体(填“吸收”或“放出”)


您最近一年使用:0次
名校
3 . 回答下列问题
(1)下列反应中,属于吸热反应的是___________ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥ 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol 过程中放出46kJ的热量。则
过程中放出46kJ的热量。则 的键能为
的键能为__________ kJ/mol。
(3)工业上可以通过 (g)与
(g)与 (g)反应制备
(g)反应制备 (g):
(g):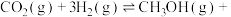
 △H<0
△H<0
①保持温度不变,向2L恒容密闭容器中充入2mol 和6mol
和6mol  ,能说明该反应已达平衡状态的是(填字母)
,能说明该反应已达平衡状态的是(填字母)__________ 。
a.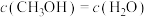 b.容器内压强保持不变
b.容器内压强保持不变
c.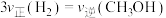
②在2L恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
0~5min内的平均反应速率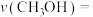
______ ;反应达平衡时,
_______ 。
③向恒容密闭容器中充入一定量 和
和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态), 的转化率随反应温度的变化如图所示。其中a点
的转化率随反应温度的变化如图所示。其中a点 的转化率高于b点的原因是
的转化率高于b点的原因是________________________ 。
(1)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥
 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol
 过程中放出46kJ的热量。则
过程中放出46kJ的热量。则 的键能为
的键能为(3)工业上可以通过
 (g)与
(g)与 (g)反应制备
(g)反应制备 (g):
(g):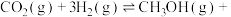
 △H<0
△H<0①保持温度不变,向2L恒容密闭容器中充入2mol
 和6mol
和6mol  ,能说明该反应已达平衡状态的是(填字母)
,能说明该反应已达平衡状态的是(填字母)a.
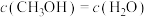 b.容器内压强保持不变
b.容器内压强保持不变c.
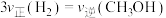
②在2L恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
反应时间 |
|
|
|
0min | 2 | 6 | 0 |
5min | 1 | ||
15min | 1.5 | ||
20min | 1.5 |
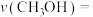

③向恒容密闭容器中充入一定量
 和
和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态), 的转化率随反应温度的变化如图所示。其中a点
的转化率随反应温度的变化如图所示。其中a点 的转化率高于b点的原因是
的转化率高于b点的原因是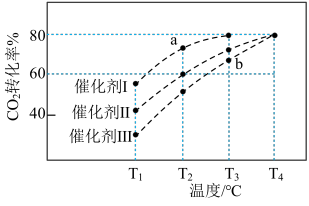
您最近一年使用:0次
解题方法
4 . 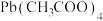 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为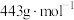 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有:
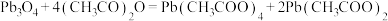
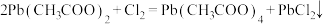
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为_______ 。
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是_______ 。
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为_______ (填仪器接口的小写字母),干燥管中碱石灰的作用是_______ ,步骤Ⅲ中,现象1为_______ 。 ,实验结束理论上可生成
,实验结束理论上可生成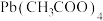 质量为
质量为_______ 。
(5)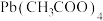 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是_______ ,实验前后,干燥管I质量增加 ,则样品的纯度为
,则样品的纯度为_______ 。
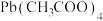 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为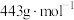 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有: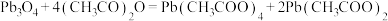
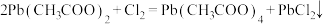
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入
 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到
 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为

 ,实验结束理论上可生成
,实验结束理论上可生成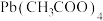 质量为
质量为(5)
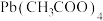 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是 ,则样品的纯度为
,则样品的纯度为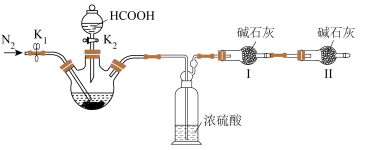
您最近一年使用:0次
5 . 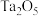 和
和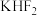 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数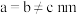 ,
, ,
, 键键长为
键键长为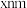 。下列说法错误的是
。下列说法错误的是
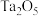 和
和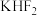 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数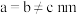 ,
, ,
, 键键长为
键键长为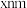 。下列说法错误的是
。下列说法错误的是
A.制备晶体的化学方程式: |
B.O原子分数坐标可能为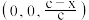 , ,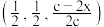 |
C.与棱心 等距且紧邻的 等距且紧邻的 有8个 有8个 |
D.该晶体密度为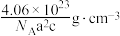 |
您最近一年使用:0次
6 . 乙酸水蒸气重整制氢气是一项极具前景的制氢工艺,该过程中发生下列反应:
反应Ⅰ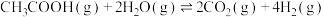

反应Ⅱ

回答下列问题:
(1)已知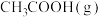 和
和 的燃料热分别为
的燃料热分别为 、
、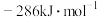 ,18g气态水转化为液态水释放出44kJ的能量,则
,18g气态水转化为液态水释放出44kJ的能量,则
______ ,反应Ⅰ在______ 条件下能自发进行。
(2)已知:水碳比(S/C)是指转化进料中水蒸气分子总数与碳原子总数的比值,水碳比(S/C)分别为2和4时,反应温度对 平衡产率的影响如图所示:
平衡产率的影响如图所示: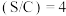 的曲线是
的曲线是______ (填“a”或“b”),水碳比 时,
时, 平衡产率随温度升高先增大后逐渐减小,
平衡产率随温度升高先增大后逐渐减小, 平衡产率逐渐减小的原因可能是
平衡产率逐渐减小的原因可能是______ 。
(3)已知:S表示选择性, ;在
;在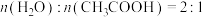 时,1MPa下,平衡时
时,1MPa下,平衡时 和
和 随温度的变化;350℃下,平衡时
随温度的变化;350℃下,平衡时 和
和 随压强的变化均如图2所示。平衡常数随温度变化如图3所示。
随压强的变化均如图2所示。平衡常数随温度变化如图3所示。
 选择性随压强变化的曲线是
选择性随压强变化的曲线是______ (填字母)。
②图中B、C、D、M、N、P、Q7个点中与A点处于相同化学平衡状态的点有______ 个。
③在一定温度和压强下,向容积可变的密闭容器中通入2mol 和1mol
和1mol ,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的
,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的
______ (保留2位有效数字)。
反应Ⅰ
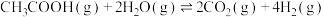

反应Ⅱ


回答下列问题:
(1)已知
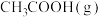 和
和 的燃料热分别为
的燃料热分别为 、
、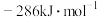 ,18g气态水转化为液态水释放出44kJ的能量,则
,18g气态水转化为液态水释放出44kJ的能量,则
(2)已知:水碳比(S/C)是指转化进料中水蒸气分子总数与碳原子总数的比值,水碳比(S/C)分别为2和4时,反应温度对
 平衡产率的影响如图所示:
平衡产率的影响如图所示:
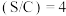 的曲线是
的曲线是 时,
时, 平衡产率随温度升高先增大后逐渐减小,
平衡产率随温度升高先增大后逐渐减小, 平衡产率逐渐减小的原因可能是
平衡产率逐渐减小的原因可能是(3)已知:S表示选择性,
 ;在
;在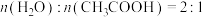 时,1MPa下,平衡时
时,1MPa下,平衡时 和
和 随温度的变化;350℃下,平衡时
随温度的变化;350℃下,平衡时 和
和 随压强的变化均如图2所示。平衡常数随温度变化如图3所示。
随压强的变化均如图2所示。平衡常数随温度变化如图3所示。
 选择性随压强变化的曲线是
选择性随压强变化的曲线是②图中B、C、D、M、N、P、Q7个点中与A点处于相同化学平衡状态的点有
③在一定温度和压强下,向容积可变的密闭容器中通入2mol
 和1mol
和1mol ,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的
,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的
您最近一年使用:0次
名校
7 . 一定温度下,向 、
、 均为0.01 mol/L的混合溶液中持续通入CO2,始终保持CO2分压固定,体系中
均为0.01 mol/L的混合溶液中持续通入CO2,始终保持CO2分压固定,体系中 关系如图所示。其中,c表示
关系如图所示。其中,c表示 、
、 、
、 、
、 、
、 的浓度。已知
的浓度。已知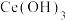 的
的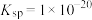 。下列说法正确的是
。下列说法正确的是
 、
、 均为0.01 mol/L的混合溶液中持续通入CO2,始终保持CO2分压固定,体系中
均为0.01 mol/L的混合溶液中持续通入CO2,始终保持CO2分压固定,体系中 关系如图所示。其中,c表示
关系如图所示。其中,c表示 、
、 、
、 、
、 、
、 的浓度。已知
的浓度。已知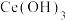 的
的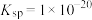 。下列说法正确的是
。下列说法正确的是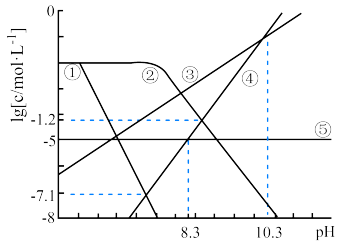
A.③代表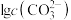 与pH的关系曲线 与pH的关系曲线 |
B.pH逐渐增大时,溶液中优先析出的沉淀为 |
C.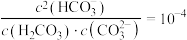 |
D.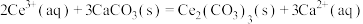 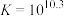 |
您最近一年使用:0次
2024-05-16更新
|
194次组卷
|
2卷引用:2024届山东省济宁市高三下学期高考二模化学试题
解题方法
8 . 二氯异氰尿酸钠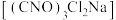 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为______ ,装置D中,盛放 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为______ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到______ 时,关闭 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式______ ,制备过程中要不断通入 ,其目的是
,其目的是______ ,反应完成后需进行的操作为______
③取装置D中溶液,制得产品。操作为______ 、过滤、冷水洗涤、低温干燥得到粗产品
(3)粗产品中 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用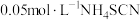 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]
① 的纯度为
的纯度为______ 。
②下列有关上述滴定操作的说法正确的是______ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
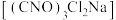 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示: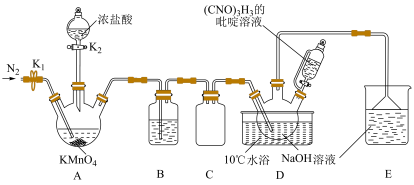
(1)装置B中试剂为
 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭
 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式 ,其目的是
,其目的是③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用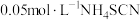 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]①
 的纯度为
的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放
 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
名校
9 . (一)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和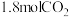 ,在不同温度下反应的过程如下图所示:
,在不同温度下反应的过程如下图所示:
________ 。
(2)反应速率::A点________ B点,A点________ C点(填“<”“>”或“=”)。
(3)乙容器中C点时, 的物质的量百分数为
的物质的量百分数为________ 。
(二)一定条件下,在容积为2L的密闭容器中进发生反应: ,测得四种不同情况下的反应速率分别为①
,测得四种不同情况下的反应速率分别为①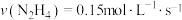 ②
② ③
③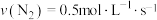 ④
④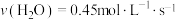
(4)则反应速率由快到慢的顺序为________ ,改变下列条件能够加快该化学反应速率的是________ 。
a.充入氖气,使压强增大 b.增大氧气的浓度
c.将容器的体积变为3L d.升高体系温度
(三)为比较和对分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。 比
比 对
对 分解催化效果好,丙同学认为甲同学的结论不正确,请说明理由
分解催化效果好,丙同学认为甲同学的结论不正确,请说明理由________ 。
(6)改进后,用图乙装置测定反应速率,需要测定的数据为________ 。
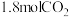 ,在不同温度下反应的过程如下图所示:
,在不同温度下反应的过程如下图所示:

(2)反应速率::A点
(3)乙容器中C点时,
 的物质的量百分数为
的物质的量百分数为(二)一定条件下,在容积为2L的密闭容器中进发生反应:
 ,测得四种不同情况下的反应速率分别为①
,测得四种不同情况下的反应速率分别为①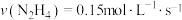 ②
② ③
③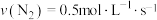 ④
④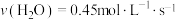
(4)则反应速率由快到慢的顺序为
a.充入氖气,使压强增大 b.增大氧气的浓度
c.将容器的体积变为3L d.升高体系温度
(三)为比较和对分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。

 比
比 对
对 分解催化效果好,丙同学认为甲同学的结论不正确,请说明理由
分解催化效果好,丙同学认为甲同学的结论不正确,请说明理由(6)改进后,用图乙装置测定反应速率,需要测定的数据为
您最近一年使用:0次
2024-04-19更新
|
208次组卷
|
2卷引用:山东省济宁市邹城市2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
10 . 亚硝酰氯(NOCl)是有机物合成中的重要试剂,熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物。NOCl可由NO与Cl2在通常条件下反应得到,相关实验装置如图所示。
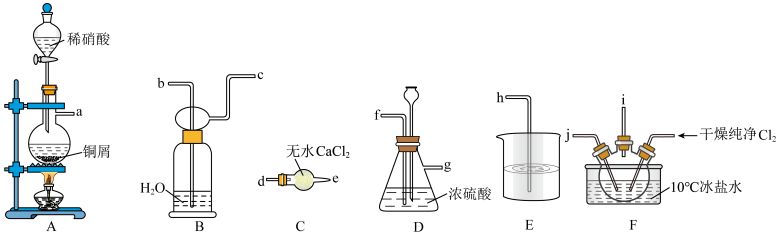
回答下列问题:
(1)装置的连接顺序为a→___________ →h,实验时先打开分液漏斗活塞滴入稀硝酸,当观察到F中___________ 时,开始向装置中通入Cl2。
(2)装置D的作用有:根据气泡快慢调节气体流速、___________ 、___________ 。
(3)尾气处理装置中若用NaOH溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:___________ 。
(4)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:
a.将所得亚硝酰氯(NOCl)产品7.0g溶于水,配制成250mL溶液;取出25.00mL,加入足量的30.00mL0.5mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.5mol/LNH4SCN溶液的体积平均为10.00mL。
已知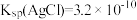 ,
,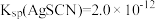
①加入硝基苯覆盖沉淀表面的目的是___________ 。
②滴定选用的指示剂是___________ 。
A.FeCl3 B.FeCl2 C.NH4Fe(SO4)2 D.(NH4)2Fe(SO4)2
③NOCl的纯度为___________ 。
④若读取NH4SCN标准溶液体积时滴定前仰视,滴定后读数正确,可能导致测定结果___________ (填“偏高”“偏低”或“不变”)。

回答下列问题:
(1)装置的连接顺序为a→
(2)装置D的作用有:根据气泡快慢调节气体流速、
(3)尾气处理装置中若用NaOH溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:
(4)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:
a.将所得亚硝酰氯(NOCl)产品7.0g溶于水,配制成250mL溶液;取出25.00mL,加入足量的30.00mL0.5mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.5mol/LNH4SCN溶液的体积平均为10.00mL。
已知
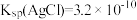 ,
,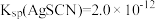
①加入硝基苯覆盖沉淀表面的目的是
②滴定选用的指示剂是
A.FeCl3 B.FeCl2 C.NH4Fe(SO4)2 D.(NH4)2Fe(SO4)2
③NOCl的纯度为
④若读取NH4SCN标准溶液体积时滴定前仰视,滴定后读数正确,可能导致测定结果
您最近一年使用:0次



