名校
解题方法
1 . 亚硝酰氯(NOCl)是有机物合成中的重要试剂,熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物。NOCl可由NO与Cl2在通常条件下反应得到,相关实验装置如图所示。
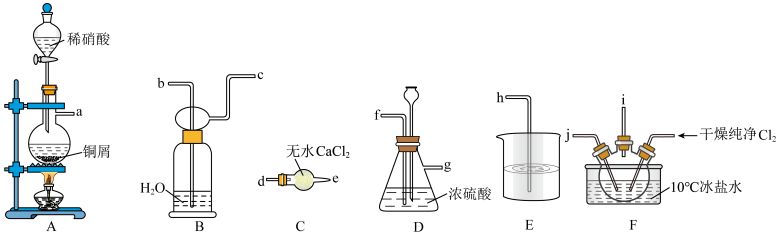
回答下列问题:
(1)装置的连接顺序为a→___________ →h,实验时先打开分液漏斗活塞滴入稀硝酸,当观察到F中___________ 时,开始向装置中通入Cl2。
(2)装置D的作用有:根据气泡快慢调节气体流速、___________ 、___________ 。
(3)尾气处理装置中若用NaOH溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:___________ 。
(4)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:
a.将所得亚硝酰氯(NOCl)产品7.0g溶于水,配制成250mL溶液;取出25.00mL,加入足量的30.00mL0.5mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.5mol/LNH4SCN溶液的体积平均为10.00mL。
已知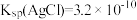 ,
,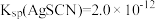
①加入硝基苯覆盖沉淀表面的目的是___________ 。
②滴定选用的指示剂是___________ 。
A.FeCl3 B.FeCl2 C.NH4Fe(SO4)2 D.(NH4)2Fe(SO4)2
③NOCl的纯度为___________ 。
④若读取NH4SCN标准溶液体积时滴定前仰视,滴定后读数正确,可能导致测定结果___________ (填“偏高”“偏低”或“不变”)。

回答下列问题:
(1)装置的连接顺序为a→
(2)装置D的作用有:根据气泡快慢调节气体流速、
(3)尾气处理装置中若用NaOH溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:
(4)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:
a.将所得亚硝酰氯(NOCl)产品7.0g溶于水,配制成250mL溶液;取出25.00mL,加入足量的30.00mL0.5mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.5mol/LNH4SCN溶液的体积平均为10.00mL。
已知
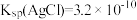 ,
,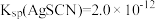
①加入硝基苯覆盖沉淀表面的目的是
②滴定选用的指示剂是
A.FeCl3 B.FeCl2 C.NH4Fe(SO4)2 D.(NH4)2Fe(SO4)2
③NOCl的纯度为
④若读取NH4SCN标准溶液体积时滴定前仰视,滴定后读数正确,可能导致测定结果
您最近一年使用:0次
名校
解题方法
2 . 实验室利用苯甲腈( ,
, )和三氟乙醇(
)和三氟乙醇( ,
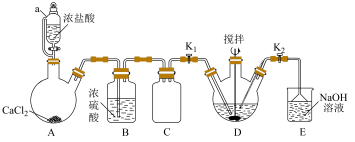
, )制备苯甲亚胺三氟乙酯的装置(加热及夹持装置略)如图所示。
)制备苯甲亚胺三氟乙酯的装置(加热及夹持装置略)如图所示。
已知:Ⅰ.制备原理: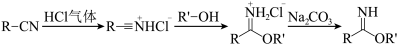 (R、R'=烃基);
(R、R'=烃基);
Ⅱ.苯甲腈、三氟乙醇、苯甲亚胺三氟乙酯均为液体,苯甲亚胺三氟乙酯受热易分解。
回答下列问题:
(1)组装好装置并检查装置气密性,再向A中加入足量无水 ,D中加入20.6g苯甲腈和21.6g三氟乙醇并用冰浴降温至0℃,仪器a的名称为
,D中加入20.6g苯甲腈和21.6g三氟乙醇并用冰浴降温至0℃,仪器a的名称为___________ ,装置C的作用是___________ 。
(2)向D中持续通入 一段时间后关闭
一段时间后关闭 、
、 ,继续搅拌反应液使充分反应,冷却至0℃,抽滤得白色固体,用乙腈洗涤2~3次,白色固体主要成分的结构简式为
,继续搅拌反应液使充分反应,冷却至0℃,抽滤得白色固体,用乙腈洗涤2~3次,白色固体主要成分的结构简式为___________ ,洗涤的方法是___________ 。
(3)将洗涤后的白色固体加入饱和 溶液中,低温下反应,有机溶剂萃取3次,合并有机相,向有机相中加入无水
溶液中,低温下反应,有机溶剂萃取3次,合并有机相,向有机相中加入无水 ,过滤,与溶剂分离后得产品20.3g。
,过滤,与溶剂分离后得产品20.3g。
①萃取时可选用的有机溶剂是___________ (填标号)。
a.甲醇 b.乙酸 c.乙酸乙酯 d.丙酮
②无水 的作用是
的作用是___________ ,产品与溶剂分离的操作的名称是___________ ,本实验的产率为___________ 。
 ,
, )和三氟乙醇(
)和三氟乙醇( ,
, )制备苯甲亚胺三氟乙酯的装置(加热及夹持装置略)如图所示。
)制备苯甲亚胺三氟乙酯的装置(加热及夹持装置略)如图所示。
已知:Ⅰ.制备原理:
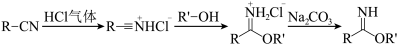 (R、R'=烃基);
(R、R'=烃基);Ⅱ.苯甲腈、三氟乙醇、苯甲亚胺三氟乙酯均为液体,苯甲亚胺三氟乙酯受热易分解。
回答下列问题:
(1)组装好装置并检查装置气密性,再向A中加入足量无水
 ,D中加入20.6g苯甲腈和21.6g三氟乙醇并用冰浴降温至0℃,仪器a的名称为
,D中加入20.6g苯甲腈和21.6g三氟乙醇并用冰浴降温至0℃,仪器a的名称为(2)向D中持续通入
 一段时间后关闭
一段时间后关闭 、
、 ,继续搅拌反应液使充分反应,冷却至0℃,抽滤得白色固体,用乙腈洗涤2~3次,白色固体主要成分的结构简式为
,继续搅拌反应液使充分反应,冷却至0℃,抽滤得白色固体,用乙腈洗涤2~3次,白色固体主要成分的结构简式为(3)将洗涤后的白色固体加入饱和
 溶液中,低温下反应,有机溶剂萃取3次,合并有机相,向有机相中加入无水
溶液中,低温下反应,有机溶剂萃取3次,合并有机相,向有机相中加入无水 ,过滤,与溶剂分离后得产品20.3g。
,过滤,与溶剂分离后得产品20.3g。①萃取时可选用的有机溶剂是
a.甲醇 b.乙酸 c.乙酸乙酯 d.丙酮
②无水
 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
3 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: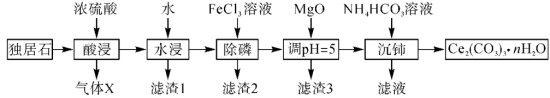
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
4 . B、C、N、O、F是重要的非金属元素,在日常生活和化工生产中有广泛的应用。回答下列问题:
(1)C、N、O的第三电离能由大到小的顺序是_______ ,电负性由大到小的顺序是_______ 。
(2)三氟化硼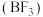 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是_______ 。
(3)已知: 中存在大π键:
中存在大π键: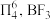 中
中 键的键能是
键的键能是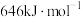 ,而
,而 中
中 键的键能仅
键的键能仅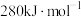 。
。 的分子构型是
的分子构型是_______ ; 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是_______ 。
(4)亚肼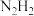 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和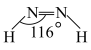 。试推测在水中的溶解度:
。试推测在水中的溶解度:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
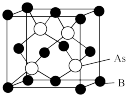
(5)超高热导率半导体材料一砷化硼 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为_______  (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
(1)C、N、O的第三电离能由大到小的顺序是
(2)三氟化硼
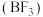 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是(3)已知:
 中存在大π键:
中存在大π键: 中
中 键的键能是
键的键能是 ,而
,而 中
中 键的键能仅
键的键能仅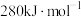 。
。 的分子构型是
的分子构型是 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是(4)亚肼
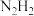 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和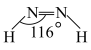 。试推测在水中的溶解度:
。试推测在水中的溶解度:
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(5)超高热导率半导体材料一砷化硼
 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为 (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
名校
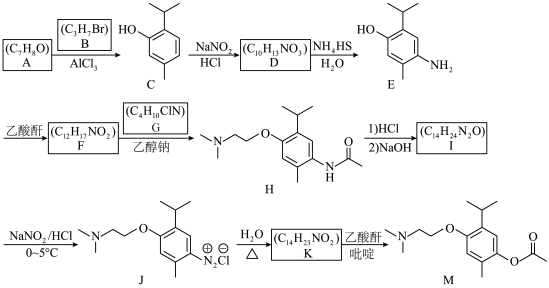
5 . 有机物M是一种用于治疗脑血管意外后遗症的药物。下列路线可用于合成该有机物,回答下列问题。 (乙酸酐)
(乙酸酐)
(1)B的化学名称为___________ 。
(2)I的结构简式为___________ ;F→H的反应类型为___________ 。
(3)F中含氧官能团的名称为___________ 。
(4)K→M的化学方程式为___________ 。
(5)符合下列条件D的同分异构体有___________ 种(不考虑立体异构)。
①属于芳香族化合物;②含有硝基;③含有手性碳原子。
(6)参照上述信息,写出以苯酚、1—溴丙烷为原料合成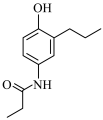 的路线
的路线_____ 。
 (乙酸酐)
(乙酸酐)(1)B的化学名称为
(2)I的结构简式为
(3)F中含氧官能团的名称为
(4)K→M的化学方程式为
(5)符合下列条件D的同分异构体有
①属于芳香族化合物;②含有硝基;③含有手性碳原子。
(6)参照上述信息,写出以苯酚、1—溴丙烷为原料合成
 的路线
的路线
您最近一年使用:0次
2024-02-02更新
|
469次组卷
|
5卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
真题
名校
6 . 锆 是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,
是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞,
是重要的战略金属,可从其氧化物中提取。下图是某种锆的氧化物晶体的立方晶胞, 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是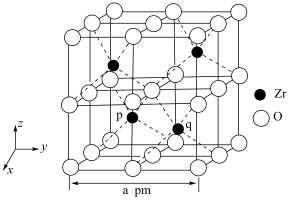
A.该氧化物的化学式为 |
B.该氧化物的密度为 |
C. 原子之间的最短距离为 原子之间的最短距离为 |
D.若坐标取向不变,将p点 原子平移至原点,则q点 原子平移至原点,则q点 原子位于晶胞 原子位于晶胞 面的面心 面的面心 |
您最近一年使用:0次
2023-11-29更新
|
5145次组卷
|
10卷引用:山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题江西省宜春市高安市灰埠中学2023-2024学年高三上学期11月期中化学试题(已下线)选择题11-14(已下线)微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题2023年河北省高考化学试卷四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷(已下线)选择题11-14
解题方法
7 . 某元素X的原子序数为a,能够形成Xm+,另一种元素Y能够形成与Xm+具有相同电子层结构的Yn-,则Y元素的质子数是
| A.a+m-n | B.a+m+n | C.a-m-n | D.a-m+n |
您最近一年使用:0次
解题方法
8 . CO2资源化利用有助于实现“双碳目标”。选择不同条件,利用CO2和H2可获得甲醇、甲醛等多种有机物。回答下列问题:
(1)CO2电催化还原制甲醇的反应为
 ,该反应需通过以下两步来实现:
,该反应需通过以下两步来实现:
Ⅰ.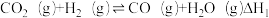
Ⅱ.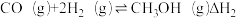
①反应过程中各物质的相对能量变化情况如图所示。
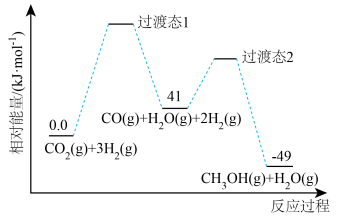
△H2=___________ 。
②若反应 的
的 ,下列温度下能自发进行的是
,下列温度下能自发进行的是___________ (填标号)。
A.5℃ B.10℃ C.50℃ D.500℃
③按照n(CO2):n(H2)=1:3投料,在恒容密闭容器中进行反应,CO2的平衡转化率随温度和压强的变化如图所示。
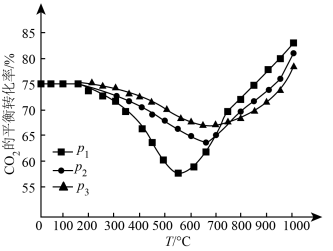
则压强p1、p2、p3由大到小的顺序为___________ 。p2压强下,温度高于670℃之后,随着温度升高,CO2的平衡转化率增大,原因是___________ 。
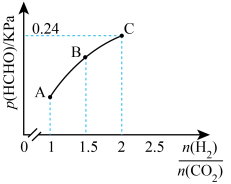
(2)T℃时,向2L恒容密闭容器中充入一定量的CO2和H2,使初始压强为1.2kPa.在催化条件下发生反应: 。反应达到平衡时,HCHO(g)的分压[p(HCHO]与起始时
。反应达到平衡时,HCHO(g)的分压[p(HCHO]与起始时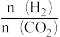 的关系如图所示。当起始时
的关系如图所示。当起始时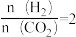 ,反应达到平衡时,平衡常数Kp=
,反应达到平衡时,平衡常数Kp=___________ (kPa)-1(保留1位小数)。反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使两者分压均增大0.05kPa,则达到新平衡时,H2的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)甲醇催化制取丙烯(C3H6)的过程中发生如下反应:
Ⅰ.
Ⅱ.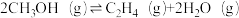
反应I的Arrhenius经验公式的实验数据如图中直线a所示,已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=___________ kJ·mol-1.当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是___________ 。

(1)CO2电催化还原制甲醇的反应为
 ,该反应需通过以下两步来实现:
,该反应需通过以下两步来实现:Ⅰ.
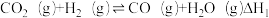
Ⅱ.
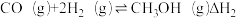
①反应过程中各物质的相对能量变化情况如图所示。

△H2=
②若反应
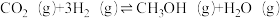 的
的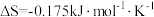 ,下列温度下能自发进行的是
,下列温度下能自发进行的是A.5℃ B.10℃ C.50℃ D.500℃
③按照n(CO2):n(H2)=1:3投料,在恒容密闭容器中进行反应,CO2的平衡转化率随温度和压强的变化如图所示。

则压强p1、p2、p3由大到小的顺序为
(2)T℃时,向2L恒容密闭容器中充入一定量的CO2和H2,使初始压强为1.2kPa.在催化条件下发生反应:
 。反应达到平衡时,HCHO(g)的分压[p(HCHO]与起始时
。反应达到平衡时,HCHO(g)的分压[p(HCHO]与起始时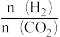 的关系如图所示。当起始时
的关系如图所示。当起始时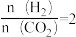 ,反应达到平衡时,平衡常数Kp=
,反应达到平衡时,平衡常数Kp=
(3)甲醇催化制取丙烯(C3H6)的过程中发生如下反应:
Ⅰ.

Ⅱ.
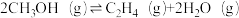
反应I的Arrhenius经验公式的实验数据如图中直线a所示,已知Arrhenius经验公式为
 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
名校
解题方法
9 . 化学反应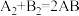 的能量变化如图所示,则下列说法正确的是
的能量变化如图所示,则下列说法正确的是
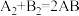 的能量变化如图所示,则下列说法正确的是
的能量变化如图所示,则下列说法正确的是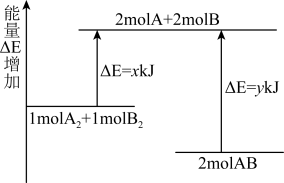
| A.该反应是吸热反应 |
B.断裂 键和 键和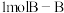 键能放出 键能放出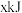 的能量 的能量 |
C.断裂 键需要吸收ykJ的能量 键需要吸收ykJ的能量 |
D.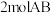 的总能量高于1molA2和1molB2的总能量 的总能量高于1molA2和1molB2的总能量 |
您最近一年使用:0次
2023-05-15更新
|
924次组卷
|
11卷引用:山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题
山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题广东省广州市玉岩中学2022-2023学年高一下学期期中考试化学试题安徽省六安第二中学2022-2023学年高一下学期期中考试化学试题江西省九江市德安县第一中学2022-2023学年高一下学期5月期中考试化学试题测试-选择性必修1第一章第一节第1课时黑龙江省哈尔滨市第三中学2022-2023学年高一下学期学业水平强化模拟考试化学试题第1课时 反应热 焓变黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期6月考试化学试题宁夏石嘴山市第三中学2022-2023学年高二下学期期末理科化学试题广东省佛山市顺德区桂洲中学2023-2024学年高一下学期第一次联考模拟化学试题 广东省广州市天河中学2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
10 . 我国稀土产业发达,利用稀土元素制备新型电池材料是一个潜在的研究热点。铈(元素符号为Ce)是最重要的稀土元素之一,以氟碳铈矿(假设只含 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:

提示:稀土元素离子易与 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。
请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因__________________ 。
(2)滤渣A的主要成分是 和
和______ (填化学式)。
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:
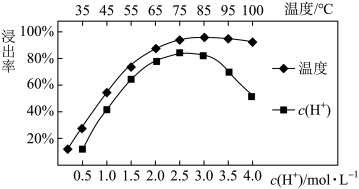
应选择的适宜条件为______ 。硫酸浓度过大时,浸出率降低的原因是______ 。
(4)在进行步骤③时,应该特别注意的问题是_____________________ 。
(5)写出步骤⑤中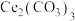 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式__________________ 。
 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:
提示:稀土元素离子易与
 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因
(2)滤渣A的主要成分是
 和
和(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:

应选择的适宜条件为
(4)在进行步骤③时,应该特别注意的问题是
(5)写出步骤⑤中
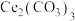 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式
您最近一年使用:0次



