名校
解题方法
1 . 1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
| A.C>D>B>A | B.D>B>A>C | C.A>D>C>B | D.B>A>C>D |
您最近一年使用:0次
2024-04-13更新
|
35次组卷
|
23卷引用:吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题
吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题2015-2016学年贵州省遵义一中高一下第二次联考化学试卷河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题步步为赢 初高中衔接教材化学暑假作业:第1课时 人类对原子结构的认识云南省广南县二中2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律章末综合检测卷湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题江苏省盐城市响水中学2020-2021学年高一上学期期中考试化学试题(已下线)4.1.1 原子结构 元素周期表 核素(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省如皋中学2020-2021学年高一上学期第二次阶段考试化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题甘肃省张掖市2021-2022学年高一上学期期末学业水平质量检测化学试题(已下线)易错专题26 原子的构成-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)第一节 原子结构与元素周期表 第1课时 原子结构 核素山东省菏泽市郓城县第一中学2021-2022学年高一下学期3月阶段性检测化学试题宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题江苏省邳州市宿羊山高级中学2021-2022学年高一上学期第二次学情检测化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题北京市第一六六中学2022-2023学年高一上学期期末考试化学试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
2 . 为检测某品牌银耳中添加剂亚硫酸盐的含量,取 银耳样品和
银耳样品和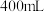 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了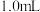 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是
 银耳样品和
银耳样品和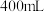 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了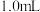 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是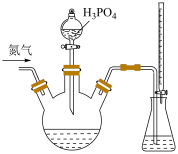
A.选择的三颈瓶规格为 |
| B.滴定终点溶液变为蓝色,读数时应双手上下持滴定管 |
| C.“不通氮气”或者“先加磷酸再通氮气”,这两种做法都会使测定结果偏高 |
D.银耳样品中亚硫酸盐的百分含量(以 质量计)为 质量计)为 |
您最近一年使用:0次
2024-02-06更新
|
360次组卷
|
5卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
解题方法
3 . 某无色溶液可能由Na+、Ba2+、Cu2+、 、
、 、
、 、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。
下列关于原溶液说法正确的是
 、
、 、
、 、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。
下列关于原溶液说法正确的是
A.肯定存在 |
| B.肯定不存在 Ba2+,可能存在Cu2+ |
C. 、 、 均不存在 均不存在 |
| D.是否存在Na+需要通过焰色试验来确定 |
您最近一年使用:0次
2024-02-02更新
|
127次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
4 . 建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOx)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案1:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ∆H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) ∆H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是___________ 。
(2)方案2:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H.向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
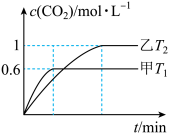
①甲容器中,平衡时NO2的转化率为___________ ;
②T1___________ T2(填“>”或“<”);△H___________ 0(填“>”或“<”)
(3)方案3:用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。
①实际生产中NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是___________ 。
②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=___________ mol·L-1·min-1,500℃时该反应的平衡常数Kp=___________ MPa(用含p0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(4)方案4:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为___________ 。
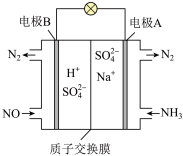
(1)方案1:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) ∆H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ∆H2=-574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) ∆H3=-1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是
(2)方案2:利用CO在催化剂条件下还原NOx:2NOx(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H.向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为
②T1
(3)方案3:用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。①实际生产中NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=
(4)方案4:可以利用原电池原理处理氮氧化合物,原理如图。则其正极的电极反应式为

您最近一年使用:0次
5 . 下列说法正确的是
| A.麦芽糖的水解产物不能发生银镜反应 |
| B.植物油中含碳碳不饱和键,硬化后可用于生产人造奶油 |
| C.脱氧核糖核酸充分水解后得到磷酸、脱氧核糖和5种碱基 |
| D.蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,加水不溶解 |
您最近一年使用:0次
2023-07-20更新
|
176次组卷
|
5卷引用:吉林省长春市朝阳区长春市第十七中学2022-2023学年高三下学期开学化学试题
吉林省长春市朝阳区长春市第十七中学2022-2023学年高三下学期开学化学试题吉林省长春市第五中学2022-2023学年高二下学期第三学程(期末)化学试题吉林省长春市实验中学2022-2023学年高二下学期期末考试化学试题(已下线)综合02 有机化学基础压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)专题07 生物大分子 合成高分子-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
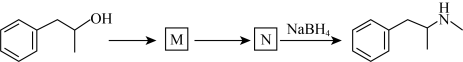
6 . 加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如下。
(1)A中与卤代烃成醚活性高的羟基位于酯基的_______ 位(填“间”或“对”)。
(2)C发生酸性水解,新产生的官能团为羟基和_______ (填名称)。
(3)用O2代替PCC完成D→E的转化,化学方程式为_______ 。
(4)F的同分异构体中,红外光谱显示有酚羟基、无N-H键的共有_______ 种。
(5)H→I的反应类型为_______ 。
(6)某药物中间体的合成路线如下(部分反应条件已略去),其中M和N的结构简式分别为_______ 和_______ 。
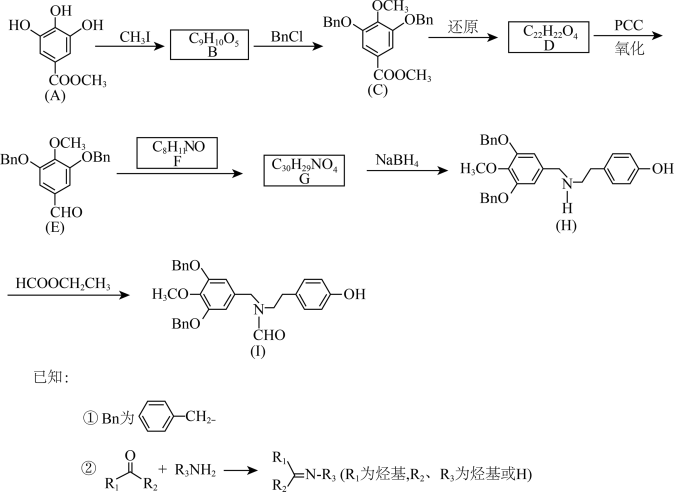
(1)A中与卤代烃成醚活性高的羟基位于酯基的
(2)C发生酸性水解,新产生的官能团为羟基和
(3)用O2代替PCC完成D→E的转化,化学方程式为
(4)F的同分异构体中,红外光谱显示有酚羟基、无N-H键的共有
(5)H→I的反应类型为
(6)某药物中间体的合成路线如下(部分反应条件已略去),其中M和N的结构简式分别为
您最近一年使用:0次
2023-06-13更新
|
12425次组卷
|
23卷引用:吉林省长春市朝阳区长春市第十七中学2022-2023学年高三下学期开学化学试题
吉林省长春市朝阳区长春市第十七中学2022-2023学年高三下学期开学化学试题吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题2023年高考辽宁卷化学真题(已下线)T19-有机综合题(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)第22练 有机合成与推断题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)T25-有机化学基础(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)有机化学基础(已下线)专题17 有机化学基础综合题-2023年高考化学真题题源解密(全国通用)福建省晋江市平山学校,泉州中远学校,晋江市内坑中学,晋江市磁灶中学,永春第二中学2022-2023学年高二下学期期末联考化学试题(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷(已下线)题型四 有机物的综合推断-备战2024年高考化学答题技巧与模板构建湖北省沙市中学2023-2024学年高三下学期3月月考化学试题福建泉州科技中学2022-2023学年高二下学期期末考化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题(已下线)测试辽宁化学 请勿下载(已下线)T18-有机推断题
名校
解题方法
7 . 判断下列说法不正确的是
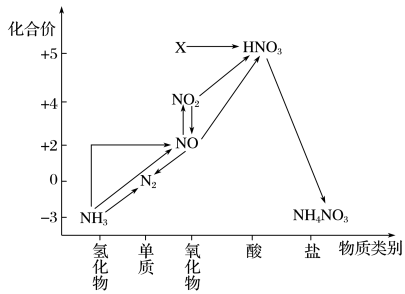
| A.X是N2O5 |
| B.可用排空气法收集NO气体 |
| C.工业上以NH3、空气、水为原料生产硝酸 |
| D.由NH3→N2,从原理上看,NH3可与NO2反应实现 |
您最近一年使用:0次
2023-05-11更新
|
533次组卷
|
29卷引用:吉林省梅河口市第五中学2023-2024学年高二上学期开学考试化学试题
吉林省梅河口市第五中学2023-2024学年高二上学期开学考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)(已下线)【浙江新东方】98专题7 专题强化练3 氮及其化合物的性质与转化-高中化学必修第二册苏教版2019陕西省宝鸡市渭滨区2020-2021学年高一上学期期末考试化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(一)化学试题江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题辽宁省葫芦岛市普通高中2021-2022学年高一下学期期末学业质量监测化学试题甘肃省永昌县第一高级中学2021-2022学年高一下学期期末考试化学试题江苏省常熟市2021-2022学年高一下学期期中考试化学试题广东省广州市第二中学2021-2022学年高一下学期期末考试化学试题(已下线)第12讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省郑州市第七高级中学2022-2023 学年高一上学期期末考试化学试题宁夏银川市第二中学2022-2023学年高一下学期第一次月考化学试题江苏省南京市协同体七校2022-2023学年高一下学期期中联合考试化学试题山西省阳泉市第一中学校2022-2023学年高一下学期期中考试化学试题陕西省西安市第八十五中学2022-2023学年高一下学期期中考试化学试题安徽省合肥市庐巢八校联考2022-2023学年高一下学期5月期中化学试题广东省广州市真光中学2022-2023学年高一下学期5月月考化学试题宁夏银川市贺兰县第一中学2022-2023学年高一下学期期中考试化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期末考试化学试题四川省成都石室蜀都中学2022-2023学年高一下学期期末考试化学试题云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期9月月考化学试题湖北省襄阳市第一中学2023-2024学年高一下学期3月月考化学试题福建省德化第一中学2024-2024学年高一下学期第一次月考化学试题福建省福州第四中学2023-2024学年高一下学期期中考试化学试卷宁夏青铜峡市宁朔中学2023-2024学年高一下学期期中考试化学试题青海省西宁市第十四中学2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
8 . 铁是人类较早使用的金属之一,FeSO4和FeCl3是重要的化工原料。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量_______ (填标号,下同);向FeSO4溶液加入_______ 可验证该溶液是否变质。
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是_______ 。(已知:Fe2+遇铁氰化钾溶液产生蓝色沉淀)
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:
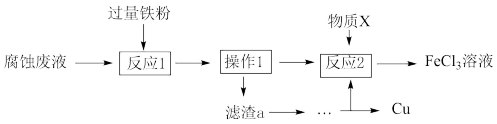
①滤渣a为_______ 。
②物质X为_______ 。
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是_______
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为_______ 。
(I)硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。
(1)为防止FeSO4溶液变质,应在溶液中加入少量
A.铜片 B.KSCN溶液 C.氯气 D.铁粉
(2)该补血剂与维生素C同时服用,有利于Fe2+的吸收。某同学设计如下实验探究维生素C的作用:取少量Fe2(SO4)3溶液于试管中,加入维生素C片2片,振荡溶解,再滴加铁氰化钾溶液,溶液出现蓝色沉淀,由此得出结论是
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有FeCl3、FeCl2和CuCl2,且c(Fe3+)=c(Fe2+)。
(3)从废液中可回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣a为
②物质X为
A.HCl B.酸性KMnO4溶液 C.Cl2
(4)取该废液20mL并加入mg铁粉,充分反应。
①对反应后的溶液分析错误的是
A.溶液中一定含有Fe2+
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有Cu2+,则可能有固体析出
D.溶液若有Fe3+剩余,则一定没有固体析出
②若m=2.72,则充分反应后得到20mL3.0mol/L氯化亚铁溶液和2.24g固体混合物。则原废液中Fe3+的物质的量浓度为
您最近一年使用:0次
2023-02-14更新
|
299次组卷
|
3卷引用:吉林省长春外国语学校2023-2024学年高一下学期开学化学试题
名校
解题方法
9 . 已知:CH4(g)+2H2S(g)  CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,下图所示:
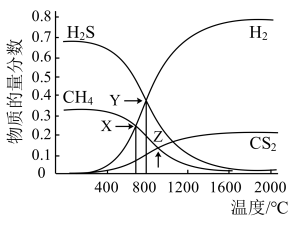
下列说法正确的是
 CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,下图所示:
下列说法正确的是
| A.该反应的△H<0 |
| B.X 点CH4的转化率为30% |
| C.X点与Y点容器内压强比为55:51 |
| D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol 时v(正)<v(逆) |
您最近一年使用:0次
2022-12-10更新
|
200次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期开学考试化学试题
吉林省通化市梅河口市第五中学2023-2024学年高三上学期开学考试化学试题黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高三上学期期末考试化学试题(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)
2022高三·全国·专题练习
10 . 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、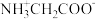 和
和 的分布分数【如
的分布分数【如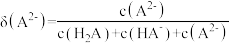 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、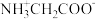 和
和 的分布分数【如
的分布分数【如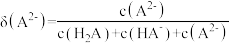 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是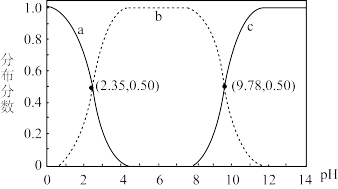
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.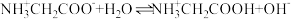 的平衡常数 的平衡常数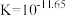 |
D.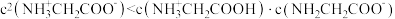 |
您最近一年使用:0次
2022-07-06更新
|
12834次组卷
|
33卷引用:吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题
吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第二中学2022-2023学年高三上学期12月考化学试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题湖南省岳阳市汨罗市第一中学2023-2024学年高二下学期5月月考化学试题



