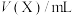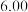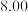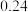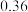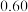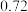名校
解题方法
1 . 铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与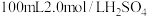 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 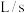 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为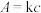 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: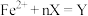 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为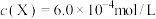 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1. 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为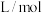 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下 值为
值为______________ 。
(1)
 铁粉与
铁粉与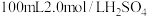 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
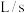 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,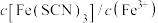 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。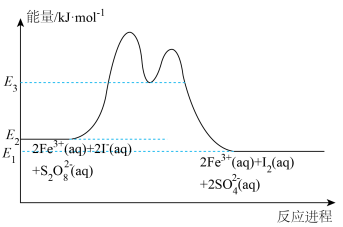
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
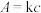 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: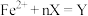 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为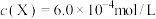 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为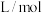 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: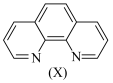
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
 值为
值为
您最近一年使用:0次
名校
2 . 环丙沙星是喹诺酮类抗菌药物,具有广谱抗菌活性,杀菌效果好,某研究小组按下列路线合成环丙沙星(H)。
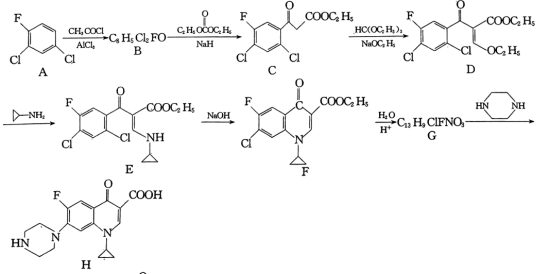
已知:RCOCH3

回答下列问题:
(1)B的结构简式是___________ 。
(2)C中含氧官能团名称是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)E→F的反应类型为___________ 。
(5)A的芳香族同分异构体有___________ 种(本身除外);写出符合下列要求的G的同分异构体的结构简式:___________ 。
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以 和
和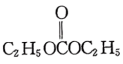 为原料合成
为原料合成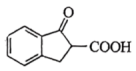 的路线图为:
的路线图为:
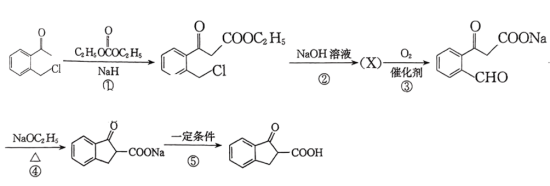
则X的结构简式为___________ ;反应⑤中的一定条件是指___________ 。

已知:RCOCH3


回答下列问题:
(1)B的结构简式是
(2)C中含氧官能团名称是
(3)写出D→E的化学方程式:
(4)E→F的反应类型为
(5)A的芳香族同分异构体有
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以
 和
和 为原料合成
为原料合成 的路线图为:
的路线图为:
则X的结构简式为
您最近一年使用:0次
解题方法
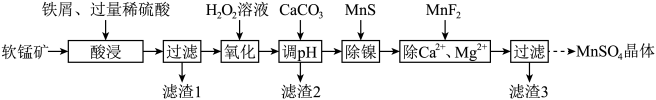
3 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于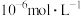 ,此时溶液中
,此时溶液中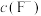 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于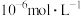 ,此时溶液中
,此时溶液中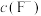 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
4 .  是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为
是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为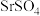 )为原料制备
)为原料制备 的一种工艺方法如下:
的一种工艺方法如下:
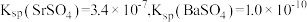 。
。
回答下列问题:
(1)天青石与碳粉在一定投料比下“煅烧”生成 和碳氧化物,据矿样成分分析结果计算得出,生成
和碳氧化物,据矿样成分分析结果计算得出,生成 、
、 时失重率分别为
时失重率分别为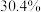 、
、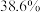 ,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为
,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为___________ (填“ ”或“
”或“ ”)。
”)。
(2)“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为___________ 和___________ 。
(3)“水浸”后滤渣的主要成分除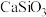 和C外,还有两种氧化物,化学式为
和C外,还有两种氧化物,化学式为___________ 和___________ 。
(4)“水浸”时需加热, 与热水作用后的溶液呈碱性的主要原因为
与热水作用后的溶液呈碱性的主要原因为___________ (用化学方程式表示)
(5)“水浸”后的滤液中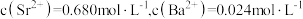 ,“除杂”过程中(忽略
,“除杂”过程中(忽略 溶液引起的体积变化),为使
溶液引起的体积变化),为使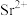 不沉淀,应控制溶液中
不沉淀,应控制溶液中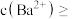
___________  ,每升滤液中篇加入
,每升滤液中篇加入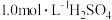 溶液的体积
溶液的体积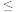
___________  。
。
(6)“沉锶”过程中,可溶性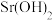 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
 是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为
是一种重要的含锶化合物,广泛应用于许多领域。以天青石(主要成分为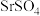 )为原料制备
)为原料制备 的一种工艺方法如下:
的一种工艺方法如下: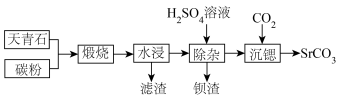
| 元素 |  |  |  |  |  |
质量分数( ) ) | 36.4 | 2.0 | 4.0 | 0.5 | 5.0 |
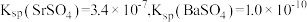 。
。回答下列问题:
(1)天青石与碳粉在一定投料比下“煅烧”生成
 和碳氧化物,据矿样成分分析结果计算得出,生成
和碳氧化物,据矿样成分分析结果计算得出,生成 、
、 时失重率分别为
时失重率分别为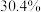 、
、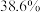 ,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为
,实际热重分析显示失重率为32.6%,则“煅烧”中主要生成的碳氧化物为 ”或“
”或“ ”)。
”)。(2)“煅烧”过程中还可能产生少量对环境有危害的气体,化学式为
(3)“水浸”后滤渣的主要成分除
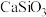 和C外,还有两种氧化物,化学式为
和C外,还有两种氧化物,化学式为(4)“水浸”时需加热,
 与热水作用后的溶液呈碱性的主要原因为
与热水作用后的溶液呈碱性的主要原因为(5)“水浸”后的滤液中
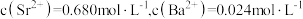 ,“除杂”过程中(忽略
,“除杂”过程中(忽略 溶液引起的体积变化),为使
溶液引起的体积变化),为使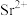 不沉淀,应控制溶液中
不沉淀,应控制溶液中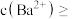
 ,每升滤液中篇加入
,每升滤液中篇加入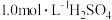 溶液的体积
溶液的体积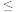
 。
。(6)“沉锶”过程中,可溶性
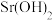 发生反应的离子方程式为
发生反应的离子方程式为
您最近一年使用:0次
2024-01-22更新
|
1263次组卷
|
7卷引用:工业流程题
(已下线)工业流程题2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学
5 . 室温下,向 、
、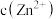 均为
均为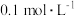 的混合溶液中持续通入
的混合溶液中持续通入 气体,始终保持
气体,始终保持 饱和(
饱和( 的物质的量浓度为
的物质的量浓度为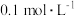 ),通过调节
),通过调节 使
使 、
、 分别沉淀,溶液中
分别沉淀,溶液中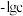 与
与 的关系如下图所示。其中,c表示
的关系如下图所示。其中,c表示 、
、 、
、 和
和 的物质的量浓度的数值,
的物质的量浓度的数值,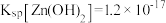 。下列说法错误的是
。下列说法错误的是
 、
、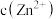 均为
均为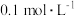 的混合溶液中持续通入
的混合溶液中持续通入 气体,始终保持
气体,始终保持 饱和(
饱和( 的物质的量浓度为
的物质的量浓度为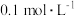 ),通过调节
),通过调节 使
使 、
、 分别沉淀,溶液中
分别沉淀,溶液中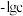 与
与 的关系如下图所示。其中,c表示
的关系如下图所示。其中,c表示 、
、 、
、 和
和 的物质的量浓度的数值,
的物质的量浓度的数值,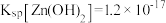 。下列说法错误的是
。下列说法错误的是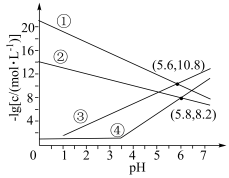
A.①代表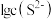 与 与 的关系曲线 的关系曲线 | B. 逐渐增大时,溶液中优先析出的沉淀为 逐渐增大时,溶液中优先析出的沉淀为 |
C. 的 的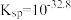 | D. 的平衡常数 的平衡常数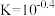 |
您最近一年使用:0次
2024-01-22更新
|
1759次组卷
|
9卷引用:选择题11-15
(已下线)选择题11-152024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升(已下线)选择题11-15山东省聊城市2024年高考模拟试题(一) 化学辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题山东省聊城市2023-2024学年高三下学期一模化学试题 (已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)化学(山东卷02)-2024年高考押题预测卷
名校
6 . 天然药物活性成分N具有消炎等生理活性,其人工合成路线如下: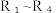 代表烃基
代表烃基
(1)A为链状化合物,其含有的官能团为_______ ,A到B的反应类型为_______ 。
(2)反应D→E的氧化常分为两步进行,写出第一步的氧化后的产物与新制氢氧化铜悬浊液发生反应的化学方程式_______ 。
(3)反应G→H所需加入的试剂为_______ 。
(4)反应H→Ⅰ的化学方程式为_______ 。
(5)反应J→K中加入的试剂X为_______ 。
(6)F的 谱中,只有两组峰。F与K生成N的反应分三步,除N外还得到了1分子丙酸。
谱中,只有两组峰。F与K生成N的反应分三步,除N外还得到了1分子丙酸。
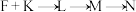 (反应条件略去)
(反应条件略去)
L、M的结构分别为_______ 、_______ 。
已知:①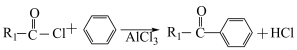
②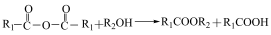
③
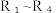 代表烃基
代表烃基(1)A为链状化合物,其含有的官能团为
(2)反应D→E的氧化常分为两步进行,写出第一步的氧化后的产物与新制氢氧化铜悬浊液发生反应的化学方程式
(3)反应G→H所需加入的试剂为
(4)反应H→Ⅰ的化学方程式为
(5)反应J→K中加入的试剂X为
(6)F的
 谱中,只有两组峰。F与K生成N的反应分三步,除N外还得到了1分子丙酸。
谱中,只有两组峰。F与K生成N的反应分三步,除N外还得到了1分子丙酸。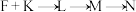 (反应条件略去)
(反应条件略去)L、M的结构分别为
您最近一年使用:0次
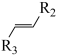
7 . 某药物成分I具有抗炎、抗病毒、抗氧化等生物活性,其合成路线如下:
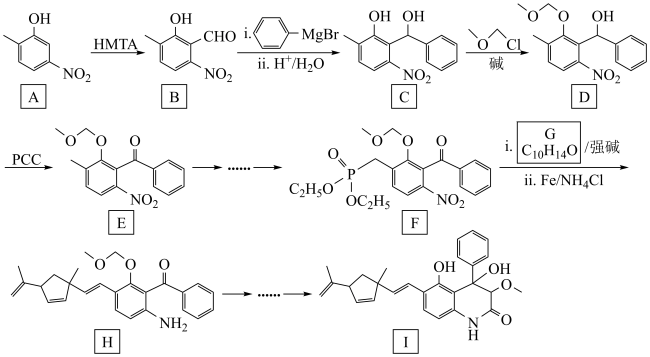
已知: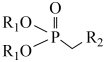 +R3-CHO
+R3-CHO
 +
+
回答下列问题:
(1)A中官能团名称为___________ 。
(2)在NaOH溶液中,C→D的化学方程式为___________ 。
(3)D→E的反应类型为___________ 。
(4)G的结构简式为___________ 。
(5)化合物A的同分异构体满足以下条件的有___________ 种(不考虑立体异构);
i.含苯环 ii.含硝基,且硝基与碳原子相连。
(6)参照上述流程,设计以HCHO和 (R基自己确定)为原料合成
(R基自己确定)为原料合成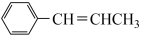 的路线如下:
的路线如下:

则X的结构简式为___________ ,Y的结构简式为___________ ,Z的结构简式为___________ 。

已知:
 +R3-CHO
+R3-CHO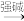
 +
+
回答下列问题:
(1)A中官能团名称为
(2)在NaOH溶液中,C→D的化学方程式为
(3)D→E的反应类型为
(4)G的结构简式为
(5)化合物A的同分异构体满足以下条件的有
i.含苯环 ii.含硝基,且硝基与碳原子相连。
(6)参照上述流程,设计以HCHO和
 (R基自己确定)为原料合成
(R基自己确定)为原料合成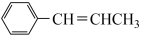 的路线如下:
的路线如下:
则X的结构简式为
您最近一年使用:0次
2024-01-14更新
|
385次组卷
|
5卷引用:有机综合题
(已下线)有机综合题吉林省吉林市2023-2024学年高三上学期第二次模拟考试 化学试题吉林省吉林市2023-2024学年高三上学期第二次模拟考试化学试题(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)专题11 有机推断综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
2024·广西·模拟预测
解题方法
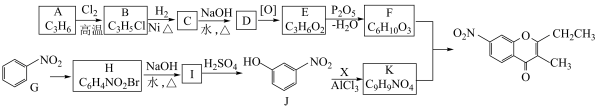
8 . 碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料丙烯出发,针对酮类有机物H设计了如下合成路线:

已知: 。
。
回答下列问题:
(1)由A→B的反应中,A中的_______ 键断裂(填“π”或“σ”)。
(2)满足下列条件,与E互为同分异构体的芳香族化合物M有_______ 种,写出的M一种结构简式:
_______ (任写一种)。
ⅰ.苯环上有4个取代基
ⅱ.能与 溶液发生显色反应
溶液发生显色反应
ⅲ.其中核磁共振氢谱有6组峰,峰面积之比为6∶4∶2∶2∶1∶1
ⅳ.该物质可催化氧化生成醛
(3)D中含氧官能团的名称为_______ 。
(4)G→H的反应类型为_______ ,H结构简式为_______ 。
(5)参照上述合成路线,以 和
和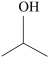 为原料合成
为原料合成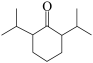 的路线如下:
的路线如下:

合成过程中除生成主要产物I( )外,还生成另一种副产物J,J的结构简式为
)外,还生成另一种副产物J,J的结构简式为_______ 。写出生成J的化学方程式_______ 。

已知:
 。
。回答下列问题:
(1)由A→B的反应中,A中的
(2)满足下列条件,与E互为同分异构体的芳香族化合物M有
ⅰ.苯环上有4个取代基
ⅱ.能与
 溶液发生显色反应
溶液发生显色反应ⅲ.其中核磁共振氢谱有6组峰,峰面积之比为6∶4∶2∶2∶1∶1
ⅳ.该物质可催化氧化生成醛
(3)D中含氧官能团的名称为
(4)G→H的反应类型为
(5)参照上述合成路线,以
 和
和 为原料合成
为原料合成 的路线如下:
的路线如下:
合成过程中除生成主要产物I(
 )外,还生成另一种副产物J,J的结构简式为
)外,还生成另一种副产物J,J的结构简式为
您最近一年使用:0次
9 . 利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如图。
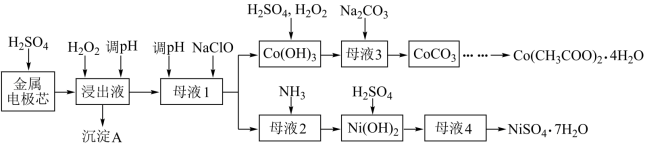
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
(1)用硫酸没取金属电极芯时,提高浸取率的方法有_______ ,(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、_______ ;“浸出液"调节pH的范围为_______ ,调节pH用的试剂可以是_______ 。(选填序号)
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1"中加入NaClO反应的离子方程式为_______ 。
(4)“母液1”中先加入NaClO溶液将Co2+氧化,而后又向生成的沉淀中加入H2O2将Co(OH)3还原为Co2+,则“母液1”中加入NaClO溶液的作用是_______ 。
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于_______ mol/L;为防止生成Co(OH)2沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式是_______ 。(已知:Ksp[Co(OH)2]=2×10-15)
(6)由“母液4"获取NiSO4·7H2O的操作中用乙醇洗涤的优点是_______ 。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀 | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀 | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)用硫酸没取金属电极芯时,提高浸取率的方法有
(2)沉淀A的主要成分是Fe(OH)3、
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1"中加入NaClO反应的离子方程式为
(4)“母液1”中先加入NaClO溶液将Co2+氧化,而后又向生成的沉淀中加入H2O2将Co(OH)3还原为Co2+,则“母液1”中加入NaClO溶液的作用是
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于
(6)由“母液4"获取NiSO4·7H2O的操作中用乙醇洗涤的优点是
您最近一年使用:0次
10 . 下图为常温Al(OH)3、Mn(OH)2、Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1),M为Al3+、Mn2+或Cu2+;c(M)≤10-5mol/L可认为M离子沉淀完全)。下列叙述正确的是
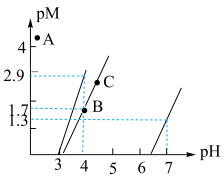
| A.常温下,Ksp[Al(OH)3]=10-22.3 |
| B.加适量CuCl2固体可使溶液由B点变到C点 |
C.若A点为含Al3+、Cu2+的混合溶液,则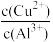 =10-0.7 =10-0.7 |
| D.浓度均为0.1mol/L的Cu2+和Mn2+可通过分步沉淀进行分离 |
您最近一年使用:0次