名校
解题方法
1 . 除去粗盐中的Ca2+、Mg2+、 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
2024-03-30更新
|
183次组卷
|
63卷引用:吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题
吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题吉林省长春外国语学校2017-2018学年高一上学期期末考试化学(文)试题天津市静海县第一中学2019-2020学年高一3月学生学业能力调研考试化学试题四川省江油中学2018-2019学年高一10月月考化学试题内蒙古北京八中乌兰察布分校2020-2021学年高一上学期第一次月考化学试题黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题合肥市第十一中学2020-2021学年高一下学期第一次教学质量评估化学试题贵州省毕节市民族中学2020-2021学年高一上学期12月月考化学试题广东省中山市第二中学2020-2021学年高一下学期第一次段考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一4月月考化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题重庆铁路中学2020-2021学年高一下学期4月月考化学试题吉林省长春市2020-2021学年高一下学期期末联考化学试题宁夏中卫市第一中学2021-2022学年高一上学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高一上学期第一次月考化学试题云南省宣威市第三中学2021-2022学年高一下学期4月考试化学试题北京市东直门中学2021—2022学年高一下学期6月月考化学试题四川省什邡中学2021-2022学年高一上学期第一次月考化学试题黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考(普通班)化学试题湖南省岳阳市2022-2023学年高一上学期第一次月考化学试题陕西省武功县普集高级中学2022-2023学年高一下学期3月月考化学试题广东省佛山市三水中学2022-2023学年高一下学期3月第一次统测化学试题黑龙江省哈尔滨市第四中学校2023-2024学年高一上学期11月月考化学试题 新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高一上学期10月第一次月考化学试卷河北省邯郸市永年区第二中学2023-2024学年高一上学期12月月考化学试题广东省深圳市光明中学2023-2024学年高一下学期3月第一次统测化学试题广东省江门市某校2023-2024学年高一下学期第一次质量检测化学试题云南省昆明市禄劝彝族苗族自治县第一中学2023-2024学年高一下学期3月月考化学试题四川省华蓥中学2023-2024学年高一下学期4月月考化学试题2015-2016学年陕西省城固一中高一上学期期中测试化学试卷山东省昌邑市第一中学2017-2018学年高一上学期期末模拟化学试题北京市首师附2019-2020学年第一学期期中考试高一化学试卷四川省自贡市田家炳中学2019-2020学年高一上学期期中考试化学试题北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题宁夏吴忠市吴忠中学2020-2021学年高一上学期期中考试化学试题四川省成都市实验外国语学校(西区)2020-2021学年高一上学期期中考试化学试题山东省日照市莒县2020-2021学年高一11月模块考试化学试题辽宁省抚顺县高级中学2019-2020学年高一下学期期中网课学习质量检测化学试题湖北省黄冈市麻城市麻城二中2020-2021学年高一下学期期中考试化学试题山西省大同市天镇县实验中学2020-2021学年高一下学期期中考试化学试题河北省师范大学附属中学2020-2021学年高一第二学期期中考试化学试题(已下线)专题01 硫及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)北京市大兴区2020-2021学年高一下学期期末考试化学试题内蒙古集宁新世纪中学2020-2021学年高一上学期期中考试化学试题广东省2012年全国高中学生化学素质和实验能力竞赛初赛试题(B组)(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题甘肃省永昌县第一高级中学2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高一上学期期末考试化学试题安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题山东省临沂市2021-2022学年高一下学期期中考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高一下学期期中考试(选择考)化学试题江苏省天一中学2021-2022学年高一下学期期中考试(文)化学试题云南红河县第一中学2021-2022学年高一下学期期末考试化学试题云南省昆明北大博雅实验中学2020-2021学年高一下学期期中考试化学试题云南省红河县第一中学2020-2021学年高一下学期期末考试化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期中考试化学(A卷)试题广东省广州大同中学2022-2023学年高一下学期期中考试化学试题广东省江门市新会陈经纶中学2022-2023学年高一下学期期中考试(合格考)化学试题安徽省六安第二中学2022-2023学年高一下学期期中考试化学试题山西省阳泉市2022-2023学年高一下学期期末考试化学试题安徽省蚌埠市固镇县汉兴学校、怀远县禹泽学校2023-2024学年高一上学期12月期末联考化学试题
13-14高二下·宁夏银川·期末
2 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: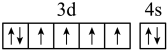 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
219次组卷
|
62卷引用:吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题
吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题第一章 本章复习提升1福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
3 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、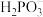 、
、 的物质的量分数
的物质的量分数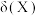 随
随 的变化如图所示。已知:
的变化如图所示。已知: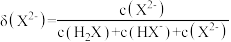 。
。
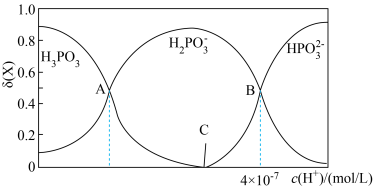
①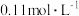 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点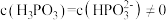 ,那C点对应的
,那C点对应的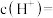
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中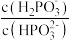 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
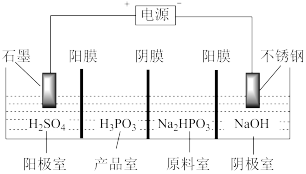
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、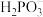 、
、 的物质的量分数
的物质的量分数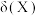 随
随 的变化如图所示。已知:
的变化如图所示。已知: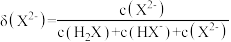 。
。
①
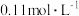 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
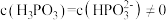 ,那C点对应的
,那C点对应的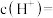
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中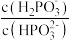 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 某温度下,将氯气Cl2通入氢氧化钾溶液中,发生反应为:Cl2+KOH-KCl+KClO+KClO3+H2O(未配平),得到KCl,KClO,KCO3的混合液,经测定溶液中ClO-与ClO 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为| A.23:7 | B.7:23 | C.12:7 | D.7:12 |
您最近一年使用:0次
2023-10-13更新
|
1084次组卷
|
6卷引用:吉林省辉南县2023-2024学年第六中学高一上学期11月半月考化学试卷
名校
解题方法
5 . 反应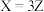 经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
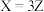 经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是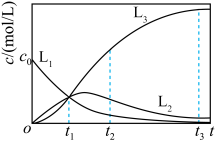
A. 为 为 随t的变化曲线 随t的变化曲线 |
B. 时, 时,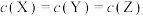 |
C. 时,X的消耗速率等于Z的生成速率 时,X的消耗速率等于Z的生成速率 |
D.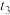 时, 时,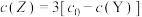 |
您最近一年使用:0次
2023-10-08更新
|
217次组卷
|
4卷引用:吉林省部分名校2023-2024学年高二上学期10月联考化学试题
9-10高一下·浙江温州·期中
名校
解题方法
6 . 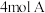 气体和
气体和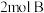 气体在
气体在 的容器中混合并在一定条件下发生如下反应:
的容器中混合并在一定条件下发生如下反应: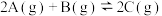 。若经
。若经 后测得C的浓度为
后测得C的浓度为 ,现有下列几种说法:
,现有下列几种说法:
①用物质A表示的反应平均速率为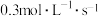
②用物质B表示的反应的平均速率为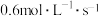
③ 时物质A的转化率为70%
时物质A的转化率为70%
④ 时物质B的浓度为
时物质B的浓度为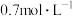
其中正确的是
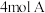 气体和
气体和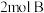 气体在
气体在 的容器中混合并在一定条件下发生如下反应:
的容器中混合并在一定条件下发生如下反应: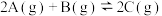 。若经
。若经 后测得C的浓度为
后测得C的浓度为 ,现有下列几种说法:
,现有下列几种说法:①用物质A表示的反应平均速率为
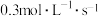
②用物质B表示的反应的平均速率为
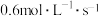
③
 时物质A的转化率为70%
时物质A的转化率为70%④
 时物质B的浓度为
时物质B的浓度为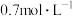
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
您最近一年使用:0次
2023-09-17更新
|
477次组卷
|
189卷引用:2011-2012学年吉林省白山二中高一下学期第一次月考化学试卷
(已下线)2011-2012学年吉林省白山二中高一下学期第一次月考化学试卷吉林省辽源市田家炳高级中学2019-2020学年高二12月月考化学试题(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2011-2012年河北省灵寿中学高二上学期第一次月考化学试卷(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年山东省郓城一中高二上学期模块考试化学试卷(已下线)2011-2012学年山东省济宁市泗水一中高一3月月考化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2011-2012学年河北省正定中学高一下学期第三次考试理科化学试卷(已下线)2011-2012学年河北省藁城一中高二9月月考化学试卷(已下线)2012-2013学年辽宁省盘锦市第二高级中学高二9月月考化学试卷(已下线)2012-2013学年广东省汕头市金山中学高二10月月考化学试卷(已下线)2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(已下线)2012-2013学年河南省安阳一中高一下学期第二次阶段测试化学试卷(已下线)2012-2013学年河南省唐河县第一高级中学高一下第四次月考化学试卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷2014-2015学年湖北省松滋一中高一下学期6月月考化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年青海省高级中学高二上9月质检化学试卷2016届河北省邯郸市大名县第一中学高三上学期10月月考化学试卷2015-2016学年河南省信阳高级中学高二12月月考化学卷2015-2016学年山东省淄博市淄川一中高二上第一次阶段测化学试卷2015-2016学年安徽省钱桥中学、泥河中学高二上12月联考化学试卷2015-2016学年安徽省宣城郎溪中学高二上学期第三次月考化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷新疆生产建设兵团第二中学2016-2017学年高一下学期第二次月考化学试题湖北省沙市中学2016-2017学年高一下学期第四次双周考化学试题宁夏石嘴山市第三中学2016-2017学年高一下学期第二次(5月)月考化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二9月月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题山东省济南市历城区第二中学2017-2018学年高二10月月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题重庆市铜梁一中2018-2019学年高二上学期10月月考化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省招远一中2018-2019学年高一下学期4月月考化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题河北省张家口第一中学2019-2020学年高二9月月考(衔接班)化学试题山西省朔州市怀仁一中2019-2020学年高二上学期第一次月考化学试卷山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题山东省淄博市淄川区般阳中学2019-2020学年高二10月月考化学试题广西宾阳县宾阳中学2019-2020学年高二9月月考化学试题浙江省金华市江南中学高二上学期12月月考化学试题山西省运城市景胜中学2019-2020学年高二上学期期中考试化学试题四川省宜宾市南溪区第二中学2019-2020学年高二上学期第三次月考化学试题江西省南丰县第二中学2019-2020学年高一下学期4月线上测试化学试题湖南省长沙市明德中学2019-2020学年高一下学期第八次阶段性检测化学试题江西省新余市第一中学2019-2020学年高一下学期5月段考化学试题江西省贵溪市实验中学2020-2021学年高二上学期第一次月考化学试题山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二上学期第二次月考化学试题四川省自贡市江姐中学2020-2021学年高二上学期第一次月考化学试题安徽省滁州市定远县重点中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】43安徽省广德县实验中学2020-2021学年高二上学期10月月考化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题湖北省石首市第一中学2020-2021学年高二上学期10月月考化学试题广西钦州市第四中学2020-2021学年下学期高二3月月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高二上】【高中化学】【00135】江西省靖安中学2019-2020学年高二上学期第一次月考化学试题北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题河南省新乡县龙泉高级中学2021-2022学年高二上学期9月月考化学试题天津市第三中学2021-2022学年高二上学期10月阶段性检测化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题福建省福州第四中学2021-2022学年高一下学期3月月考化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 北京市顺义区牛栏山第一中学2021-2022学年高一下学期阶段性检测化学试题河南省三门峡市第一高级中学2021-2022学年高一下学期5月月考化学试题天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第一次阶段考试化学试题天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题湖北省襄阳东风中学2021-2022学年高二上学期10月月考化学试题湖南省长沙市长郡中学2022-2023学年高一下学期第一次月考化学试题广东省佛山市三水中学2022-2023学年高二上学期10月第一次统测化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题河南省濮阳市南乐县第一高级中学2023-2024学年高一下学期模拟预测化学试题(已下线)2010年浙江省温州中学高一第二学期期中考试化学试卷(已下线)2010年春季武汉睿升学校高一期中考试化学卷(已下线)09-10学年河北省衡水中学高一年级下学期期末考试化学试卷(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2010年福建省厦门六中高二上学期期中考试化学试卷(已下线)2010年江西省新余九中高二上学期期中考试化学试卷(已下线)2010—2011学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2010-2011学年山西省吕梁市高一下学期期中考试化学试卷(已下线)2010-2011学年江西省上饶市第五中学高一下学期期中考试化学试卷(已下线)2010-2011学年陕西省勉县一中高一下学期期中考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东临清三中高二上学期学分认定测试化学(理)试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012年江西赣州市十一县(市)高一下学期期中联考化学试卷(已下线)2011-2012学年湖南省望城一中高一下学期期中考试化学试卷(已下线)2011-2012学年河南省信阳高中高一下学期期中考试化学试卷(已下线)2012-2013学年广东省实验中学高二上学期期中化学试卷(已下线)2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷(已下线)2013-2014学年江西省南昌市高二上学期期中测试理科化学试卷(乙)(已下线)2013-2014学年广东省肇庆市高二上学期末考试化学试卷(已下线)2013-2014学年安徽省宿州市高二上学期期末考试化学试卷(已下线)2014高考名师推荐化学速率表示与平衡移动(已下线)2013-2014福建省三明一中下学期期中考试高二化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题(已下线)2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷2014-2015学年内蒙古巴彦淖尔市一中高二上学期期中化学试卷2014-2015湖北省武汉市部分重点中学高一下学期期中考试化学试卷2014—2015江西省九江市彭泽县第二高中高一下学期期中考试化学试卷2014-2015学年浙江省杭州第二中学高一下期中考试化学试卷2014-2015学年浙江省乐成公立寄宿学校高一下学期期末考试化学试卷2015-2016学年湖南省邵阳市邵东三中高一下期中化学试卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷2015-2016学年浙江省杭州市七校高二下学期期中化学试卷2015-2016学年浙江省杭州二中高二下期中化学试卷2016-2017学年河南省郸城高级中学高二上开学测化学试卷2016-2017学年山东省曲阜师大附中高二上期中化学试卷2016-2017学年四川省雅安中学高二下学期开学考试化学试卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷2016-2017学年湖北省襄阳市四校(襄州一中、枣阳一中、宜城一中、曾都一中)高二下学期期中联考化学试卷2青海省平安县第一高级中学2016-2017学年高二下学期期中考试化学试题湖北省天门、仙桃、潜江三市2016-2017学年高一下学期期末考试化学试题湖北省沙市中学2017-2018学年高二上学期第二次双周考化学试题北京市昌平临川育人学校2017-2018学年高二上学期期中考试化学试题山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题1江西省四校协作体2017-2018学年高二上学期期中联考化学试题河南省商丘市九校2017-2018学年高二上学期期中联考化学试题山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题2内蒙古赤峰市宁城县2017-2018学年高二上学期期末考试化学试题宁夏吴忠中学2017-2018学年高二下学期开学考试化学试题广西马山县金伦中学2017-2018学年高一下学期“4+ N”高中联合体期末联考化学试题(已下线)第13天 化学反应速率的计算——《每日一题·2018快乐暑假》高二化学【校级联考】湖南省浏阳市六校联考2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期期中考试化学试题【市级联考】内蒙古自治区鄂尔多斯市2018-2019学年高二上学期期中考试化学试题【全国百强校】湖北省随州市第一中学2018-2019学年高二上学期期中考试化学试题【校级联考】甘肃省兰州市第二片区丙组2018-2019学年高二上学期期末联考化学试题青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题浙江省宁波诺丁汉大学附属中学2019-2020学年高二上学期期中考试化学(实验班)试题浙江省磐安县第二中学2019-2020学年高二上学期期中考试化学试题浙江省杭州地区七校2019-2020学年高二上学期期中考试理综化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理—— 转化率与产率的相关计算(已下线)专题06 化学反应的速率和限度(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)江西省湘东中学2019~2020学年高一下学期期中化学线上能力测试化学试题辽宁省丹东市2018-2019学年高一下学期期末质量监测化学试题江西省南昌市新建一学2019-2020学年高一下学期线上期中考试化学试题(已下线)【南昌新东方】2020 新建一中 高一(下) 期中 006(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题江苏省苏州市震泽中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率西藏拉萨市第二高级中学2019-2020学年高二上学期期中考试化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题福建省福州市福建师范大学附属中学2020-2021学年高二上学期期中考试化学试题天津市滨海新区大港太平村中学2020-2021学年高二上学期期中化学试题陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题高中化学苏教2019版必修第二册-专题6 第一单元 第1课时 化学反应速率湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题湖南省常德市石门县第六中学2019-2020学年高二下学期期末考试化学试题青海省西宁市海湖中学2020-2021学年高二下学期开学考试化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二上学期期末考试化学试题江西省抚州市部分中学联合体2020-2021学年高一下学期期中考试化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题广东省肇庆市实验中学2021-2022学年高二上学期期中考试化学试题黑龙江省鸡东县第二中学2021-2022学年高二上学期期中考试化学(理)试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)浙江省舟山中学2021-2022学年高一下学期学考考前质量检测化学试题甘肃省民勤县第四中学2021-2022学年高二上学期期中考试(实验班)化学试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期第一次质量检测(开学摸底)化学试题浙江省强基联盟2022-2023学年高三上学期选考仿真密卷化学试题 河南大学附属中学2022-2023学年高一下学期期中考试 化学试题四川省成都市西南交通大学附属中学2022-2023学年高一下学期期中考试化学试题江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题辽宁省辽西联合校2023-2024学年高二上学期期中考试化学试题福建省福州格致中学2023-2024学年高二上学期10月期中考试化学试题海南省海口市第一中学2023-2024学年高三上学期期末考试化学试题(非重点班)(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)福建省福州第八中学2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
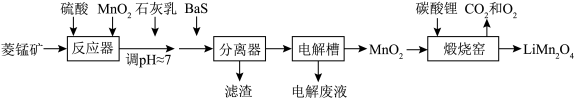
7 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量
,含有少量 、
、 、
、 、
、 等元素)制备
等元素)制备 的流程如下:
的流程如下:
已知: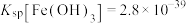 ,
,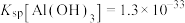 ,
,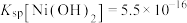 。
。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量
 的作用是
的作用是(3)溶矿反应完成后,反应器中溶液
 ,此时
,此时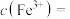
 ;用石灰乳调节至
;用石灰乳调节至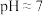 ,除去的金属离子是
,除去的金属离子是(4)加入少量
 溶液除去
溶液除去 ,生成的沉淀有
,生成的沉淀有(5)在电解槽中,发生电解反应的离子方程式为
(6)煅烧窑中,生成
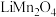 反应的化学方程式是
反应的化学方程式是
您最近一年使用:0次
2023-09-02更新
|
438次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期9月月考化学试题
8 . 工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料(已知:CH3CH2OH CH2=CH2↑+H2O)。
CH2=CH2↑+H2O)。_______ (写名称)。
(2)反应②的类型是________ ;反应④的类型是________ 。
(3)请写出反应②的化学方程式________ 。
(4)请写出反应④的化学方程式________ 。
(5)请写出反应⑥的化学方程式_________ 。
(6)关于乙二醇又称甘醇,是常用的一种有机溶剂,关于乙二醇HOCH2-CH2OH性质预测正确的是_______ (填字母)。
 CH2=CH2↑+H2O)。
CH2=CH2↑+H2O)。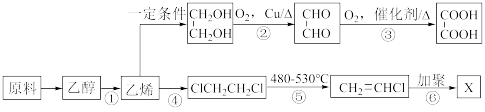
(2)反应②的类型是
(3)请写出反应②的化学方程式
(4)请写出反应④的化学方程式
(5)请写出反应⑥的化学方程式
(6)关于乙二醇又称甘醇,是常用的一种有机溶剂,关于乙二醇HOCH2-CH2OH性质预测正确的是
| A.乙二醇能溶于水 |
| B.乙二醇能燃烧,充分燃烧其产物是CO2和水 |
| C.向紫色的酸性高锰酸钾溶液中加入乙二醇溶液,可观察到紫色溶液褪色 |
| D.乙二醇与乙醇互为同系物 |
您最近一年使用:0次
2023-06-23更新
|
343次组卷
|
4卷引用:吉林省长春外国语学校2022-2023学年高一下学期6月月考化学试题
吉林省长春外国语学校2022-2023学年高一下学期6月月考化学试题辽宁省昌图县第一高级中学2022-2023学年高一下学期6月月考化学试题辽宁省营口市普通高中2021-2022学年高一下学期期末化学试题(已下线)专题05 乙醇与乙酸 基本营养物质-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
名校
解题方法
9 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(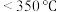 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑( )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
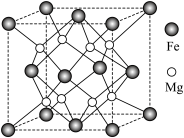
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(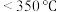 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
345次组卷
|
3卷引用:吉林省长春市第二实验中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
10 . 咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
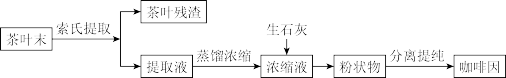
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
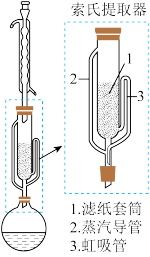
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是_______ 。圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒_______ 。
(2)提取过程不可选用明火直接加热,原因是_______ 。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是_______ 。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏水、温度计、接收管之外,还有_______ (填字母)。
A.直形冷凝管 B.球形冷凝管
C.接收瓶 D.烧杯
(4)浓缩液加生石灰的作用是中和_______ 和吸收_______ 。
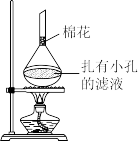
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。
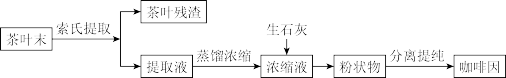
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是
(2)提取过程不可选用明火直接加热,原因是
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是
A.直形冷凝管 B.球形冷凝管
C.接收瓶 D.烧杯
(4)浓缩液加生石灰的作用是中和
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

您最近一年使用:0次



