 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、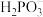 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: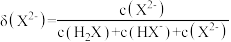 。
。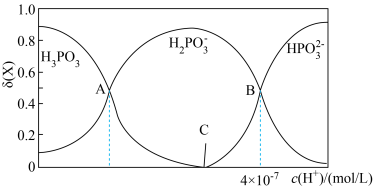
①
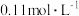 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
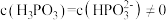 ,那C点对应的
,那C点对应的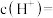
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中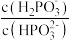 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示: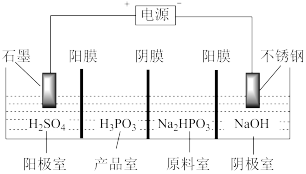
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
更新时间:2024-01-23 23:49:17
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
①上述探究实验1-2选用的盐酸为_____________ (填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____ NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________ 。

(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | |
实验2-2 | 0.20g镁粉 | |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
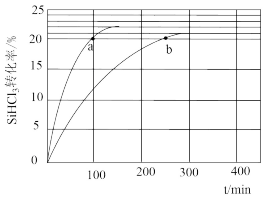
①343 K时反应的平衡转化率α=________ %。平衡常数K343 K=________ (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________ ;要缩短反应达到平衡的时间,可采取的措施有________ 、________ 。
③比较a、b处反应速率大小:va________ vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________ (保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
①请用文字解释随温度升高水的离子积增大的原因 _______________ ;
②10℃时纯水的电离平衡常数为_________ ;计算100℃时纯水中电离产生的氢离子浓度为__________________ 。

①343 K时反应的平衡转化率α=
②在343 K下:要提高SiHCl3转化率,可采取的措施是
③比较a、b处反应速率大小:va
(2)不同温度下水的离子积常数如表所示:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
②10℃时纯水的电离平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】雪碧、可乐是深受人们青睐的碳酸型饮料.
Ⅰ.雪琩是一款柠檬味汽水饮料,其中所含酸性物质包括碳酸、柠檬酸、苯甲酸. 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:
(1)上述三种酸的酸性由强到弱的顺序为____________ (填字母并用“>”符号连接)。
a.苯甲酸 b.碳酸 c.柠檬酸
(2)水中存在平衡 ,欲使平衡向右移动且溶液显碱性,下列方法可行的是
,欲使平衡向右移动且溶液显碱性,下列方法可行的是____________ (填字母)。
a.通入氨气 b.加入 c.加热至
c.加热至 d.加入
d.加入 固体
固体
(3)室温下,向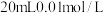 苯甲酸
苯甲酸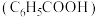 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,溶液的
溶液,溶液的 与加入
与加入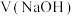 之间的关系如图所示,已知
之间的关系如图所示,已知 。
。

① 点溶液的
点溶液的
____________ (保留小数点后一位)。
②下列说法正确的有____________ 。
a.为准确判断滴定终点,可使用甲基橙做指示剂
b. 点溶液
点溶液 ,且有
,且有
c. 点溶液中一定存在
点溶液中一定存在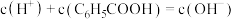
d.D点溶液中有
e.从 点到
点到 点,溶液中水的电离程度最小的是
点,溶液中水的电离程度最小的是 点
点
Ⅱ.可乐中的食品添加剂有白砂糖、二氧化碳、焦糖、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 )有一定关系,已知磷酸电离常数为:
)有一定关系,已知磷酸电离常数为: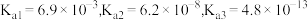
(4)室温下,测得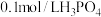 溶液的
溶液的 ,原因是
,原因是____________ (用电离方程式表示)。
(5)向含磷酸的溶液中滴加 溶液,此过程中各含磷微粒在溶液中的物质的量分数与
溶液,此过程中各含磷微粒在溶液中的物质的量分数与 的关系如图所示:
的关系如图所示:
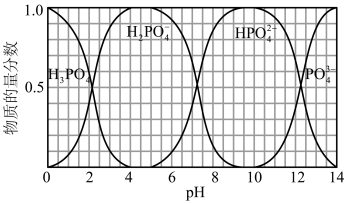
①溶液 由11增大到14的过程中,发生反应的离子方程式为
由11增大到14的过程中,发生反应的离子方程式为____________ 。
②若已知碳酸的电离常数,将磷酸滴入碳酸钠溶液中,发生反应的离子方程式错误的为____________ 。
A.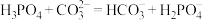 B.
B.
C.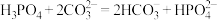 D.
D.
Ⅰ.雪琩是一款柠檬味汽水饮料,其中所含酸性物质包括碳酸、柠檬酸、苯甲酸.
 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:| 物质 | 苯甲酸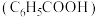 | 碳酸 | 柠檬酸 |
| 电离常数 |  |  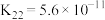 | 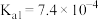 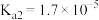  |
(1)上述三种酸的酸性由强到弱的顺序为
a.苯甲酸 b.碳酸 c.柠檬酸
(2)水中存在平衡
 ,欲使平衡向右移动且溶液显碱性,下列方法可行的是
,欲使平衡向右移动且溶液显碱性,下列方法可行的是a.通入氨气 b.加入
 c.加热至
c.加热至 d.加入
d.加入 固体
固体(3)室温下,向
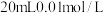 苯甲酸
苯甲酸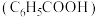 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,溶液的
溶液,溶液的 与加入
与加入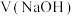 之间的关系如图所示,已知
之间的关系如图所示,已知 。
。
①
 点溶液的
点溶液的
②下列说法正确的有
a.为准确判断滴定终点,可使用甲基橙做指示剂
b.
 点溶液
点溶液 ,且有
,且有
c.
 点溶液中一定存在
点溶液中一定存在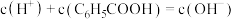
d.D点溶液中有

e.从
 点到
点到 点,溶液中水的电离程度最小的是
点,溶液中水的电离程度最小的是 点
点Ⅱ.可乐中的食品添加剂有白砂糖、二氧化碳、焦糖、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 )有一定关系,已知磷酸电离常数为:
)有一定关系,已知磷酸电离常数为: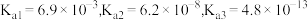
(4)室温下,测得
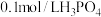 溶液的
溶液的 ,原因是
,原因是(5)向含磷酸的溶液中滴加
 溶液,此过程中各含磷微粒在溶液中的物质的量分数与
溶液,此过程中各含磷微粒在溶液中的物质的量分数与 的关系如图所示:
的关系如图所示:
①溶液
 由11增大到14的过程中,发生反应的离子方程式为
由11增大到14的过程中,发生反应的离子方程式为②若已知碳酸的电离常数,将磷酸滴入碳酸钠溶液中,发生反应的离子方程式错误的为
A.
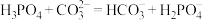 B.
B.
C.
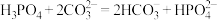 D.
D.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】水体中氮含量过高会对水中生物构成安全威胁,氨氮硝氮是氮的主要存在形态。
(1)某工业氨氮废水的处理流程如下图所示:
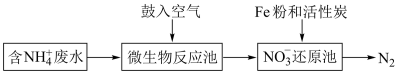
①写出“微生物反应池”中反应的离子方程式:___________ 。
②“NO 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:___________ 。
(2)向氨氮废水中加入NaClO,可以将NH 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
i.ClO—+H2O OH-+HClO
OH-+HClO
ii.NH +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:___________ 。
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)___________ (填“增大”“不变”或“减小”,下同),c(NH3·H2O)___________ 。
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是___________ (答一条)。
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:
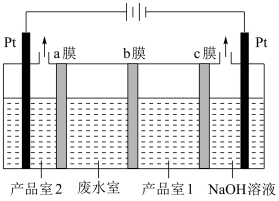
b膜属于___________ (填“阴”或“阳”)离子交换膜;为增强溶液的导电性,电解前产品室2中的溶液应是___________ 。
(1)某工业氨氮废水的处理流程如下图所示:

①写出“微生物反应池”中反应的离子方程式:
②“NO
 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:(2)向氨氮废水中加入NaClO,可以将NH
 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:i.ClO—+H2O
 OH-+HClO
OH-+HClOii.NH
 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:

b膜属于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
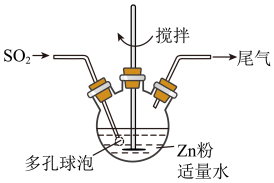
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______ ;容器中多孔球泡的作用是______ 。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体”的原理是(用必要的化学用语和文字说明)______ 。
(3)两种方法中控制温度的加热方式是______ 。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______ 。
(5)甲酸钠法中生成Na2S2O4的总反应为______ 。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______ 。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______ 。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。

步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体”的原理是(用必要的化学用语和文字说明)
(3)两种方法中控制温度的加热方式是
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:
(5)甲酸钠法中生成Na2S2O4的总反应为
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】国家规定,排放的废水中氟的含量不得超过10.0mg·L-1,砷的含量不得超过0.5mg·L-1。硫酸工厂废水中除含有稀硫酸外,还含有H3AsO3、H2SiF6等物质。工业上常通过化学沉淀和氧化、吸附沉降处理废水,实现水体达标排放。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:____ 。
②充分沉淀后测得废水中F-的含量为9.5mg·L-1,此时SO 的浓度为
的浓度为____ mol·L-1。[已知:Ksp(CaSO4)=5.0×10-5,Ksp(CaF2)=5.0×10-9]
(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。
已知:i.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ii.溶液的pH对Fe(OH)3胶体表面所带电荷有影响。pH>7时,Fe(OH)3胶体表面带负电荷,pH越高,表面所带负电荷越多。
iii.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
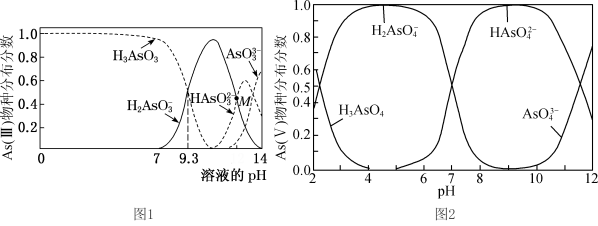
①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:____ 。
②H3AsO3第一步电离的电离常数为Ka1,则pKa1=____ (pKa1=-lgKa1)。
③如图1为向0.1mol/LH3AsO3溶液逐滴加入KOH溶液,含砷物种的分布分数图,下列说法正确的是____ 。
A.当n(H3AsO3):n(H2AsO )=1:1时,溶液呈碱性
)=1:1时,溶液呈碱性
B.pH在8.0~10.0时,反应的离子方程式为:H3AsO3+OH-=H2AsO +H2O
+H2O
C.M点对应的溶液中:c(H2AsO )+c(HAsO
)+c(HAsO )+c(AsO
)+c(AsO )+c(H3AsO3)=0.1mol·L-1
)+c(H3AsO3)=0.1mol·L-1
D.pH=12时,溶液中:c(H2AsO )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(H3AsO3)>c(H+)+c(K+)
)+c(H3AsO3)>c(H+)+c(K+)
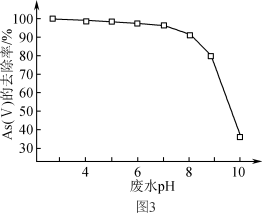
④废水的pH对As(V)的去除率的影响如图3所示。pH>8时,随着废水的pH增大,As(V)的去除率发生如图所示变化的原因是____ 。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:
②充分沉淀后测得废水中F-的含量为9.5mg·L-1,此时SO
 的浓度为
的浓度为(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。
已知:i.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ii.溶液的pH对Fe(OH)3胶体表面所带电荷有影响。pH>7时,Fe(OH)3胶体表面带负电荷,pH越高,表面所带负电荷越多。
iii.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:
②H3AsO3第一步电离的电离常数为Ka1,则pKa1=
③如图1为向0.1mol/LH3AsO3溶液逐滴加入KOH溶液,含砷物种的分布分数图,下列说法正确的是
A.当n(H3AsO3):n(H2AsO
 )=1:1时,溶液呈碱性
)=1:1时,溶液呈碱性B.pH在8.0~10.0时,反应的离子方程式为:H3AsO3+OH-=H2AsO
 +H2O
+H2OC.M点对应的溶液中:c(H2AsO
 )+c(HAsO
)+c(HAsO )+c(AsO
)+c(AsO )+c(H3AsO3)=0.1mol·L-1
)+c(H3AsO3)=0.1mol·L-1D.pH=12时,溶液中:c(H2AsO
 )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(H3AsO3)>c(H+)+c(K+)
)+c(H3AsO3)>c(H+)+c(K+)④废水的pH对As(V)的去除率的影响如图3所示。pH>8时,随着废水的pH增大,As(V)的去除率发生如图所示变化的原因是

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】氯、氮、硫等及其化合物性质研究。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为____ 。
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式____ 。
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析正确的是___ 。
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:
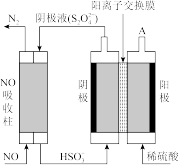
从A口中出来的物质的是____ 。写出电解池阴极的电极反应式____ 。
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
①上述实验中a=____ ,b=____ 。
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是____ (填实验编号)。

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O
 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl下列分析正确的是
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:

从A口中出来的物质的是
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO
 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | b | 124 |
| III | 350 | a | 5.80×10-3 | 82 |
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】油气开采过程中会产生有害的 ,油气脱硫一直是石油工业研究的重点。
,油气脱硫一直是石油工业研究的重点。
(1)输油、输气的钢管被原油、天然气中的含硫化合物腐蚀属于_______ 腐蚀(填“化学”或“电化学”)。
(2)石化工业,常采用碳酸钠溶液作为脱硫吸收剂。
①已知: ,
,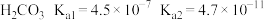 ;
;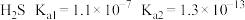 。请写出
。请写出 与足量碳酸钠溶液反应的离子方程式:
与足量碳酸钠溶液反应的离子方程式:_______ 。
②工业生产中常采用从吸收塔顶淋入吸收液、塔底通入待处理油气的逆流喷淋吸收法,这样做的好处是_______ 。
(3) 与
与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: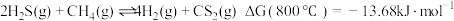
①该反应在给定条件下是否能自发进行?_______ (填“是”或“否”)。
在研究反应发生的适宜条件时,发现:过多的 会导致
会导致 催化剂失活;
催化剂失活; 助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题:
助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题:
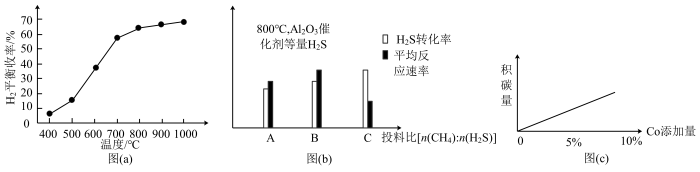
②图(a)为随温度升高,氢气平衡收率图,由图像可知该反应正向
_______ 0(填“>”或“<”)。
③图(b)为 ,
, 催化剂条件下投入等量
催化剂条件下投入等量 ,投料比[
,投料比[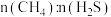 ]分别为1∶1,1∶3、12∶1达平衡时
]分别为1∶1,1∶3、12∶1达平衡时 转化率、平均反应速率图。请判断投料比
转化率、平均反应速率图。请判断投料比 对应图中
对应图中_______ 组图像(填“A”“B”或“C”);在三组图像中,C组图像中平均速率最低的可能原因是_______ 。
④未添加 助剂时,无积碳,随着
助剂时,无积碳,随着 添加量的变化,积碳量变化如图(c)所示,由此可推知,
添加量的变化,积碳量变化如图(c)所示,由此可推知, 助剂可能催化了原料气发生的
助剂可能催化了原料气发生的_______ 反应(填化学方程式)。
(4)油气脱硫也可以采用电解法,原理如图所示:
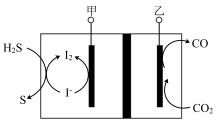
请写出甲电极所在区域发生的总电极反应式:_______ 。
 ,油气脱硫一直是石油工业研究的重点。
,油气脱硫一直是石油工业研究的重点。(1)输油、输气的钢管被原油、天然气中的含硫化合物腐蚀属于
(2)石化工业,常采用碳酸钠溶液作为脱硫吸收剂。
①已知:
 ,
,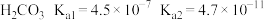 ;
;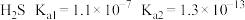 。请写出
。请写出 与足量碳酸钠溶液反应的离子方程式:
与足量碳酸钠溶液反应的离子方程式:②工业生产中常采用从吸收塔顶淋入吸收液、塔底通入待处理油气的逆流喷淋吸收法,这样做的好处是
(3)
 与
与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: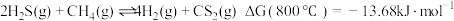
①该反应在给定条件下是否能自发进行?
在研究反应发生的适宜条件时,发现:过多的
 会导致
会导致 催化剂失活;
催化剂失活; 助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题:
助剂有稳定催化剂的作用。同时,得出一组图像,请根据图中信息回答问题:
②图(a)为随温度升高,氢气平衡收率图,由图像可知该反应正向

③图(b)为
 ,
, 催化剂条件下投入等量
催化剂条件下投入等量 ,投料比[
,投料比[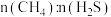 ]分别为1∶1,1∶3、12∶1达平衡时
]分别为1∶1,1∶3、12∶1达平衡时 转化率、平均反应速率图。请判断投料比
转化率、平均反应速率图。请判断投料比 对应图中
对应图中④未添加
 助剂时,无积碳,随着
助剂时,无积碳,随着 添加量的变化,积碳量变化如图(c)所示,由此可推知,
添加量的变化,积碳量变化如图(c)所示,由此可推知, 助剂可能催化了原料气发生的
助剂可能催化了原料气发生的(4)油气脱硫也可以采用电解法,原理如图所示:

请写出甲电极所在区域发生的总电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收得到Na2Cr2O7等物质。
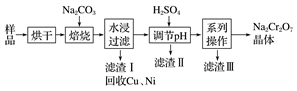
已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②不同钠盐在不同温度下的溶解度(g)如下表
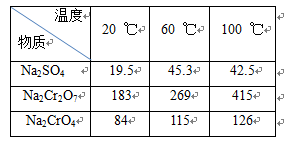
(1)水浸后的溶液呈________ (“酸”“碱”或“中”)性。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
______________________________
(3)滤渣Ⅱ的主要成分有Zn(OH)2、________ 。
(4)“系列操作”中为继续加入H2SO4,________________ (填操作方法),过滤。继续加入H2SO4目的是_____________________ (结合平衡移动的原理予 以说明)。
以说明)。
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式:________________________________________________ 。

已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②不同钠盐在不同温度下的溶解度(g)如下表

(1)水浸后的溶液呈
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
(3)滤渣Ⅱ的主要成分有Zn(OH)2、
(4)“系列操作”中为继续加入H2SO4,
 以说明)。
以说明)。(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】对CO2及氮氧化物的研究以有更大意义:
(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、
H2的热值为142.9kJ/g,则CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) △H=___________ 。
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)⇌2NO2(g) △H3<0
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是___________ 。

A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
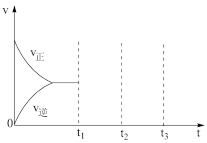
② 将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。___________
(3)常温常压下,空气中的CO2溶于水,达到平衡时碳酸分子浓度1.5×10-5mol/L,溶液的pH=5.6,(已知10-5.6=2.5×10-6)。
①Ka1=___________ (忽略碳酸二级电离), 向NaClO溶液中,通入少量CO2,反应的离子方程式为:___________ ;
② 熔融碳酸盐(传导 )电解技术是一种吸收空气中CO2的新方法,其工作原理如图所示,写出电解时阴极的电极反应式
)电解技术是一种吸收空气中CO2的新方法,其工作原理如图所示,写出电解时阴极的电极反应式___________ 。

(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、
H2的热值为142.9kJ/g,则CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) △H=
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)⇌2NO2(g) △H3<0
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是

A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
② 将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。

(3)常温常压下,空气中的CO2溶于水,达到平衡时碳酸分子浓度1.5×10-5mol/L,溶液的pH=5.6,(已知10-5.6=2.5×10-6)。
| 弱酸 | HClO | H2CO3 |
| 电离常数 | Ka=4.7×10-8 | Ka1; Ka2=5.6×10-11 |
② 熔融碳酸盐(传导
 )电解技术是一种吸收空气中CO2的新方法,其工作原理如图所示,写出电解时阴极的电极反应式
)电解技术是一种吸收空气中CO2的新方法,其工作原理如图所示,写出电解时阴极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】铵盐是比较重要的盐类物质,请回答下列问题。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中HC2O 、 C2O
、 C2O 、NH
、NH 、H2C2O4、 H+五种粒子浓度由大到小的顺序为
、H2C2O4、 H+五种粒子浓度由大到小的顺序为_______ 。
②NH4HC2O4溶液中,c(H2C2O4)-c(C2O )=
)=_______ 。
(2)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
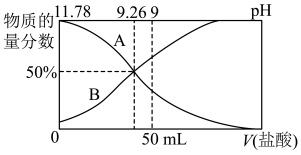
a.表示NH3·H2O物质的量分数变化的曲线是_______ (填“A”或“B”)。
b.NH3·H2O的电离常数为_______ 。
c.当加入盐酸的体积为50 mL时,溶液中c(NH )-c(NH3·H2O)=
)-c(NH3·H2O)=_______ mol·L-1(用式子表示)。
②常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH 的水解常数Kh=
的水解常数Kh=_______ (用含a、b的代数式表示)。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中HC2O
 、 C2O
、 C2O 、NH
、NH 、H2C2O4、 H+五种粒子浓度由大到小的顺序为
、H2C2O4、 H+五种粒子浓度由大到小的顺序为②NH4HC2O4溶液中,c(H2C2O4)-c(C2O
 )=
)=(2)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH
 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
a.表示NH3·H2O物质的量分数变化的曲线是
b.NH3·H2O的电离常数为
c.当加入盐酸的体积为50 mL时,溶液中c(NH
 )-c(NH3·H2O)=
)-c(NH3·H2O)=②常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH
 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氨气在产生、生活中都有广泛用途,所以,化学学习中对氨气认识十分重要。
(1)已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol,合成氨的热化学方程式为_____________ 。
(2)下列方法可以证明 N2(g)+3H2(g) 2NH3(g)已达平衡状态的是
2NH3(g)已达平衡状态的是____ 。
①单位时间内生成n mol H2同时生成n molNH3
②单位时间内3molH—H键断裂同时有6 mol H—N键断裂
③温度和体积一定时,容器内压强不再变化
④c(N2)︰c(H2)︰c(NH3)=1︰3︰2
⑤反应速率2v(H2)= 3v(NH3)
⑥条件一定,混合气体的平均相对分子质量不再变化
⑦温度和体积一定时,混合气体的密度不再变化
(3) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得pH=11,则该条件下,NH3•H2O的电离平衡常数约为__________ 。向此溶液中加入少量的氯化铵固体时,[c(NH3•H2O) • c(H+)] / c(NH4+)值将______ (“增大”“减小”或“不变”)。
(4)若向该氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH(pOH=-lg[OH-])的变化关系如图所示。
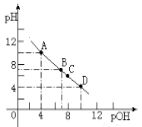
B点所加盐酸的体积_____ (填“>”、“=”或“<”) 20.0 mL。C点溶液中离子浓度大小顺序为_____ >____ >_____ >_____ 。
(5)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=_________ 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)。
(1)已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol,合成氨的热化学方程式为
(2)下列方法可以证明 N2(g)+3H2(g)
 2NH3(g)已达平衡状态的是
2NH3(g)已达平衡状态的是①单位时间内生成n mol H2同时生成n molNH3
②单位时间内3molH—H键断裂同时有6 mol H—N键断裂
③温度和体积一定时,容器内压强不再变化
④c(N2)︰c(H2)︰c(NH3)=1︰3︰2
⑤反应速率2v(H2)= 3v(NH3)
⑥条件一定,混合气体的平均相对分子质量不再变化
⑦温度和体积一定时,混合气体的密度不再变化
(3) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得pH=11,则该条件下,NH3•H2O的电离平衡常数约为
(4)若向该氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH(pOH=-lg[OH-])的变化关系如图所示。

B点所加盐酸的体积
(5)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=
您最近一年使用:0次



