(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
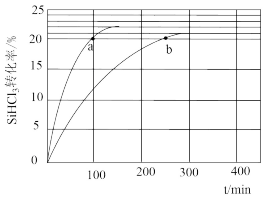
①343 K时反应的平衡转化率α=________ %。平衡常数K343 K=________ (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________ ;要缩短反应达到平衡的时间,可采取的措施有________ 、________ 。
③比较a、b处反应速率大小:va________ vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________ (保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
①请用文字解释随温度升高水的离子积增大的原因 _______________ ;
②10℃时纯水的电离平衡常数为_________ ;计算100℃时纯水中电离产生的氢离子浓度为__________________ 。

①343 K时反应的平衡转化率α=
②在343 K下:要提高SiHCl3转化率,可采取的措施是
③比较a、b处反应速率大小:va
(2)不同温度下水的离子积常数如表所示:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
②10℃时纯水的电离平衡常数为
更新时间:2019-03-06 21:29:45
|
相似题推荐
【推荐1】 的捕集和利用是实现“碳中和”的有效途径。
的捕集和利用是实现“碳中和”的有效途径。
(1)CaO可在较高温度下捕集 。工业制备CaO的工艺有两种:
。工业制备CaO的工艺有两种:
ⅰ. 热分解制备
热分解制备
ⅱ.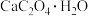 热分解制备
热分解制备
其中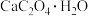 在隔绝空气加热升温过程中固体残留率的变化如图1所示(
在隔绝空气加热升温过程中固体残留率的变化如图1所示( )。
)。_______ (填化学式,下同)转化为_______ 。
②已知分解反应放出的气体越多,制得的固体越疏松多孔,则工艺_______ (填“ⅰ”或“ⅱ”)得到的CaO具有更好的 捕集性能。
捕集性能。
(2)在恒容密闭反应器中充入物质的量之比为1:1的 和
和 的混合气体,可发生以下反应:
的混合气体,可发生以下反应:
ⅰ.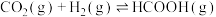
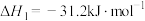
ⅱ.

在相同时间内, 的转化率、HCOOH的选择性与温度的关系如图2所示。
的转化率、HCOOH的选择性与温度的关系如图2所示。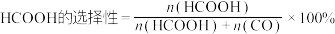 ,CO的选择性与HCOOH的选择性的计算方式相似。
,CO的选择性与HCOOH的选择性的计算方式相似。
①反应ⅰ在相对_______ (填“较低”或“较高”)温度下易自发进行;温度低于673K时,CO的选择性随温度升高而_______ (填字母)。
a.减小 b.增大 c.不变 d.无法判断
②温度高于673K时,随温度升高,HCOOH的选择性减小的原因可能是_______ (已知反应均未达到平衡状态)。
③平衡时再充入0.1mol 和0.1mol
和0.1mol  ,再次平衡时
,再次平衡时 的转化率
的转化率_______ (填“减小”“增大”或“不变”)。
(3)一定温度时,将一定量的 和
和 (物质的量之比为1:1)充入某恒容密闭容器中发生(2)中反应ⅰ和ⅱ,达到平衡时
(物质的量之比为1:1)充入某恒容密闭容器中发生(2)中反应ⅰ和ⅱ,达到平衡时 的转化率为y,CO的选择性为x,体系中氢气的分压为
的转化率为y,CO的选择性为x,体系中氢气的分压为 ,则反应ⅰ的压强平衡常数
,则反应ⅰ的压强平衡常数
_______  (用含x、y、
(用含x、y、 的代数式表示)。
的代数式表示)。
(4)研究发现,用氮化铁作催化材料,对 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图3所示,沿z轴方向的投影如图4所示,A原子的分数坐标为(0,0,0),B原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图3所示,沿z轴方向的投影如图4所示,A原子的分数坐标为(0,0,0),B原子的分数坐标为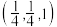 ,则C原子的分数坐标为
,则C原子的分数坐标为_______ (用含b、c的代数式表示);设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______ g· (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 的捕集和利用是实现“碳中和”的有效途径。
的捕集和利用是实现“碳中和”的有效途径。(1)CaO可在较高温度下捕集
 。工业制备CaO的工艺有两种:
。工业制备CaO的工艺有两种:ⅰ.
 热分解制备
热分解制备ⅱ.
 热分解制备
热分解制备其中
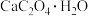 在隔绝空气加热升温过程中固体残留率的变化如图1所示(
在隔绝空气加热升温过程中固体残留率的变化如图1所示( )。
)。
②已知分解反应放出的气体越多,制得的固体越疏松多孔,则工艺
 捕集性能。
捕集性能。(2)在恒容密闭反应器中充入物质的量之比为1:1的
 和
和 的混合气体,可发生以下反应:
的混合气体,可发生以下反应:ⅰ.
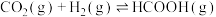
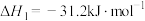
ⅱ.


在相同时间内,
 的转化率、HCOOH的选择性与温度的关系如图2所示。
的转化率、HCOOH的选择性与温度的关系如图2所示。
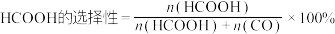 ,CO的选择性与HCOOH的选择性的计算方式相似。
,CO的选择性与HCOOH的选择性的计算方式相似。①反应ⅰ在相对
a.减小 b.增大 c.不变 d.无法判断
②温度高于673K时,随温度升高,HCOOH的选择性减小的原因可能是
③平衡时再充入0.1mol
 和0.1mol
和0.1mol  ,再次平衡时
,再次平衡时 的转化率
的转化率(3)一定温度时,将一定量的
 和
和 (物质的量之比为1:1)充入某恒容密闭容器中发生(2)中反应ⅰ和ⅱ,达到平衡时
(物质的量之比为1:1)充入某恒容密闭容器中发生(2)中反应ⅰ和ⅱ,达到平衡时 的转化率为y,CO的选择性为x,体系中氢气的分压为
的转化率为y,CO的选择性为x,体系中氢气的分压为 ,则反应ⅰ的压强平衡常数
,则反应ⅰ的压强平衡常数
 (用含x、y、
(用含x、y、 的代数式表示)。
的代数式表示)。(4)研究发现,用氮化铁作催化材料,对
 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图3所示,沿z轴方向的投影如图4所示,A原子的分数坐标为(0,0,0),B原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图3所示,沿z轴方向的投影如图4所示,A原子的分数坐标为(0,0,0),B原子的分数坐标为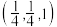 ,则C原子的分数坐标为
,则C原子的分数坐标为 ,该晶体的密度为
,该晶体的密度为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566 kJ/mol
S(l)+O2(g)=SO2(g) ΔH2=-296 kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________ 。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)=____________ mol·L-1·min-1。

②CO2平衡时的体积分数为_______________ ,该温度下Kp为__________ (用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是______________ 。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
则乙容器中反应起始向________ 方向进行;c1_________ (填“>”“<”或“=”)c2。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566 kJ/mol
S(l)+O2(g)=SO2(g) ΔH2=-296 kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)①反应进行到4 min 时,v(正)

②CO2平衡时的体积分数为
③下列能说明该反应已达到平衡状态的是
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 容器甲 | 容器乙 |
| 反应物起始投入量 | 1 mol CO2,3 mol H2 | 0.5 mol CO2,1 mol H2 1 mol CH3OH,1 mol H2O |
| CH3OH的平衡浓度/mol·L-1 | C1 | C2 |
则乙容器中反应起始向
您最近一年使用:0次
【推荐3】一碳化学的研究对象是分子中只含一个碳原子的化合物,如一氧化碳、二氧化碳、甲烷、甲醇等。在以石油、天然气为基本原料的化学工业里,甲烷是一碳化学的起点。在以煤炭为基本原料的化学工业里一氧化碳是一碳化学的出发点。一碳化学研究是从这两种原料出发,生产其他化工原料和产品的方法。请回答下列问题:
(1)已知:氧气中O=O键的键能为497kJ·mol-1,二氧化碳中C=O键的键能为745kJ·mol-1。
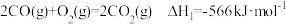
则使1molCO(g)完全分解成原子所需要的能量至少为__ kJ。
(2)一定条件下,将 的混合气体充入恒温恒容的密闭容器中合成甲醇:
的混合气体充入恒温恒容的密闭容器中合成甲醇: 。
。
①下列叙述能说明反应达到化学平衡状态的是__ (填标号)。
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
D.若将容器改为绝热恒容容器,体系温度不随时间变化而变化
②下列措施既能提高H2的转化率又能加快反应速率的是__ (填标号)。
A.升高温度 B.使用高效催化剂 C.增加CO投料
(3)在容积为1L的恒容密闭容器中通入1molCO和2mol H2,发生的反应为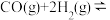
 ,平衡时测得混合气体中
,平衡时测得混合气体中 的物质的量分数
的物质的量分数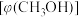 与温度(T)、压强(P)之间的关系如图所示。
与温度(T)、压强(P)之间的关系如图所示。

①温度为T1和T2时对应的平衡常数分别为K1、K2,则K1__ (填“>”、“<”或“=”)K2;温度为T1、压强为p1kPa时,CH3OH的平衡产率为____ (保留四位有效数字),该反应的平衡常数K=___ 。
②若在温度为T1、压强为p1kPa的条件下向上述容器中加入1molCO、2molH2、1molCH3OH,反应开始时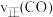
___ (填“>”“<”“”或“无法确定”)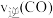 。
。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数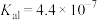 、
、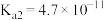 ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中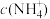
__ (填“>”、“<”或“=”) 。
。
(1)已知:氧气中O=O键的键能为497kJ·mol-1,二氧化碳中C=O键的键能为745kJ·mol-1。
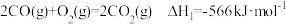
则使1molCO(g)完全分解成原子所需要的能量至少为
(2)一定条件下,将
 的混合气体充入恒温恒容的密闭容器中合成甲醇:
的混合气体充入恒温恒容的密闭容器中合成甲醇: 。
。①下列叙述能说明反应达到化学平衡状态的是
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
D.若将容器改为绝热恒容容器,体系温度不随时间变化而变化
②下列措施既能提高H2的转化率又能加快反应速率的是
A.升高温度 B.使用高效催化剂 C.增加CO投料
(3)在容积为1L的恒容密闭容器中通入1molCO和2mol H2,发生的反应为
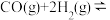
 ,平衡时测得混合气体中
,平衡时测得混合气体中 的物质的量分数
的物质的量分数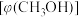 与温度(T)、压强(P)之间的关系如图所示。
与温度(T)、压强(P)之间的关系如图所示。
①温度为T1和T2时对应的平衡常数分别为K1、K2,则K1
②若在温度为T1、压强为p1kPa的条件下向上述容器中加入1molCO、2molH2、1molCH3OH,反应开始时
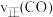
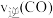 。
。(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体
 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数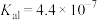 、
、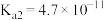 ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中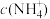
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】已知草酸为二元弱酸:H2C2O4
 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中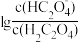 或
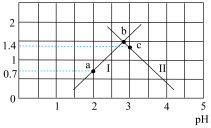
或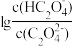 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=__________ ,Ka2=__________ 。
(2)如果所得溶液溶质为KHC2O4,则该溶液显________ (填“酸性”“碱性”或“中性”)。
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为__________ 。
(4)a、b、c三点,水的电离程度的变化趋势是___________ 。
(5)已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,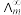 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 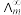 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。
①该条件下测定的0.01mol/L乙酸中的c(H+)为_________ mol/L。
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐_______ (填化学式)。

 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中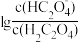 或
或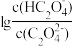 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
回答下列问题:
(1)常温下,草酸的电离常数Ka1=
(2)如果所得溶液溶质为KHC2O4,则该溶液显
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为
(4)a、b、c三点,水的电离程度的变化趋势是
(5)已知电离度
 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,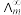 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 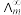 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。①该条件下测定的0.01mol/L乙酸中的c(H+)为
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐
| 离子种类 |  | Cl- | CH3COO- | K+ | Na+ |
| 摩尔电导率/(10-4 S·m2·mol-1) . | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
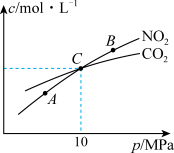
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
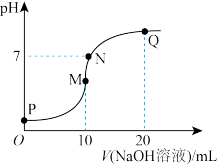
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
 )
)b.N点c(NH
 )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)c.Q点c(NH
 )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】I.高铁酸钾(K2FeO4)具有很强的氧化性,在生产,生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____ 。
(2)制备K2FeO4可以采用湿式氧化法,流程如图:

已知:①温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
①该生产工艺应在_____ (填“温度较高”或“温度较低”)的情况下进行。
②写出产生K2FeO4的离子方程式_________ 。
(3)实验室模拟工业电解法制取K2FeO4,装置如图.
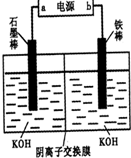
①此装置中电源的负极是______ (填“a”或“b”).
②阳极的电极反应式为______ .
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因_____________ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_____ (填“>”、“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(H+)。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是
(2)制备K2FeO4可以采用湿式氧化法,流程如图:

已知:①温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
①该生产工艺应在
②写出产生K2FeO4的离子方程式
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是
②阳极的电极反应式为
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因
(2)混合溶液中由水电离出的c(H+)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】I.常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________ (填“>”“<”或“=”)n。
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=________ 。
(3)常温时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=________ 。
(4)已知NH3•H2O的Kb=1.8×10-5,H2CO3的Ka1=4×10-7,Ka2=4×10-11,则反应NH3•H2O+H2CO3 NH
NH +HCO
+HCO +H2O的平衡常数K=
+H2O的平衡常数K=________ 。
Ⅱ.某实验小组用已知浓度的NaOH溶液滴定未知浓度的盐酸。
(5)①量取待测盐酸20.00mL放入锥形瓶中,向其中滴加2滴酚酞溶液作指示剂。
②用0.1000mol•L-1的NaOH溶液滴定。
如何判断滴定终点________ 。
(6)实验记录如表。计算可得,待测盐酸浓度为________ mol/L。
(7)误差分析:滴定时,若加入待测盐酸前用待测盐酸润洗锥形瓶,将导致测定结果________ (填“偏大”、“偏小”或“不变”)。
(8)常温下,将pH=3的盐酸与pH=11的氨水等体积混合,混合后溶液的pH________ 7(用>、=、<表示)。
| 弱酸 | CH3COOH | NH3•H2O | H2CO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Kb=1.8×10-5 | Ka1=4×10-7 Ka2=4×10-11 |
(1)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=
(3)常温时,向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=
(4)已知NH3•H2O的Kb=1.8×10-5,H2CO3的Ka1=4×10-7,Ka2=4×10-11,则反应NH3•H2O+H2CO3
 NH
NH +HCO
+HCO +H2O的平衡常数K=
+H2O的平衡常数K=Ⅱ.某实验小组用已知浓度的NaOH溶液滴定未知浓度的盐酸。
(5)①量取待测盐酸20.00mL放入锥形瓶中,向其中滴加2滴酚酞溶液作指示剂。
②用0.1000mol•L-1的NaOH溶液滴定。
如何判断滴定终点
(6)实验记录如表。计算可得,待测盐酸浓度为
| 滴定次数 | 滴定管中液面初始读数/mL | 滴定终点液面读数/mL |
| 1 | 0.00 | 15.04 |
| 2 | 1.20 | 16.26 |
| 3 | 0.02 | 15.10 |
(7)误差分析:滴定时,若加入待测盐酸前用待测盐酸润洗锥形瓶,将导致测定结果
(8)常温下,将pH=3的盐酸与pH=11的氨水等体积混合,混合后溶液的pH
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液中的Kw=____ (填数值),由水电离出的c(H+)=_____ mol•L-1。
②溶液中c(NH )+c(NH3•H2O)
)+c(NH3•H2O)_____ c(Al3+)+c[Al(OH)3](填“>”“=”或“<”);2c(SO )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=_____ mol•L-1(填精确计算式)。
(2)80℃时,0.1mol•L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是____ 。
(3)常温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①图中a、b、c、d四点中水的电离程度最大的是____ 。
②向NH4HSO4溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式_____ 。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是____ 。
(1)常温时,0.1mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液中的Kw=
②溶液中c(NH
 )+c(NH3•H2O)
)+c(NH3•H2O) )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=(2)80℃时,0.1mol•L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是
(3)常温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①图中a、b、c、d四点中水的电离程度最大的是
②向NH4HSO4溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ. 下的某溶液中,
下的某溶液中,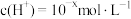 ,
,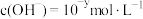 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
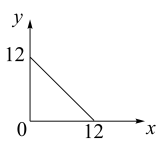
(1)在此温度下,向 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:
假设溶液混合前后的体积变化忽略不计,则
_______ ,实验②中由水电离产生的
_______  。
。
(2)在此温度下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为_______ 。
Ⅱ.在保持体系总压为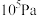 的条件下进行反应:
的条件下进行反应: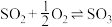 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:

(3)图中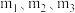 的大小顺序为
的大小顺序为_______ 。
(4)图中A点原料气的成分: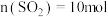 ,
,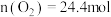 ,
, ,达平衡时
,达平衡时 的分压
的分压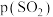 为
为_______  (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
(5)若在容积均为2L的密闭容器内, 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: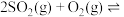
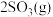
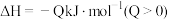 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
三个容器中的反应分别达平衡时下列各组数据关系正确的是_______(填字母)。
Ⅲ. 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: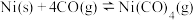
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和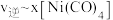 的关系如图所示:
的关系如图所示:
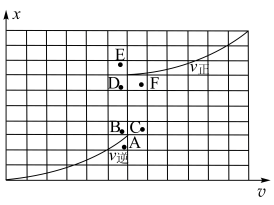
(6)当降低温度时,反应重新达到平衡, 和
和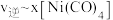 相对应的点分别为
相对应的点分别为_______ 、_______ (填字母)。
 下的某溶液中,
下的某溶液中,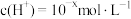 ,
,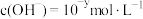 ,
, 与
与 的关系如下图所示:
的关系如下图所示:
(1)在此温度下,向
 溶液中逐滴加入
溶液中逐滴加入 的盐酸,测得混合溶液的部分
的盐酸,测得混合溶液的部分 如表所示:
如表所示:| 实验序号 |  溶液的体积/mL 溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |


 。
。(2)在此温度下,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得溶液的
混合,所得溶液的 为
为Ⅱ.在保持体系总压为
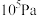 的条件下进行反应:
的条件下进行反应: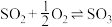 ,原料气中
,原料气中 和
和 的物质的量之比
的物质的量之比 不同时,
不同时, 的平衡转化率与温度
的平衡转化率与温度 的关系如图所示:
的关系如图所示:
(3)图中
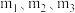 的大小顺序为
的大小顺序为(4)图中A点原料气的成分:
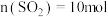 ,
,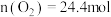 ,
, ,达平衡时
,达平衡时 的分压
的分压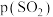 为
为 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。(5)若在容积均为2L的密闭容器内,
 时按不同方式投入反应物,发生反应:
时按不同方式投入反应物,发生反应: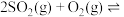
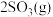
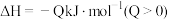 ,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
,保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 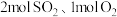 | 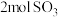 |  |
平衡时n( ) ) |  |  |  |
| 反应的能量变化 | 放出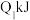 | 吸收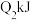 | 放出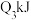 |
| 体系的压强 |  |  |  |
| 反应物的转化率 | 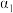 | 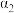 | 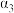 |
A.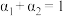 |
B.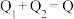 |
C. |
D. |
E. |
F.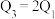 |
Ⅲ.
 与
与 发生羰化反应形成的络合物可作为催化剂。
发生羰化反应形成的络合物可作为催化剂。 的羰化反应为:
的羰化反应为: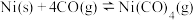
 ,
, 温度下测得一定的实验数据,计算
温度下测得一定的实验数据,计算 和
和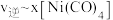 的关系如图所示:
的关系如图所示:
(6)当降低温度时,反应重新达到平衡,
 和
和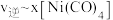 相对应的点分别为
相对应的点分别为
您最近一年使用:0次



