解题方法
1 . 用下列装置进行实验,不能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 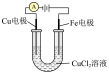 | 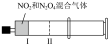 | 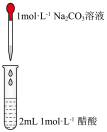 | 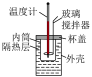 |
| 实验目的 | 铁电极上镀铜 | 探究压强对化学平衡的影响 | 比较 的 的 与 与 的 的 的大小 的大小 | 测定盐酸与NaOH反应的中和热 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 下列反应的离子方程式表示错误的是
A.泡沫灭火器的反应原理: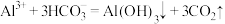 |
B.硝酸银溶液中加入足量稀氨水: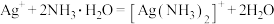 |
C.少量 通入 通入 溶液中: 溶液中: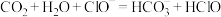 |
D.硫化氢通入 溶液中: 溶液中: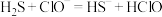 |
您最近半年使用:0次
2024-02-02更新
|
65次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
3 . 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫___________ ,乙酸的官能团是___________ (写名称).
(2)实验室常用图装置制备乙酸乙酯.
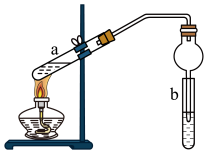
①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是___________ ,浓硫酸的作用是___________ ,a试管中主要反应的化学方程式为______________________________ .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________ .
(3)醋酸能除水垢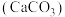 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________________ .
(4) ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
①
___________ ;②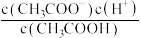
___________ ;③
___________ .
(5)室温下,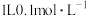 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为___________ .
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫
(2)实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)醋酸能除水垢
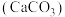 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)
 ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①

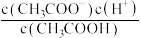

(5)室温下,
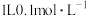 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为
您最近半年使用:0次
名校
4 . 化学中,酸的电离平衡常数( )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
回答下列问题:
(1)T℃下, 的电离平衡常数为
的电离平衡常数为 ,则T
,则T___________ 25℃(选填“>”、“<”或“=”)估算T℃下, 溶液的
溶液的
___________ mol/L;保持温度不变,将该溶液加水稀释至0.01mol/L下列物理量增大的是___________ 。
a. b.
b.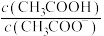 c.
c. d.电离度α
d.电离度α
(2)根据以上数据,写出将少量 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:___________ 。
(3) 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: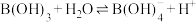 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数___________ (列出原始计算式,不计算结果)
(4) 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式:___________ 。根据上表中的数据,写出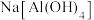 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
 )是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):
)是评估酸性强弱的重要依据。已知下列酸的电离平衡常数数据(25℃):| 酸 |  |  | HClO |  |  |
 |  | 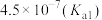 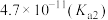 |  | 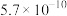 | 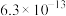 |
(1)T℃下,
 的电离平衡常数为
的电离平衡常数为 ,则T
,则T 溶液的
溶液的
a.
 b.
b.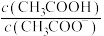 c.
c. d.电离度α
d.电离度α(2)根据以上数据,写出将少量
 气体通入NaClO溶液反应的离子方程式:
气体通入NaClO溶液反应的离子方程式:(3)
 是一元酸,其在水中的电离方程式为:
是一元酸,其在水中的电离方程式为: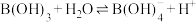 。利用上表中的数据,计算反应
。利用上表中的数据,计算反应 的平衡常数
的平衡常数(4)
 的酸式电离与
的酸式电离与 类似,在水中电离生成
类似,在水中电离生成 ,试写出
,试写出 酸式电离的电离方程式:
酸式电离的电离方程式: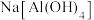 溶液与
溶液与 溶液反应的化学方程式:
溶液反应的化学方程式:
您最近半年使用:0次
名校
5 . 按要求完成下列试题:
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,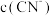
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
③室温下,一定浓度的 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=___________ 。
④将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)室温下, 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中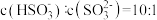 ,溶液的pH=
,溶液的pH=___________ 。(室温下, 的
的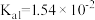 ;
; )
)
II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为_______ ;B的原子核外电子运动状态有_________ 种,
(4)C的最外层电子排布式为________ ;D的原子结构示意图为________ 。
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 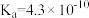 |  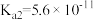 |
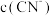
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.
 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③室温下,一定浓度的
 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=④将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)室温下,
 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中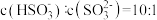 ,溶液的pH=
,溶液的pH= 的
的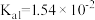 ;
; )
)II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为
(4)C的最外层电子排布式为
您最近半年使用:0次
名校
解题方法
6 . 已知:
(1)浓度均为0.1mol/L的下列四种溶液,pH由小到大排列的顺序是___________ (填标号)。
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是___________ (填标号)。
A.c(H+) B. C.
C. D.
D. E.
E.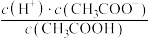
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸___________ 盐酸(填“>”、“<”或“=”)。
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =___________ 。
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈___________ (填标号)。
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为___________ (忽略溶液混合时体积的变化)。
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为___________ 。
| CH3COOH | H2CO3 | HClO | H2C2O4 | NH3·H2O | |
| 电离平衡常数 (25℃) |  |   | Ka= | Ka1=5.6×10-2 Ka2=5.4×10-5 |  |
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是
A.c(H+) B.
 C.
C. D.
D. E.
E.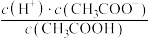
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为
您最近半年使用:0次
名校
7 . 根据表中信息,判断下列说法不正确的是
| 酸 | 电离常数(常温下) |
| CH3COOH | Ka=1.8×10-5 |
| H2CO3 | Ka1=4.5×10-7,Ka2=4.7×10-11 |
| H2S | Ka1=1.3×10-7,Ka2=1.1×10-11 |
| A.酸性由强到弱:CH3COOH>H2CO3>H2S |
| B.CH3COOH能与Na2CO3反应生成CO2 |
| C.H2S能与NaHCO3反应生成CO2 |
| D.往Na2S溶液中通入足量CO2能生成H2S |
您最近半年使用:0次
8 . 能够抵抗外加少量强酸、强碱或水稀释,而保持pH基本不变的溶液称为缓冲溶液。某化学学习小组配制不同浓度的NH4Cl-NH3缓冲溶液,探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸和抗碱的影响。
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。

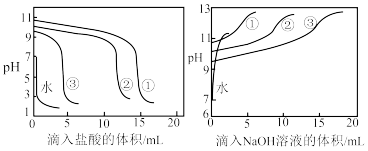
对于实验2,下列说法错误的是
实验1:配制缓冲溶液
该小组先配制0.1mol·L-1NH4Cl溶液和0.1mol·L-1氨水,再将NH4Cl溶液和氨水按照1:4、1:1和4:1的比例混合后,分别配制成15mL缓冲溶液①、②、③,测得pH分别为10.6、10.1和9.6。
实验2:探究c(NH4Cl)/c(NH3)对缓冲溶液抗酸、抗碱能力的影响
分别向滴定管中加入0.1mol·L-1盐酸和0.1mol·L-1NaOH溶液,逐滴滴入缓冲溶液①②③和等量蒸馏水中,测得pH与滴入的盐酸、NaOH溶液体积的关系如图所示。


对于实验2,下列说法错误的是
| A.c(NH4Cl)/c(NH3)=4:1时,缓冲溶液抗碱能力最强 |
| B.c(NH4Cl)/c(NH3)不变时,c(NH4Cl)+c(NH3)越大,抗酸抗碱能力越强 |
| C.缓冲溶液抗酸、抗碱最佳比例为c(NH4Cl)/c(NH3)=1:1 |
| D.向上述缓冲溶液中加入少量盐酸或NaOH溶液时,水的电离程度均增加 |
您最近半年使用:0次
名校
9 . 砷(As)是一种重要的非金属元素,常用于农药、杀虫剂等领域。
(1)亚砷酸( )可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向
)可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向 溶液中滴加
溶液中滴加 溶液,各种微粒物质的量分数与溶液pH关系如图所示。
溶液,各种微粒物质的量分数与溶液pH关系如图所示。
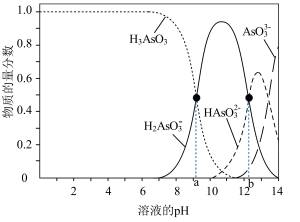
①结合化学用语解释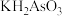 溶液显碱性的原因
溶液显碱性的原因___________ 。
②下列说法正确的是___________ (填字母)。
a.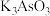 溶液:
溶液:
b.当 时,溶液中:
时,溶液中: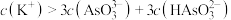
c.当 时,向该溶液中加一定量的水,则溶液中
时,向该溶液中加一定量的水,则溶液中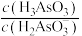 增大
增大
(2)三价砷[As(Ⅲ)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水。向废水中先加入适量漂白粉氧化(氧化后溶液pH约为8),再加入生石灰将砷元素转化为 沉淀。
沉淀。
资料:a.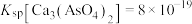 ,
, 较
较 更难溶于水,溶液中离子浓度
更难溶于水,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;
b.一定条件下,As(Ⅴ)的存在形式如下图所示:
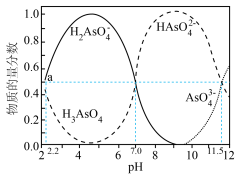
ⅰ.加入生石灰的作用是____________ 。
ⅱ.当除去 时,溶液中的
时,溶液中的 至少为
至少为___________  。
。
ⅲ.若氧化不充分,会使该方法处理后废水中的含砷量___________ (填“偏高”、“偏低”或“无影响”)。
②采用铁盐处理含砷废水。其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
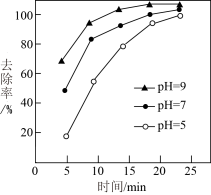
ⅰ.由图可得出的结论是___________ 。
ⅱ.10min时,不同pH溶液中砷(Ⅱ)的去除率不同,其原因是___________ 。
(1)亚砷酸(
 )可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向
)可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向 溶液中滴加
溶液中滴加 溶液,各种微粒物质的量分数与溶液pH关系如图所示。
溶液,各种微粒物质的量分数与溶液pH关系如图所示。
①结合化学用语解释
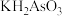 溶液显碱性的原因
溶液显碱性的原因②下列说法正确的是
a.
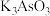 溶液:
溶液:
b.当
 时,溶液中:
时,溶液中: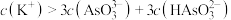
c.当
 时,向该溶液中加一定量的水,则溶液中
时,向该溶液中加一定量的水,则溶液中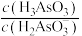 增大
增大(2)三价砷[As(Ⅲ)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水。向废水中先加入适量漂白粉氧化(氧化后溶液pH约为8),再加入生石灰将砷元素转化为
 沉淀。
沉淀。资料:a.
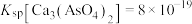 ,
, 较
较 更难溶于水,溶液中离子浓度
更难溶于水,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;b.一定条件下,As(Ⅴ)的存在形式如下图所示:

ⅰ.加入生石灰的作用是
ⅱ.当除去
 时,溶液中的
时,溶液中的 至少为
至少为 。
。ⅲ.若氧化不充分,会使该方法处理后废水中的含砷量
②采用铁盐处理含砷废水。其原理是:铁盐混凝剂在溶液中产生
 胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
ⅰ.由图可得出的结论是
ⅱ.10min时,不同pH溶液中砷(Ⅱ)的去除率不同,其原因是
您最近半年使用:0次
2023-11-29更新
|
167次组卷
|
2卷引用:北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题
名校
10 . 已知部分弱酸的电离常数如下表:
以下说法不正确的是
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数K(25℃) | 7.2×10-4 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
A.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c( )分别为a、b、c(单位为mol/L),由大到小c>a>b )分别为a、b、c(单位为mol/L),由大到小c>a>b |
B.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb= )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=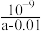 |
| C.常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是NaF |
D.将过量H2S通入Na2CO3溶液,反应的离子方程式是 +H2S= +H2S= + + |
您最近半年使用:0次



