按要求完成下列试题:
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,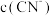
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
③室温下,一定浓度的 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=___________ 。
④将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)室温下, 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中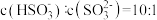 ,溶液的pH=
,溶液的pH=___________ 。(室温下, 的
的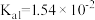 ;
; )
)
II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为_______ ;B的原子核外电子运动状态有_________ 种,
(4)C的最外层电子排布式为________ ;D的原子结构示意图为________ 。
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 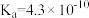 |  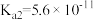 |
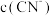
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.
 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③室温下,一定浓度的
 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=④将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)室温下,
 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中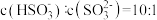 ,溶液的pH=
,溶液的pH= 的
的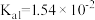 ;
; )
)II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为
(4)C的最外层电子排布式为
更新时间:2024-01-09 20:50:39
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是_____________________ 。
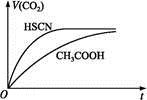
反应结束后所得两溶液中,c(CH3COO-)_____ c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是_____ (填序号)。
E.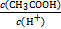
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_____ (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 _____ (填化学式)沉淀。
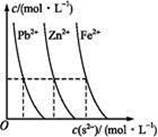
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系_________________ ,c(H2C2O4)___ c(C2 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。

反应结束后所得两溶液中,c(CH3COO-)
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
E.
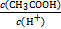
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题。
(1)在48mL0.1mol/L HNO3溶液中加入12mL0.4mol/LKOH溶液,所得溶液呈___________ (填酸性、碱性、中性)
(2)25℃时,a mol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=___________ (精确计算式)。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++ HSeO ,HSeO
,HSeO
 H++SeO
H++SeO ,Ka=10×10-2 (25℃)。
,Ka=10×10-2 (25℃)。
①向H2SeO4溶液中滴加少量氢氧化钠稀溶液,该反应的离子方程式为___________ 。
②已知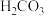 的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为
的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为___________ 。
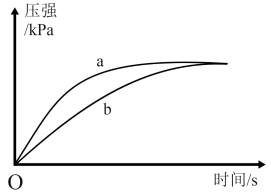
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,。在该温度下向两个锥形瓶中各加入0.5g NaHCO3粉末,塞紧橡胶塞,然后用注射器分别注入2mL2mol/LCH3COOH溶液和2mL2mol/LHSCN溶液,测得锥形瓶内气体的压强随时间的变化如图所示,则曲线___________ 表示HSCN溶液(填a或b)。
(1)在48mL0.1mol/L HNO3溶液中加入12mL0.4mol/LKOH溶液,所得溶液呈
(2)25℃时,a mol·L-1CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++ HSeO
 ,HSeO
,HSeO
 H++SeO
H++SeO ,Ka=10×10-2 (25℃)。
,Ka=10×10-2 (25℃)。①向H2SeO4溶液中滴加少量氢氧化钠稀溶液,该反应的离子方程式为
②已知
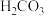 的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为
的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,。在该温度下向两个锥形瓶中各加入0.5g NaHCO3粉末,塞紧橡胶塞,然后用注射器分别注入2mL2mol/LCH3COOH溶液和2mL2mol/LHSCN溶液,测得锥形瓶内气体的压强随时间的变化如图所示,则曲线

您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知:25℃时, 、HClO、
、HClO、 ,
, 的电离平衡常数如表所示,
的电离平衡常数如表所示, 。请回答下列问题。
。请回答下列问题。
(1)等浓度的四种酸溶液的酸性由强到弱的顺序是_________ 。
(2)写出HClO在水中的电离方程式:_________ 。
(3)将10 mL 0.1 mol⋅L
 溶液逐滴滴入50 mL 0.1 mol⋅L
溶液逐滴滴入50 mL 0.1 mol⋅L
 溶液中,现象为
溶液中,现象为_________ ,写出反应的离子方程式_________ 。
(4)若将少量的 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为_________ 。
(5)25℃时,取50 mL 0.1 mol⋅L
 溶液,将其稀释100倍。
溶液,将其稀释100倍。
①稀释前 的电离度(
的电离度(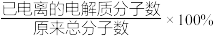 )约为
)约为_________ (保留三位有效数字)%。
②在稀释过程中,随着 浓度的降低,
浓度的降低, 逐渐
逐渐_________ (填“增大”、“减小”或“不变”)。
 、HClO、
、HClO、 ,
, 的电离平衡常数如表所示,
的电离平衡常数如表所示, 。请回答下列问题。
。请回答下列问题。| 物质 |  | HClO |  |  |
| 电离平衡常数 | 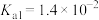 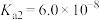 | 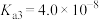 | 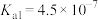  |  |
(2)写出HClO在水中的电离方程式:
(3)将10 mL 0.1 mol⋅L

 溶液逐滴滴入50 mL 0.1 mol⋅L
溶液逐滴滴入50 mL 0.1 mol⋅L
 溶液中,现象为
溶液中,现象为(4)若将少量的
 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为(5)25℃时,取50 mL 0.1 mol⋅L

 溶液,将其稀释100倍。
溶液,将其稀释100倍。①稀释前
 的电离度(
的电离度(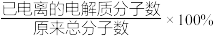 )约为
)约为②在稀释过程中,随着
 浓度的降低,
浓度的降低, 逐渐
逐渐
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】Mn与Fe两元素的部分电离能数据如下表所示:
(1)Mn与Fe两元素均位于元素周期表的___________ 区
(2)根据表中数据可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此,你的解释是
再失去1个电子难,对此,你的解释是___________ 。
| 元素 | Mn | Fe | |
| 电离能/(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn与Fe两元素均位于元素周期表的
(2)根据表中数据可知,气态
 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此,你的解释是
再失去1个电子难,对此,你的解释是
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下列表示错误的是_______ 。
A. F-的离子结构示意图: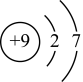
B.基态碳原子的轨道表示式: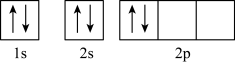
C. S2-的结构示意图:
D.核内有33个中子的Fe表示为 Fe
Fe
E.中子数为9的氮原子: N
N
F. Cl-的结构示意图: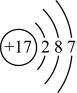
A. F-的离子结构示意图:
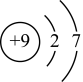
B.基态碳原子的轨道表示式:

C. S2-的结构示意图:

D.核内有33个中子的Fe表示为
 Fe
FeE.中子数为9的氮原子:
 N
NF. Cl-的结构示意图:

您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某反应体系中反应物与生成物有:K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。根据上述信息回答下列问题:
(1)S原子核外电子共占据_______ 个能级,能量最高电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)充填气象观测气球时,可用CaH2与H2O反应制H2,反应的化学方程式为_______ 。CaH2、BaH2属于_______ 晶体,熔点CaH2_______ BaH2(填>、<、=),从物质结构角度解释原因_______ 。
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
(5)已知CaC2O4在反应中失去电子,则该反应的氧化剂是_______ ,在标准状况下生成11.2L X时,有0.5mol电子转移,共消耗0.25mol CaC2O4,X的化学式为_______ 。将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:_______ 。
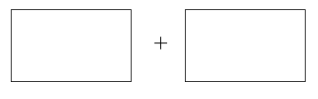
(1)S原子核外电子共占据
(2)下列说法正确的是_______。
| A.CaH2和CaO2中,阴阳离子个数比相同 |
| B.O原子与S原子核外电子的伸展方向都是4种 |
| C.H2SO4在该反应中的作用和实验室与亚硫酸钠反应制SO2时相同 |
| D.原子核外电子的能级数由少到多的顺序为:H<C<O<S |
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
| A.同浓度Na2CO3和Na2SO4的pH | B.浓硫酸和碳酸的氧化性 |
| C.CH4和H2S的稳定性 | D.CS2中共用电子对的偏移 |

您最近半年使用:0次



