(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是_____________________ 。
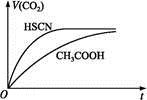
反应结束后所得两溶液中,c(CH3COO-)_____ c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是_____ (填序号)。
E.
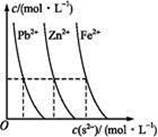
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_____ (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 _____ (填化学式)沉淀。
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系_________________ ,c(H2C2O4)___ c(C2 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。

反应结束后所得两溶液中,c(CH3COO-)
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
E.
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
2014高三·全国·专题练习 查看更多[2]
更新时间:2016-12-08 21:50:34
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】天然气高温条件下可以转化为氢气,发生反应的热化学方程式为: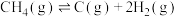
 。
。
回答下列问题:
(1)反应的平衡常数表达式为
___________ ;已知几种物质的燃烧热如下表所示,则反应的
___________ kJ·mol-1。
(2)一定温度下,在容积不变的密闭容器中充入适量 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是___________ (填序号)。
a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d. 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2
(3)在体积为2L的密闭容器中充入1mol 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:
①
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
___________ mol⋅L-1⋅min-1;达平衡时 的体积分数为
的体积分数为___________ %(结果保留1位小数)。
(4)一定温度,100kPa条件下,向密闭容器中充入 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与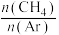 的关系如图所示。
的关系如图所示。
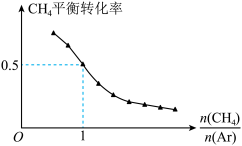
①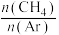 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是___________ 。
②此温度下,该反应的分压平衡常数
___________ 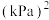 。
。
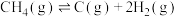
 。
。回答下列问题:
(1)反应的平衡常数表达式为


| 可燃物 |  | 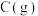 |  |
燃烧热/kJ·mol | -890.3 | -393.5 | -285.8 |
(2)一定温度下,在容积不变的密闭容器中充入适量
 发生上述反应,下列情况能说明反应达到平衡状态的是
发生上述反应,下列情况能说明反应达到平衡状态的是a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH₄体积分数不随时间变化 d.
 的消耗速率与
的消耗速率与 的生成速率之比为1∶2
的生成速率之比为1∶2(3)在体积为2L的密闭容器中充入1mol
 发生上述反应,不同温度下测得
发生上述反应,不同温度下测得 的转化率随时间的变化关系如下表所示:
的转化率随时间的变化关系如下表所示:时间/min 转化率 转化率温度/℃ | 2 | 4 | 6 | 8 | 10 |
 | 40% | 60% | 80% | 80% | 80% |
 | 20% | 30% | 40% | 60% | 60% |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 条件下,前2min内,用
条件下,前2min内,用 表示的化学反应速率
表示的化学反应速率
 的体积分数为
的体积分数为(4)一定温度,100kPa条件下,向密闭容器中充入
 、Ar气混合气体,
、Ar气混合气体, 的转化率与
的转化率与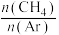 的关系如图所示。
的关系如图所示。
①
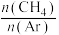 增大,
增大, 平衡转化率减小的原因是
平衡转化率减小的原因是②此温度下,该反应的分压平衡常数

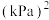 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】 可通过
可通过 与
与 在碱性溶液中反应制备。
在碱性溶液中反应制备。 和
和 均可用于氧化去除高氯(含高浓度
均可用于氧化去除高氯(含高浓度 )废水中的有机物。
)废水中的有机物。
(1)用 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。
① 时,
时,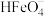 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为_______ 。
②酸性溶液中 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是_______ 。
(2)用 处理高氯废水中的有机物时,研究了“
处理高氯废水中的有机物时,研究了“ ”和“
”和“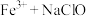 ”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
①当废水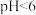 时,仅使用
时,仅使用 处理高氯废水,有机物的氧化率较低,其原因是
处理高氯废水,有机物的氧化率较低,其原因是_______ 。
②当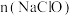 相同时,使用“
相同时,使用“ ”与“
”与“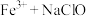 ”处理高氯废水,废水中有机物的氧化率随废水
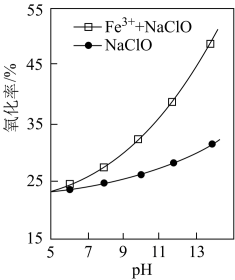
”处理高氯废水,废水中有机物的氧化率随废水 的变化如题图所示。与“
的变化如题图所示。与“ ”体系相比,“
”体系相比,“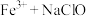 ”体系中有机物氧化率随着废水
”体系中有机物氧化率随着废水 升高显著增大的可能原因是
升高显著增大的可能原因是_______ 。
 可通过
可通过 与
与 在碱性溶液中反应制备。
在碱性溶液中反应制备。 和
和 均可用于氧化去除高氯(含高浓度
均可用于氧化去除高氯(含高浓度 )废水中的有机物。
)废水中的有机物。(1)用
 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。①
 时,
时,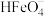 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为②酸性溶液中
 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是(2)用
 处理高氯废水中的有机物时,研究了“
处理高氯废水中的有机物时,研究了“ ”和“
”和“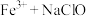 ”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。
”两种体系对高氯废水中有机物的氧化率(废水中被氧化有机物的量占废水中有机物总量的百分率)。①当废水
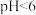 时,仅使用
时,仅使用 处理高氯废水,有机物的氧化率较低,其原因是
处理高氯废水,有机物的氧化率较低,其原因是②当
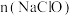 相同时,使用“
相同时,使用“ ”与“
”与“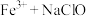 ”处理高氯废水,废水中有机物的氧化率随废水
”处理高氯废水,废水中有机物的氧化率随废水 的变化如题图所示。与“
的变化如题图所示。与“ ”体系相比,“
”体系相比,“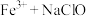 ”体系中有机物氧化率随着废水
”体系中有机物氧化率随着废水 升高显著增大的可能原因是
升高显著增大的可能原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是__________________________ 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______________________ 。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=_________ 。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式____________________________________________ 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式_______________ 。
 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦Fe ⑧金刚石 ⑨Cl2 ⑩澄清石灰水 ⑪NaOH 属于强电解质的有____ ;属于弱电解质的有:____ 。(填序号)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】滴定是一种重要的定量实验方法:
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________ (填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________ (电离度= ×100%)。
×100%)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________ b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________ mol/L。
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当___________________ 时,停止滴定,并记录NaOH溶液的最终读数。
⑤重复②、③、④步骤3次。
数据记录如下:
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为_________ mol/L
(3)误差分析:在本实验的滴定过程中,下列操作会使实验结果偏大的是_________ 。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图
(2)滴定前CH3COOH的电离度为
 ×100%)。
×100%)。(3)达到B、D状态时,反应消耗的NaOH溶液的体积a
Ⅱ. 现使用酸碱中和滴定法测定市售白醋中醋酸的浓度
(1)实验步骤:
①量取10.00 mL市售白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀得待测白醋溶液。
②用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
③读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。
④滴定。当
⑤重复②、③、④步骤3次。
数据记录如下:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(2)数据处理:
根据实验数据计算,可得市售白醋中醋酸的浓度为
(3)误差分析:在本实验的滴定过程中,下列操作会使实验结果偏大的是
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前平视读数,滴定后俯视读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
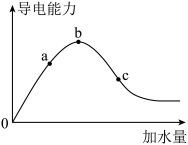
(1)“O”点导电能力为O的理由是_______ ;
(2)a、b、c三点溶液中c(H+)由小到大的顺序为_______ ;
(3)a、b、c三点中醋酸电离程度最大的是_______ ;水的电离程度最大的是_______ 。
(4)若使c点溶液的c(CH3COO-)提高,溶液的c(H+)减小,可采取的措施是_______。
①盐酸 ②冰醋酸 ③固体KOH ④加水 ⑤固体CH3COONa ⑥Zn粒

(1)“O”点导电能力为O的理由是
(2)a、b、c三点溶液中c(H+)由小到大的顺序为
(3)a、b、c三点中醋酸电离程度最大的是
(4)若使c点溶液的c(CH3COO-)提高,溶液的c(H+)减小,可采取的措施是_______。
①盐酸 ②冰醋酸 ③固体KOH ④加水 ⑤固体CH3COONa ⑥Zn粒
| A.①②③④⑤⑥ | B.①②③⑥ | C.①②⑤⑥ | D.③⑤⑥ |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的_______ (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若_______ (填“甲”或“乙”)的解释正确,溶液的pH应_______ (填“增大”减小”或“不变”)。(已知:25 ℃时,NH3·H2O的Ka=1.8×10-5,CH3COOH的Kb=1.8×10-5)
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知25 ℃时0.01 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)你认为上述两种解释中_______ (填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验,向0.010 mol·L-1的醋酸溶液中加入少量下列物质,然后测定溶液的pH_______
(3)若_______ (填“甲”或“乙”)的解释正确,溶液的pH应_______ (填“增大”“减小”或“不变”)。(已知:25 ℃时,0.01 mol·L-1的氨水和醋酸的电离程度相同)
(1)你认为上述两种解释中
(2)为了验证上述哪种解释正确,继续做如下实验,向0.010 mol·L-1的醋酸溶液中加入少量下列物质,然后测定溶液的pH_______
| A.固体NaOH | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知在25℃时,醋酸、氢氰酸和氢硫酸的电离平衡常数如表:
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=___ 。
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是__ 。
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是__ (填化学式)。
②A、B、C三点中,溶液的导电能力最强的是__ (填字母)。
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)__ c(NaCN)(填“>”“<”或“=”)。
(5)25℃时,下列关于NaHS和Na2S的说法正确的是__ (填序号)。
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=__ mol/L。
| CH3COOH | HCN | H2S |
| Ka=1.75×10-5 | Ka=6.2×10-10 | Ka1=1.1×10-7 Ka2=1.3×10-13 |
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是
②A、B、C三点中,溶液的导电能力最强的是
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)
(5)25℃时,下列关于NaHS和Na2S的说法正确的是
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】含氯化合物的应用越来越广泛,请完成下列有关问题:
(1)亚氯酸钠( )是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为_______ ,其水溶液显碱性的原因为_______ ,其水溶液中离子浓度由大到小的顺序为_______ 。
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成 和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式_______ 。
(3) 是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为
是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为 通入
通入 中可得
中可得 ,其氧化剂与还原剂的物质的量之比为
,其氧化剂与还原剂的物质的量之比为_______ 。
(4)一定条件下, 与硫酸酸化的草酸(
与硫酸酸化的草酸( )溶液反应可制备
)溶液反应可制备 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(5) 溶液可以用来检验水溶液中的
溶液可以用来检验水溶液中的 或
或 。若向
。若向 悬浊液中加入
悬浊液中加入 溶液,可把
溶液,可把 转化为
转化为 ,已知
,已知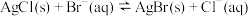 达到平衡时,
达到平衡时, ,已知
,已知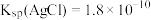 ,则
,则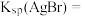
_______ 。(保留两位有效数字,不写单位)
(1)亚氯酸钠(
 )是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成
 和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式(3)
 是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为
是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为 通入
通入 中可得
中可得 ,其氧化剂与还原剂的物质的量之比为
,其氧化剂与还原剂的物质的量之比为(4)一定条件下,
 与硫酸酸化的草酸(
与硫酸酸化的草酸( )溶液反应可制备
)溶液反应可制备 ,该反应的离子方程式为
,该反应的离子方程式为(5)
 溶液可以用来检验水溶液中的
溶液可以用来检验水溶液中的 或
或 。若向
。若向 悬浊液中加入
悬浊液中加入 溶液,可把
溶液,可把 转化为
转化为 ,已知
,已知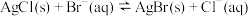 达到平衡时,
达到平衡时, ,已知
,已知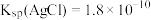 ,则
,则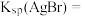
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】与化学平衡类似,电离平衡的平衡常数叫做电离常数(用Ka表示)。下表是常温下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是___________ (填化学式)
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为___________ 。
(3)计算该温度下0.1mol/L的CH3COOH溶液中c(H+)=___________ mol/L
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1___________ V2(填“>”、“<”或“=”)
(5)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈___________ 性;
(6)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3·H2O溶液中,NH 浓度由大到小的顺序是:
浓度由大到小的顺序是:___________ 。
(7)0.1mol/L的Na2CO3溶液中,下列关系式正确的是___________。
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO ClO-+H+ ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3 H++HCO H++HCO HCO   H++CO H++CO | Ka1=4.4×10-7 Ka2=5.6×10-11 |
| H3PO4 | H3PO4 H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO | Ka1=7.1×10-3 Ka2=6.3×10-8 Ka3=4.2×10-13 |
(1)若把CH3COOH、HClO、H2CO3、HCO
 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为
(3)计算该温度下0.1mol/L的CH3COOH溶液中c(H+)=
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1
(5)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈
(6)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3·H2O溶液中,NH
 浓度由大到小的顺序是:
浓度由大到小的顺序是:(7)0.1mol/L的Na2CO3溶液中,下列关系式正确的是___________。
A.c (CO ) + c (HCO ) + c (HCO ) + c (H2CO3) + c (Na+) = 0.3mol/L ) + c (H2CO3) + c (Na+) = 0.3mol/L |
B.2 c (Na+) + c (H+) = c (OH-) + c (CO ) + c (HCO ) + c (HCO ) ) |
C.c (Na+) > c (CO ) > c (HCO ) > c (HCO ) > c (OH-) > c (H+) ) > c (OH-) > c (H+) |
D.c (HCO ) + c (H2CO3) + c (H+) = c (OH-) ) + c (H2CO3) + c (H+) = c (OH-) |
您最近一年使用:0次



