名校
解题方法
1 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数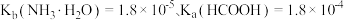 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数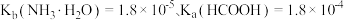 )
)
您最近半年使用:0次
2 .  为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备: 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数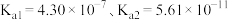 。下列说法正确的是
。下列说法正确的是
 为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备:
 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数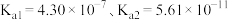 。下列说法正确的是
。下列说法正确的是A. 滴入足量 滴入足量 溶液中反应: 溶液中反应: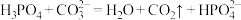 |
B.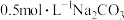 溶液中存在: 溶液中存在: |
C. 溶液中: 溶液中: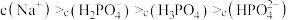 |
D.产生 沉淀的上层清液中, 沉淀的上层清液中, |
您最近半年使用:0次
解题方法
3 . 已知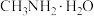 为一元弱碱。常温下,将
为一元弱碱。常温下,将 气体通入
气体通入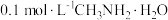 水溶液中,混合溶液的
水溶液中,混合溶液的 与
与 和
和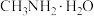 四种微粒浓度对数值(
四种微粒浓度对数值( )的关系如图所示(忽略溶液体积的变化)。下列说法错误的是
)的关系如图所示(忽略溶液体积的变化)。下列说法错误的是
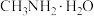 为一元弱碱。常温下,将
为一元弱碱。常温下,将 气体通入
气体通入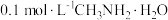 水溶液中,混合溶液的
水溶液中,混合溶液的 与
与 和
和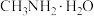 四种微粒浓度对数值(
四种微粒浓度对数值( )的关系如图所示(忽略溶液体积的变化)。下列说法错误的是
)的关系如图所示(忽略溶液体积的变化)。下列说法错误的是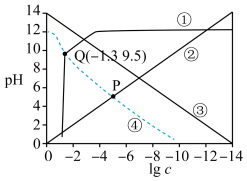
A.①线表示 浓度对数值与溶液 浓度对数值与溶液 的关系 的关系 |
B.常温下, |
C.该体系中, |
D.P点之后,溶液中不可能存在 |
您最近半年使用:0次
名校
解题方法
4 . 捕集与转化CO2的部分过程如下图所示,室温下以0.1 mol·L-1的NaOH溶液吸收CO2,忽略通入CO2引起的溶液体积变化和水的挥发。已知溶液中含碳物种的浓度c总=c(H2CO3)+c( )+c(
)+c( ),H2CO3电离常数分别为Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,下列说法正确的是
),H2CO3电离常数分别为Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,下列说法正确的是
 )+c(
)+c( ),H2CO3电离常数分别为Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,下列说法正确的是
),H2CO3电离常数分别为Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,下列说法正确的是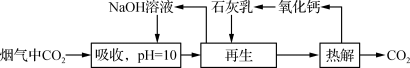
A.吸收液中:c( )<c( )<c( ) ) |
B.吸收液c总=0.1 mol·L-1时,c(H2CO3)+c( )+c(H+)=c(OH-),且Ka2(H2CO3)> )+c(H+)=c(OH-),且Ka2(H2CO3)>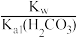 |
C.“再生”过程中发生反应的离子方程式有:Ca(OH)2+ = CaCO3+OH-+H2O = CaCO3+OH-+H2O |
D.将CaCO3投入煮沸后蒸馏水,沉降后溶液pH≈8.3,则c(Ca2+)c( )≠Ksp(CaCO3) )≠Ksp(CaCO3) |
您最近半年使用:0次
名校
5 . 室温下,向0.1 mol/L的柠檬酸的(Na3A)溶液中通入HCl气体(忽略溶液体积变化),溶液中H3A、H2A-、HA2-和A3-的分布系数 (X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
(X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
 (X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
(X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
| A.曲线d表示A3- |
| B.A3-水解平衡常数Kh1=10-7.6 |
C.n点: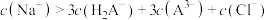 |
| D.pH为5左右时,通入HCl发生的反应为HA2-+H+=H2A- |
您最近半年使用:0次
6 . 已知常温下水溶液中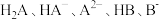 的分布分数
的分布分数 [如
[如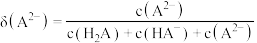 ]随
]随 变化曲线如图1所示;用
变化曲线如图1所示;用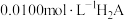 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和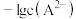 关系如图2所示。下列说法错误的是
关系如图2所示。下列说法错误的是
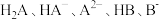 的分布分数
的分布分数 [如
[如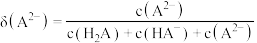 ]随
]随 变化曲线如图1所示;用
变化曲线如图1所示;用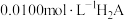 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和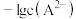 关系如图2所示。下列说法错误的是
关系如图2所示。下列说法错误的是
A.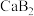 的水解平衡常数的数量级为 的水解平衡常数的数量级为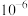 |
B.曲线e为 |
C. |
D.滴定过程中始终存在: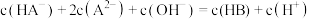 |
您最近半年使用:0次
7 . 室温下,将 溶液滴加到己二酸
溶液滴加到己二酸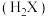 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示。下列叙述错误的是
与离子浓度变化的关系如图所示。下列叙述错误的是
 溶液滴加到己二酸
溶液滴加到己二酸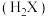 溶液中,混合溶液的
溶液中,混合溶液的 与离子浓度变化的关系如图所示。下列叙述错误的是
与离子浓度变化的关系如图所示。下列叙述错误的是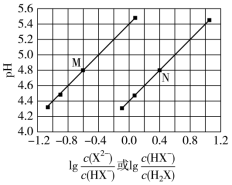
A.当混合溶液呈中性时,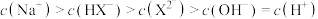 |
B.曲线 表示 表示 与 与 的变化关系 的变化关系 |
C.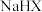 溶液中 溶液中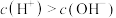 |
D. 的数量级为10-5 的数量级为10-5 |
您最近半年使用:0次
8 . 常温下,用0.2mol/L盐酸滴定25.00mL0.2mol/L某弱碱ROH溶液,所得溶液pH、R+和ROH的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是
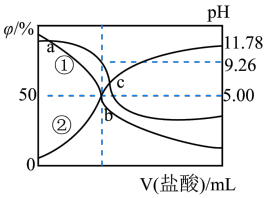

| A.曲线②代表ROH |
| B.若c点加入HCl溶液体积为25mL,则溶液中存在c(H+)>c(OH-)+c(ROH) |
| C.RCl的水解平衡常数为1.0×10-5 |
| D.a、b、c三点的溶液,水的电离程度:a<b<c |
您最近半年使用:0次
9 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、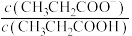 ]的关系如图所示。
]的关系如图所示。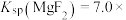
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、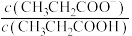 ]的关系如图所示。
]的关系如图所示。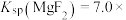
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

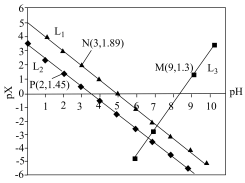
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的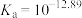 |
C.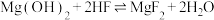 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近半年使用:0次
10 . 回答下列问题。
(1)根据所学知识回答下列问题:
(1)已知:①N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.0kJ·mol-1;
②H2(g)+ O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
③2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
则反应2NH3(g)+Fe2O3(s)=N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ·mol-1.
(2)反应NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1自发进行的条件是___________ (填“高温”或“低温”)。
(3)工业上以含SO2的废气为原料,用电化学的方法制取硫酸的装置图如下:___________ 。
(4)常温下,pH=3的醋酸溶液中,由水电离产生的
___________ mol∙L−1.
(5)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合后溶液呈___________ (填“酸性”“碱性”或“中性”)
(6)KAl(SO4)2‧12H2O可用作净水剂,其原理是___________ (用离子方程式说明)。
(7)已知常温下,Ka(HCN)=6.2×10-10。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性。
(8)某 溶液中含有
溶液中含有 杂质,溶液中
杂质,溶液中 的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于
的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于 时即沉淀完全(注:lg5=0.7),已知
时即沉淀完全(注:lg5=0.7),已知 ,
,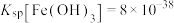 ,若将该溶液的pH调至4.0,
,若将该溶液的pH调至4.0,___________ (填“是”或“否”)可以达到除去 杂质而不损失
杂质而不损失 的目的。
的目的。
(1)根据所学知识回答下列问题:
(1)已知:①N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.0kJ·mol-1;
②H2(g)+
 O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;
O2(g)=H2O(g) ΔH=-240.0kJ·mol-1;③2Fe(s)+
 O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1
O2(g)=Fe2O3(s) ΔH=-1644.0kJ·mol-1则反应2NH3(g)+Fe2O3(s)=N2(g)+3H2O(g)+2Fe(s) ΔH=
(2)反应NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1自发进行的条件是
(3)工业上以含SO2的废气为原料,用电化学的方法制取硫酸的装置图如下:
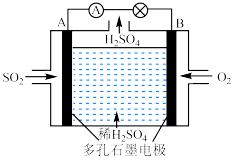
(4)常温下,pH=3的醋酸溶液中,由水电离产生的

(5)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合后溶液呈
(6)KAl(SO4)2‧12H2O可用作净水剂,其原理是
(7)已知常温下,Ka(HCN)=6.2×10-10。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
(8)某
 溶液中含有
溶液中含有 杂质,溶液中
杂质,溶液中 的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于
的浓度为0.020mol∙L−1,通常认为残留在溶液中的离子浓度小于 时即沉淀完全(注:lg5=0.7),已知
时即沉淀完全(注:lg5=0.7),已知 ,
,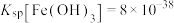 ,若将该溶液的pH调至4.0,
,若将该溶液的pH调至4.0, 杂质而不损失
杂质而不损失 的目的。
的目的。
您最近半年使用:0次



