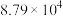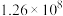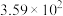解题方法
1 . 乙二醇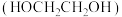 是应用广泛的化工产品,草酸二甲酯
是应用广泛的化工产品,草酸二甲酯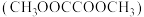 的热催化加氢是生产乙二醇、乙醇酸甲酯
的热催化加氢是生产乙二醇、乙醇酸甲酯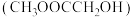 的重要工艺。主要反应如下:
的重要工艺。主要反应如下:
I.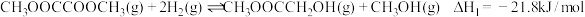
Ⅱ.
Ⅲ.
(1)写出由草酸二甲酯热催化加氢生成乙二醇的热化学方程式:___________ 。
(2)计算表明,反应Ⅲ在研究的温度范围内平衡常数大于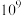 ,可以认为反应Ⅲ几乎不可逆,为了限制反应Ⅲ对乙二醇产率的影响,可采取的最佳措施是___________。
,可以认为反应Ⅲ几乎不可逆,为了限制反应Ⅲ对乙二醇产率的影响,可采取的最佳措施是___________。
(3)在选定催化剂后,科研人员研究了投料比和压强对反应平衡的影响,测得在 、
、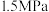 的等温等压条件下,原料草酸二甲酯的转化率(
的等温等压条件下,原料草酸二甲酯的转化率( )及产物的选择性(S)随投料比的变化关系如图(
)及产物的选择性(S)随投料比的变化关系如图(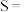 生成某产物的草酸二甲酯的物质的量/参与反应的草酸二甲酯的总物质的量)。
生成某产物的草酸二甲酯的物质的量/参与反应的草酸二甲酯的总物质的量)。___________ 。
②已知投料比为60时,草酸二甲酯的转化率为 ,该条件下不发生反应Ⅲ,则最终收集的流出气中甲醇蒸气的分压为
,该条件下不发生反应Ⅲ,则最终收集的流出气中甲醇蒸气的分压为___________  (计算结果保留二位小数)。
(计算结果保留二位小数)。
(4)在等压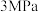 、投料比为50的条件下,科研人员测量了原料草酸二甲酯的转化率(
、投料比为50的条件下,科研人员测量了原料草酸二甲酯的转化率( )及各产物的选择性(S)随温度变化关系,如图。
)及各产物的选择性(S)随温度变化关系,如图。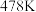 时,乙二醇的选择性降低,原因是
时,乙二醇的选择性降低,原因是___________ 。
②请画出乙醇酸甲酯的产率随温度的变化___________ 。
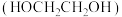 是应用广泛的化工产品,草酸二甲酯
是应用广泛的化工产品,草酸二甲酯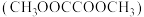 的热催化加氢是生产乙二醇、乙醇酸甲酯
的热催化加氢是生产乙二醇、乙醇酸甲酯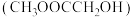 的重要工艺。主要反应如下:
的重要工艺。主要反应如下:I.
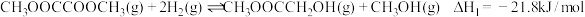
Ⅱ.

Ⅲ.

(1)写出由草酸二甲酯热催化加氢生成乙二醇的热化学方程式:
(2)计算表明,反应Ⅲ在研究的温度范围内平衡常数大于
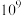 ,可以认为反应Ⅲ几乎不可逆,为了限制反应Ⅲ对乙二醇产率的影响,可采取的最佳措施是___________。
,可以认为反应Ⅲ几乎不可逆,为了限制反应Ⅲ对乙二醇产率的影响,可采取的最佳措施是___________。| A.升高反应体系的温度 |
| B.适当增大反应投料中氢气的比例 |
| C.增大反应体系的压强 |
| D.选择合适的催化剂进行反应 |
(3)在选定催化剂后,科研人员研究了投料比和压强对反应平衡的影响,测得在
 、
、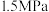 的等温等压条件下,原料草酸二甲酯的转化率(
的等温等压条件下,原料草酸二甲酯的转化率( )及产物的选择性(S)随投料比的变化关系如图(
)及产物的选择性(S)随投料比的变化关系如图( 生成某产物的草酸二甲酯的物质的量/参与反应的草酸二甲酯的总物质的量)。
生成某产物的草酸二甲酯的物质的量/参与反应的草酸二甲酯的总物质的量)。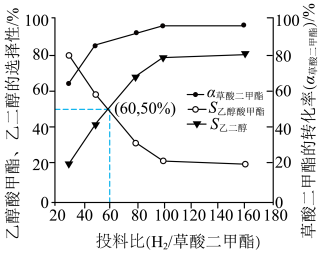
②已知投料比为60时,草酸二甲酯的转化率为
 ,该条件下不发生反应Ⅲ,则最终收集的流出气中甲醇蒸气的分压为
,该条件下不发生反应Ⅲ,则最终收集的流出气中甲醇蒸气的分压为 (计算结果保留二位小数)。
(计算结果保留二位小数)。(4)在等压
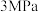 、投料比为50的条件下,科研人员测量了原料草酸二甲酯的转化率(
、投料比为50的条件下,科研人员测量了原料草酸二甲酯的转化率( )及各产物的选择性(S)随温度变化关系,如图。
)及各产物的选择性(S)随温度变化关系,如图。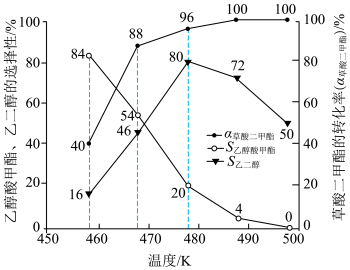
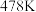 时,乙二醇的选择性降低,原因是
时,乙二醇的选择性降低,原因是②请画出乙醇酸甲酯的产率随温度的变化
您最近半年使用:0次
2 . 异丁烯 是重要的化工生产原料,可由异丁烷
是重要的化工生产原料,可由异丁烷 催化脱氢制备,反应如下:
催化脱氢制备,反应如下: .
.
已知:①主要副反应为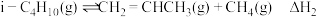

②温度过高会引发烃裂解生成炭(C).
③相关化学键的键能如下所示:
请回答:
(1)
_________  .
.
(2)有利于提高异丁烷平衡转化率的条件有_________ .
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压的密闭容器中充入异丁烷和 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率
作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率 ,空速
,空速 :单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
:单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附) 时异丁烯收率=
时异丁烯收率=_________ .
②下列说法正确的是_________ .
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是_________ .
④其他条件相同,异丁烷的平衡转化率如图3所示.若充入 改为
改为 ,在图3中作出异丁烷的平衡转化率随温度变化的曲线
,在图3中作出异丁烷的平衡转化率随温度变化的曲线______ (忽略积碳的影响).
 是重要的化工生产原料,可由异丁烷
是重要的化工生产原料,可由异丁烷 催化脱氢制备,反应如下:
催化脱氢制备,反应如下: .
.已知:①主要副反应为
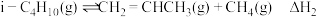

②温度过高会引发烃裂解生成炭(C).
③相关化学键的键能如下所示:
化学键 |
|
|
|
|
键能/ | 615 | 347.7 | 413.4 | 436 |
(1)

 .
.(2)有利于提高异丁烷平衡转化率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)其他条件相同,在恒压的密闭容器中充入异丁烷和
 各
各 (
( 作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率
作惰性气体),经过相同时间测得相关数据如图1和图2所示.[收率 ,空速
,空速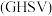 :单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附)
:单位时间通过单位体积催化剂的气体量](不考虑温度对催化剂活性的影响,异丁烷分子在催化剂表面能较快吸附) 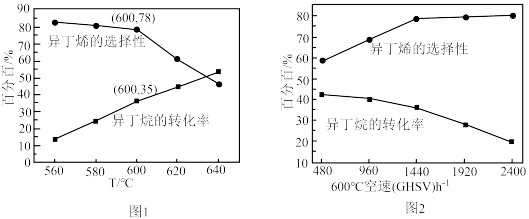
 时异丁烯收率=
时异丁烯收率=②下列说法正确的是
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入
 的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是
④其他条件相同,异丁烷的平衡转化率如图3所示.若充入
 改为
改为 ,在图3中作出异丁烷的平衡转化率随温度变化的曲线
,在图3中作出异丁烷的平衡转化率随温度变化的曲线
您最近半年使用:0次
今日更新
|
171次组卷
|
2卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
3 . 常温下,分别在Mn(NO3)2、Zn(NO3)2、HNO2溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-、 ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: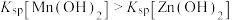 。下列叙述错误的是
。下列叙述错误的是
 ]与pH关系如图所示。已知:
]与pH关系如图所示。已知: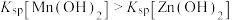 。下列叙述错误的是
。下列叙述错误的是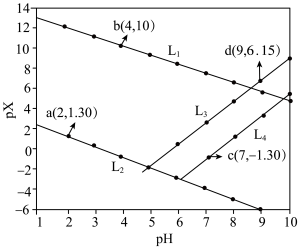
A.图中L2代表 ,L3代表Zn2+ ,L3代表Zn2+ |
B.同时产生两种沉淀时,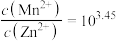 |
C. 的平衡常数 的平衡常数 |
D.室温下,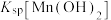 的数量级为 的数量级为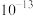 |
您最近半年使用:0次
4 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.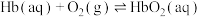

ⅱ.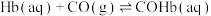

ⅱ.

ⅳ.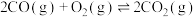

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
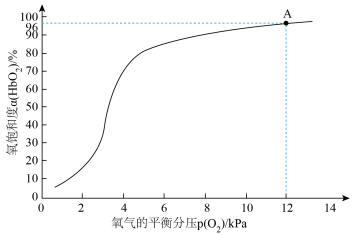
(3)36.5℃时,氧饱和度[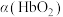 ,
,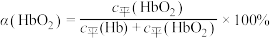 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数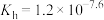 ,
,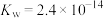 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
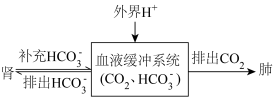
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
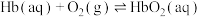

ⅱ.
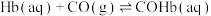

ⅱ.


ⅳ.
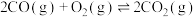

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若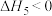 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中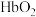 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
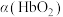 ,
,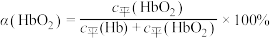 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数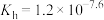 ,
,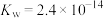 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近半年使用:0次
5 . 乙烯是世界上产量最大的化学产品之一,是合成纤维、合成橡胶基本化工原料。二氧化碳氧化乙烷脱氢制乙烯为生产乙烯提供了新途径。一定温度下, 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.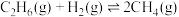
已知部分共价键的键能如下表所示:
回答下列问题:
(1)反应Ⅱ:

________  ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有________ 种。
(2)用惰性气体与 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
________ kpa(用含a、b的代数式表示)。
(3)在一定条件下
 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
(4)反应Ⅱ:
 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。
①为提高反应Ⅱ的平衡转化率,应选择的反应条件为________ 。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: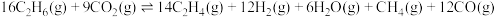 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是________ 。
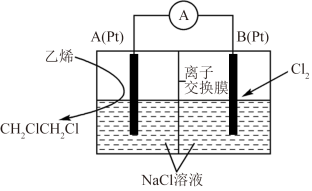
(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为________ ,离子交换膜为________ (填“阴离子”或“阳离子”)交换膜。
 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.
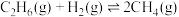
已知部分共价键的键能如下表所示:
共价键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 464 | 799 |
(1)反应Ⅱ:


 ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有(2)用惰性气体与
 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
(3)在一定条件下

 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。| A.正反应速率先增大后减小 | B.混合气体密度增大 |
| C.反应物的体积百分数增大 | D.化学平衡常数K值增大 |
(4)反应Ⅱ:

 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。①为提高反应Ⅱ的平衡转化率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面
 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: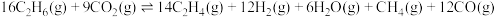 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为
您最近半年使用:0次
6 . 某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究 的分解率,工作原理如下图所示.图a、b和c反应区温度维持恒定且相等,仅发生
的分解率,工作原理如下图所示.图a、b和c反应区温度维持恒定且相等,仅发生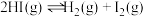 且在反应区内进行。投料均为
且在反应区内进行。投料均为 的
的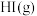 ,反应同时开始,
,反应同时开始, 时图b反应区处于瞬时平衡状态,其化学平衡常数
时图b反应区处于瞬时平衡状态,其化学平衡常数 。
。
下列说法正确的是
 的分解率,工作原理如下图所示.图a、b和c反应区温度维持恒定且相等,仅发生
的分解率,工作原理如下图所示.图a、b和c反应区温度维持恒定且相等,仅发生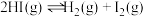 且在反应区内进行。投料均为
且在反应区内进行。投料均为 的
的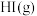 ,反应同时开始,
,反应同时开始, 时图b反应区处于瞬时平衡状态,其化学平衡常数
时图b反应区处于瞬时平衡状态,其化学平衡常数 。
。 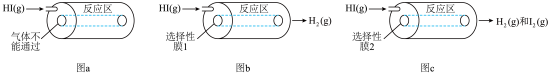
图a装置 | 图b装置 | 图c装置 | |
| 0.10 | 0.30 | x |
A.图a装置的化学平衡常数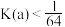 |
| B.图a装置中,HI(g)分解率为10% |
C.图b装置中,前 内 内 的平均渗透速率约为 的平均渗透速率约为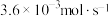 |
| D.图c装置中,x一定大于0.3 |
您最近半年使用:0次
今日更新
|
157次组卷
|
2卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
7 . 利用向制取生物柴油的副产物甘油( )中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得
)中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得 、CO、
、CO、 、
、 等组成气体,通过调整反应的组成和条件可提高
等组成气体,通过调整反应的组成和条件可提高 产率。请回答:
产率。请回答:
(1)制氢的几个主要反应如下
反应1: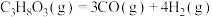
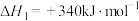
反应2:
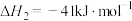
反应3:
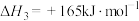
反应4: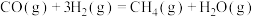

(1)计算
______ ,并判断该反应的自发性______ 。
(2)①温度控制不当,气相产物之间会发生积碳副反应从而影响氢气产率,反应如下:
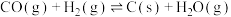
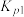 ,
,
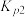 ;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压),
;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压), ,则平衡常数
,则平衡常数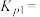
______ 。
②生产过程中,为减小积碳对氢气产率及催化剂的影响,下列措施合适的是______ (填序号)。
A.减小压强 B.通入过量的氧气 C.通入适量的水蒸气 D.选择合适的催化剂
③上述各反应达到平衡时,体系中各物质的物质的量分数受温度的影响如图,请结合图像解释,在图示温度范围内随着温度升高 的摩尔分数先迅速上升后缓慢下降的原因是
的摩尔分数先迅速上升后缓慢下降的原因是______ 。______ (表示在催化剂表面吸附态)(填序号)
A.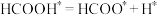
B.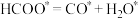
C.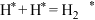
 )中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得
)中通入一定量的水蒸气,可实现重整制氢。经一系列反应可获得 、CO、
、CO、 、
、 等组成气体,通过调整反应的组成和条件可提高
等组成气体,通过调整反应的组成和条件可提高 产率。请回答:
产率。请回答:(1)制氢的几个主要反应如下
反应1:
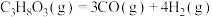
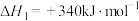
反应2:

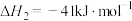
反应3:

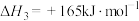
反应4:
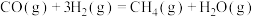

(1)计算

(2)①温度控制不当,气相产物之间会发生积碳副反应从而影响氢气产率,反应如下:
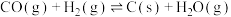
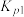 ,
,
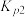 ;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压),
;若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中达到平衡时组分的分压(即组分的物质的量分数×总压), ,则平衡常数
,则平衡常数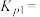
②生产过程中,为减小积碳对氢气产率及催化剂的影响,下列措施合适的是
A.减小压强 B.通入过量的氧气 C.通入适量的水蒸气 D.选择合适的催化剂
③上述各反应达到平衡时,体系中各物质的物质的量分数受温度的影响如图,请结合图像解释,在图示温度范围内随着温度升高
 的摩尔分数先迅速上升后缓慢下降的原因是
的摩尔分数先迅速上升后缓慢下降的原因是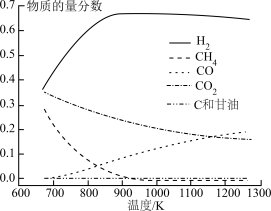
A.
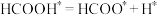
B.
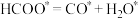
C.
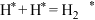
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
8 . 二甲醚是重要的有机合成原料,工业上常用合成气(主要成分为CO、H2)制备二甲醚,其主要反应如下。
反应ⅰ:CO(g)+2H2(g) CH3OH(g);
CH3OH(g);
反应ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);
反应ⅲ:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=_______ (保留三位有效数字)。
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为_______ 。②需控制出气流量小于进气流量的原因为_______ 。
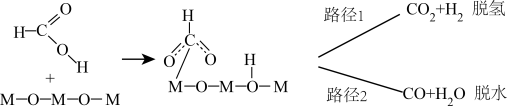
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。______________ 。
②在合成甲醇过程中,需要不断分离出甲醇的原因为_______ 。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g);
CH3OH(g);反应ⅱ:2CH3OH(g)
 CH3OCH3(g)+H2O(g);
CH3OCH3(g)+H2O(g);反应ⅲ:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。(1)一定温度下,在体积为2 L的刚性容器中充入4 mol CO(g)和8 mol H2(g)制备二甲醚,4 min时达到平衡,平衡时CO(g)的转化率为80%,c(H2)=1.4 mol·L-1,且c(CH3OH)=2c(CH3OCH3)。反应ⅲ的平衡常数Kc=
(2)实际工业生产中,需要在260 ℃、压强恒为4.0 MPa的反应釜中进行上述反应。初始时向反应釜中加入0.01 mol CO(g)和0.02 mol H2(g),为确保反应的连续性,需向反应釜中以n(CO)∶n(H2)=1∶2、进气流量0.03 mol·min-1持续通入原料,同时控制出气流量。①已知出气流量为0.02 mol·min-1,单位时间内CO(g)的转化率为60%,则流出气体中CO2(g)的百分含量为
(3)在ZnxO催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
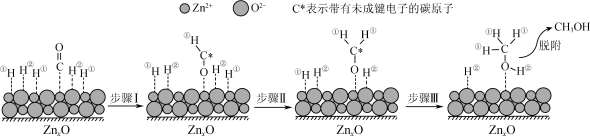
②在合成甲醇过程中,需要不断分离出甲醇的原因为
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
9 . Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应为 ;ΔH>0。
;ΔH>0。
(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应: ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。_______ 、_______ (填化学式)。
(3)M点对应温度下,H2S的转化率是_______ 。
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。_______ (填“A”“B”或“C”)组图像。三组图像中,C组图像中平均反应速率最低的可能原因是_______ 。
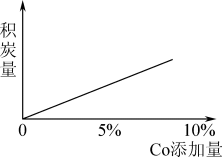
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为____ 。
 ;ΔH>0。
;ΔH>0。(1)在恒温恒容条件下,可作为上述反应达到平衡状态的判断依据的是_______。
| A.混合气体密度不变 |
| B.容器内压强不变 |
| C.2v正(H2S)=v逆(CS2) |
| D.CH4与H2的物质的量分数之比保持不变 |
Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2组成的混合气体发生反应:
 ;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。
;ΔH>0,达到平衡状态时,四种组分物质的量分数随温度的变化如下图所示。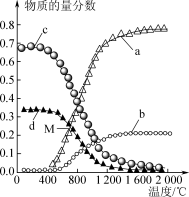
(3)M点对应温度下,H2S的转化率是
Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如下图表示800 ℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。
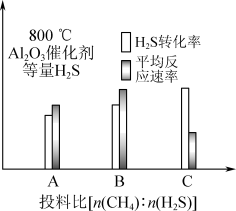
(5)未添加Co助剂时,无积炭,随着Co添加量的变化,积炭量变化如下图所示,Co助剂可能催化原料气发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
10 . 氙的氟化物被广泛用作刻蚀剂、氧化剂和氟化剂,稀有气体Xe和 混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
反应ⅰ: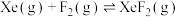

反应ⅱ: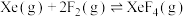

反应ⅲ: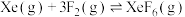

(1)关于上述反应,下列有关说法正确的是______ (填标号)。
A.当体系总压不再改变时,反应达到平衡
B.当Xe与 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于Xe
C.达到平衡后将 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
(2)升高温度,平衡
______ (填“正向移动”“逆向移动”或“不移动”),理由是______ (根据数据计算说明)。
(3)已知: 选择性是指生成
选择性是指生成 所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的
所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的 ,初始压强为
,初始压强为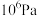 ,测得在相同时间内,上述反应Xe的转化率和
,测得在相同时间内,上述反应Xe的转化率和 的选择性与温度的关系如图1所示,则制取
的选择性与温度的关系如图1所示,则制取 的最适宜温度为
的最适宜温度为______ ;当超过1000℃, 选择性随着温度升高而降低的可能原因是
选择性随着温度升高而降低的可能原因是______ 。 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为 ,Xe和F的最短距离为b nm。
,Xe和F的最短距离为b nm。______ 。
②该晶体的密度为______  。
。
 混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):
混合在催化剂作用下同时存在如下反应(以下实验均在恒容条件下进行):反应ⅰ:
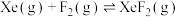

反应ⅱ:
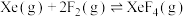

反应ⅲ:
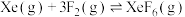

温度/℃ |
|
|
250 |
|
|
400 |
|
|
(1)关于上述反应,下列有关说法正确的是
A.当体系总压不再改变时,反应达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动(2)升高温度,平衡

(3)已知:
 选择性是指生成
选择性是指生成 所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的
所消耗的Xe的物质的量与初始Xe的物质的量的比值。则向刚性密闭容器中加入n mol的Xe和4mol的 ,初始压强为
,初始压强为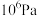 ,测得在相同时间内,上述反应Xe的转化率和
,测得在相同时间内,上述反应Xe的转化率和 的选择性与温度的关系如图1所示,则制取
的选择性与温度的关系如图1所示,则制取 的最适宜温度为
的最适宜温度为 选择性随着温度升高而降低的可能原因是
选择性随着温度升高而降低的可能原因是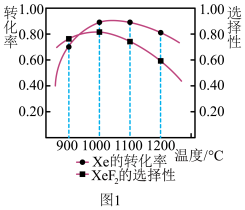
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,图中M点原子坐标参数为 ,Xe和F的最短距离为b nm。
,Xe和F的最短距离为b nm。
②该晶体的密度为
 。
。
您最近半年使用:0次





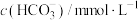

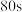 时反应区
时反应区 的物质的量/
的物质的量/