1 . 下列对实验设计的评价错误的是
| 选项 | 实验设计 | 实验评价 |
| A. | 将含有二氧化硫的气体通入酸性高锰酸钾中,然后加入足量氯化钡溶液。通过测定白色沉淀的质量,可推算二氧化硫的物质的量 | 不合理,酸性高锰酸钾中的稀硫酸会与氯化钡产生沉淀 |
| B. | 实验室用浓硫酸和乙醇制取乙烯时,若要检验所得气体含有CH2=CH2,可将混合气体干燥后,通入溴的四氯化碳溶液中。若溶液褪色,则证明有乙烯 | 合理,混合气体中,只有乙烯可使溴的四氯化碳溶液褪色 |
| C. | 常温下,用pH计分别测定等体积 CH3COONH4溶液和 CH3COONH4溶液和 CH3COONH4溶液的pH.通过比较pH值,探究浓度对水的电离程度的影响 CH3COONH4溶液的pH.通过比较pH值,探究浓度对水的电离程度的影响 | 合理 |
| D. | 探究浓度对反应速率的影响,向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液。通过观察现象,探究浓度对反应速率的影响 | 不合理,该实验无明显现象 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7日内更新
|
226次组卷
|
2卷引用:2024年辽宁省抚顺市普通高中高三下学期模拟考试化学试卷
2 . 下列方案设计、现象和结论都正确的是
| 实验 | 目的 | 方案设计 | 现象和结论 |
| ① | 探究压强对 与 与 平衡的影响 平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒 平衡混合气体的针筒 | 如果气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| ② | 探究 与 与 氧化性的强弱 氧化性的强弱 | 向 和 和 的混合溶液中滴入 的混合溶液中滴入 酸化的 酸化的 溶液 溶液 | 溶液变红,说明氧化性: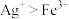 |
| ③ | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 取2  溶液于试管中,加2滴酚酞,再加入少量 溶液于试管中,加2滴酚酞,再加入少量 固体 固体 | 如果溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| ④ | 相同温度下,比较 与 与 的酸性强弱 的酸性强弱 | 向等体积的水中分别通入 、 、 至饱和,再用 至饱和,再用 计测定两种溶液的 计测定两种溶液的 | 如果通 后所得溶液的 后所得溶液的 小,则 小,则 的酸性比弱 的酸性比弱 |
| A.① | B.② | C.③ | D.④ |
您最近半年使用:0次
3 . 安息香酸(HR)是最简单的一元芳香酸,其钠盐(用NaR表示)的水溶液呈碱性。已知常温下,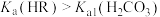 。下列说法正确的是
。下列说法正确的是
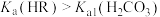 。下列说法正确的是
。下列说法正确的是A.常温下, HR水溶液的 HR水溶液的 |
| B.向NaR水溶液中加水稀释,溶液的pH升高 |
C.NaR水溶液中,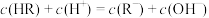 |
D.常温下,NaR溶液的碱性比同浓度的 溶液弱 溶液弱 |
您最近半年使用:0次
2024高三下·全国·专题练习
4 . 某工厂采用辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下: 分解为
分解为 ,
, 转变为
转变为 ;
;
②金属活动性: ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
“酸浸”中过量浓盐酸的作用为:①充分浸出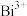 和
和 ;②
;②_______ 。
 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下: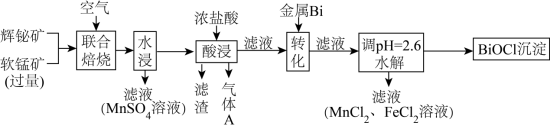
 分解为
分解为 ,
, 转变为
转变为 ;
;②金属活动性:
 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
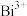 和
和 ;②
;②
您最近半年使用:0次
解题方法
5 . 为探究 与
与 溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
 与
与 溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是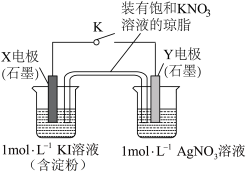
| A.Y电极为阴极 | B.右侧烧杯中 经盐桥移向左侧烧杯 经盐桥移向左侧烧杯 |
C.闭合K后右侧烧杯中溶液 不断升高 不断升高 | D.若将X电极换成 ,实验现象不变 ,实验现象不变 |
您最近半年使用:0次
6 . 一种利用配合物消除氮氧化物污染的反应为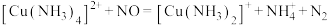
 。设
。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
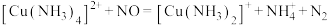
 。设
。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.键角: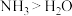 |
B.1mol 中含有 中含有 键的数目为 键的数目为 |
C.同温下 的数目:1L0.5mol/L 的数目:1L0.5mol/L 溶液>2L0.25mol/L 溶液>2L0.25mol/L 溶液 溶液 |
D.标准状况下,每生成22.4L ,该反应转移电子数为 ,该反应转移电子数为 |
您最近半年使用:0次
名校
7 . 下列方案设计、现象和结论都正确的是
| 编号 | 实验目的 | 方案设计 | 现象与结论 |
| A | 比较 与 与 的酸性强弱 的酸性强弱 | 分别测 、 、 两饱和溶液的 两饱和溶液的 |  溶液 溶液 小,则酸性 小,则酸性 |
| B | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 往含有酚酞 溶液中加入少量 溶液中加入少量 晶体 晶体 | 溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 比较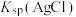 与 与 的大小 的大小 | 向足量 溶液中先加入少量 溶液中先加入少量 溶液,再加入 溶液,再加入 溶液 溶液 | 先生成白色沉淀,再生成淡黄色沉淀,则 |
| D | 探究压强对化学平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒活塞 平衡混合气体的针筒活塞 | 平衡后气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 常温下,CH3COONa溶液和NaHCO3溶液的浓度与pH的关系如图所示。已知a为CH3COONa溶液和NaHCO3溶液的交点。下列说法错误的是
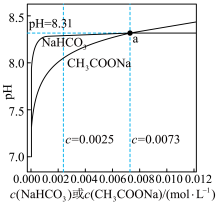

| A.c(NaHCO3)>0.0025mol·L-1时,其溶液的pH基本不变 |
| B.浓度越大CH3COONa溶液的碱性越强,是因为CH3COONa的水解程度随浓度的增大而增大 |
| C.a点CH3COONa溶液中的c(CH3COOH)小于NaHCO3溶液中的c(H2CO3) |
D.0.01mol·L-1的NaHCO3溶液中,满足c(Na+)>c( )>c(H2CO3)>c( )>c(H2CO3)>c( ) ) |
您最近半年使用:0次
名校
9 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
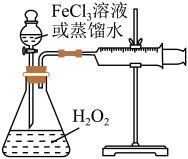
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近半年使用:0次
10 . 实验室制备 并对其进行性质探究
并对其进行性质探究
I.制备 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
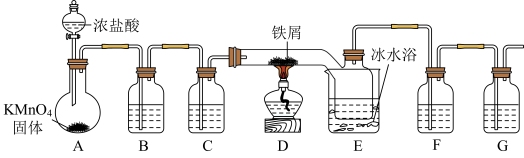
(1)A为氯气发生装置,A中的反应方程式是_______ (锰被还原为 )。
)。
(2)B中试剂的用途是_______ ;C中试剂是_______ ;F中的试剂是_______ 。
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是_______ 。
(4)结合化学方程式,解释a中的实验现象_______ 。
(5)对b的现象进行探究。推测灼烧时,导出的气体是_______ 。
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是_______ 。
 并对其进行性质探究
并对其进行性质探究I.制备
 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
(1)A为氯气发生装置,A中的反应方程式是
 )。
)。(2)B中试剂的用途是
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L
 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是| 实验ⅲ | 操作 | 序号 | 现象 |
 | a | 蒸发时,试管内有白雾 | |
| b | 灼烧时,导出的气体可以使NaBr溶液变黄 | ||
| c | 最终,试管底部留有黑色固体 |
(4)结合化学方程式,解释a中的实验现象
(5)对b的现象进行探究。推测灼烧时,导出的气体是
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是
您最近半年使用:0次



