名校
1 . 下列说法错误的是
A.制备 沉淀,洗涤沉淀时选择稀硫酸比选择水更好 沉淀,洗涤沉淀时选择稀硫酸比选择水更好 |
B.向 的醋酸溶液中加水稀释至原体积的100倍,稀释后溶液的 的醋酸溶液中加水稀释至原体积的100倍,稀释后溶液的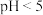 |
C.除去 溶液中的 溶液中的 ,可加入过量 ,可加入过量 ,过滤后再向滤液中加适量盐酸 ,过滤后再向滤液中加适量盐酸 |
D.向2mL0.1mol/L 溶液中滴加3滴0.1mol/LKI溶液,再滴加0.1mol/L 溶液中滴加3滴0.1mol/LKI溶液,再滴加0.1mol/L 溶液,产生黑色沉淀的离子方程式: 溶液,产生黑色沉淀的离子方程式: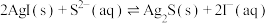 |
您最近半年使用:0次
名校
解题方法
2 . 物质的量的浓度相等的以下溶液① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ ,其中
,其中 的浓度由大到小的顺序为
的浓度由大到小的顺序为
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④
溶液、④ ,其中
,其中 的浓度由大到小的顺序为
的浓度由大到小的顺序为| A.①③②④ | B.①③④② | C.③①②④ | D.③①④② |
您最近半年使用:0次
2023-11-22更新
|
506次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2023一一2024学年高二上学期期中考试化学试卷
黑龙江省哈尔滨市第九中学校2023一一2024学年高二上学期期中考试化学试卷(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)甘肃省天水市第一中学2023-2024学年高二下学期开学化学试题
3 . 25℃时,下列有关电解质溶液的说法正确的是
A.加水稀释0.1mol·L-1氨水,溶液中 减小 减小 |
B.向CH3COONa溶液中加入少量水稀释,溶液中 的值增大 的值增大 |
C.将等物质的量浓度的Na2S和NaHS溶液等体积混合后: < < |
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中, 始终增大 始终增大 |
您最近半年使用:0次
2023-11-20更新
|
628次组卷
|
6卷引用:江西省南昌市第二中学2023-2024学年高二上学期期中考试化学试题
江西省南昌市第二中学2023-2024学年高二上学期期中考试化学试题重庆市育才中学校2023-2024学年高三上学期三校联考模拟考化学试题(清北班)(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省泸州市泸县第五中学2023-2024学年高二上学期12月月考化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
名校
4 . 醋酸钠(CH3COONa)是一种常用的防腐剂和缓冲剂。
(1)某小组探究外界因素对CH3COONa水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为0.10 mol·L-1);
i.实验________ 和________ (填序号),探究加水稀释对CH3COONa水解程度的影响;
ii.实验1和3,探究加入 对CH3COONa水解程度的影响;
对CH3COONa水解程度的影响;
iii.实验1和4,探究温度对CH3COONa水解程度的影响。
①加水稀释CH3COONa溶液的过程中,下列表达式的数值变小的是________ 。
A.c(OH-) B.c(H+)·c(OH-) C. D.
D.
②根据甲同学的实验方案,补充数据:a=________ 。
③实验测得A1>A3,该结果不足以证明加入 促进了CH3COONa的水解。根据
促进了CH3COONa的水解。根据________ (填一种微粒的化学式)的浓度增大可以说明加入 能促进CH3COONa的水解。
能促进CH3COONa的水解。
④已知CH3COONa水解为吸热反应,甲同学预测A1<A4,但实验结果为A1>A4。实验结果与预测不一致的原因是________ 。
(2)小组通过测定不同温度下CH3COONa的水解常数Kh确定温度对CH3COONa水解程度的影响。
查阅资料:Kh= ,c0为CH3COONa溶液起始浓度。
,c0为CH3COONa溶液起始浓度。
试剂: CH3COONa溶液、0.1000 mol·L-1盐酸、pH计。
实验:测定40℃下CH3COONa水解常数Kh,完成下表中序号7的实验。
在 opiqer :fId: opiqer 50℃和60℃下重复上述实验。
数据处理:40℃下,Kh=___________ (用含V、b、c的计算式表示)
实验结论:Kh(60℃)>Kh(50℃)>Kh(40℃),温度升高,促进CH3COONa水解。
(1)某小组探究外界因素对CH3COONa水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为0.10 mol·L-1);
i.实验
ii.实验1和3,探究加入
 对CH3COONa水解程度的影响;
对CH3COONa水解程度的影响;iii.实验1和4,探究温度对CH3COONa水解程度的影响。
| 序号 | 温度 | V(CH3COONa)/mL | V(CH3COONH4)/mL | V(H2O)/mL | pH |
| 1 | 25℃ | 40.0 | 0 | 0 | A1 |
| 2 | 25℃ | 4.0 | 0 | 36.0 | A2 |
| 3 | 25℃ | 20.0 | 10.0 | a | A3 |
| 4 | 40℃ | 40.0 | 0 | 0 | A4 |
A.c(OH-) B.c(H+)·c(OH-) C.
 D.
D.
②根据甲同学的实验方案,补充数据:a=
③实验测得A1>A3,该结果不足以证明加入
 促进了CH3COONa的水解。根据
促进了CH3COONa的水解。根据 能促进CH3COONa的水解。
能促进CH3COONa的水解。④已知CH3COONa水解为吸热反应,甲同学预测A1<A4,但实验结果为A1>A4。实验结果与预测不一致的原因是
(2)小组通过测定不同温度下CH3COONa的水解常数Kh确定温度对CH3COONa水解程度的影响。
查阅资料:Kh=
 ,c0为CH3COONa溶液起始浓度。
,c0为CH3COONa溶液起始浓度。试剂: CH3COONa溶液、0.1000 mol·L-1盐酸、pH计。
实验:测定40℃下CH3COONa水解常数Kh,完成下表中序号7的实验。
| 序号 | 实验 | 记录的数据 |
| 5 | 取20.00mL CH3COONa溶液,用0.1000 mol·L-1盐酸滴定至终点,测CH3COONa溶液的浓度 | 消耗盐酸体积为V mL |
| 6 | 测40℃纯水的pH | b |
| 7 | | c |
数据处理:40℃下,Kh=
实验结论:Kh(60℃)>Kh(50℃)>Kh(40℃),温度升高,促进CH3COONa水解。
您最近半年使用:0次
名校
解题方法
5 . 下列实验操作及现象、对应结论均正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向AgCl固体滴加饱和Na2CrO4溶液,有砖红色沉淀生成 | Ksp(Ag2CrO4)<Ksp(AgCl) |
| B | 向含酚酞的Na2CO3溶液中加入BaCl2固体,溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 用pH试纸分别测定同等条件下NaClO溶液和CH3COONa 溶液的pH,前者pH值较大 | Ka(CH3COOH)> Ka(HClO) |
| D | 向一定浓度的Na2S2O3溶液中滴入稀盐酸,溶液变浑浊 | 盐酸将Na2S2O3还原为S单质 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-12更新
|
472次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 室温下,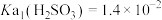 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。
实验1:用pH试纸测量0.1
 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。
实验2:向0.1
 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。
实验3:向 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
下列所得结论正确的是
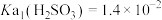 ,
, ,通过下列实验探究
,通过下列实验探究 、
、 溶液的性质。
溶液的性质。实验1:用pH试纸测量0.1

 溶液的pH,测得pH约为5。
溶液的pH,测得pH约为5。实验2:向0.1

 溶液中通入少量
溶液中通入少量 ,测得溶液pH约为8。
,测得溶液pH约为8。实验3:向
 溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
溶液中滴几滴酚酞,加水稀释,溶液红色变浅。实验4:向
 溶液中滴加少量
溶液中滴加少量 溶液,产生白色沉淀。
溶液,产生白色沉淀。下列所得结论正确的是
A.实验1可知0.1  溶液中存在: 溶液中存在: |
B.实验2得到的溶液中存在: |
C.实验3中随着水不断加入,溶液中 的值逐渐变小 的值逐渐变小 |
D.实验4中发生反应的离子方程式为 |
您最近半年使用:0次
2023-11-10更新
|
432次组卷
|
3卷引用:江苏省无锡市2023-2024学年高三上学期期中教学质量调研测试化学试卷题
名校
7 . 下列物质① 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液
(1)属于非电解质的是:___________ ;属于强电解质的是:___________ ;属于弱电解质的是:___________ ;既不是电解质也不是非电解质,常温下能导电的物质是___________ (均填序号)。
(2)写出①的电离方程式___________ 。
(3)向⑦的溶液中滴加几滴浓盐酸,平衡___________ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
___________ (填“增大”、“减小”或者“不变”),
___________ (填“增大”、“减小”或者“不变”)。
(4)将 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是___________ (结合有关离子方程式说明)。
(5)将标准状况下2.24L⑥缓慢通入 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系___________ 。
(6)将足量⑥缓慢通入 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度___________ 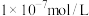 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH___________ (填“增大”、“减小”、或“不变”)。
 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液(1)属于非电解质的是:
(2)写出①的电离方程式
(3)向⑦的溶液中滴加几滴浓盐酸,平衡


(4)将
 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是(5)将标准状况下2.24L⑥缓慢通入
 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系(6)将足量⑥缓慢通入
 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度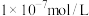 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近半年使用:0次
名校
8 .  溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是
① ②
② ③pH ④
③pH ④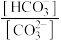
 溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是①
 ②
② ③pH ④
③pH ④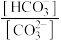
| A.①③ | B.①④ | C.②③ | D.②④ |
您最近半年使用:0次
2023-11-06更新
|
492次组卷
|
6卷引用:上海市上海中学2022-2023学年高二上学期期中考试化学试题
上海市上海中学2022-2023学年高二上学期期中考试化学试题课时2影响盐类水解的主要因素课堂例题(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河北省高碑店市崇德实验中学2023-2024学年高二上学期期中考试化学试题 上海市新中高级中学2023-2024学年高二下学期阶段检测化学试题 陕西省兴平市南郊高级中学2023-2024学年高二上学期第三次化学质量检测题
名校
9 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① | 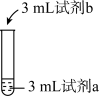 | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近半年使用:0次
2023-11-02更新
|
370次组卷
|
6卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
名校
10 . 关注“实验室化学”并进行实践能有效提高学生的化学实验素养,用如图所示装置(部分夹持装置已略去)进行实验,能达到实验目的的是


| A.甲装置可检验溶液中是否有K+ |
| B.乙装置能保证较长时间观察到白色沉淀 |
| C.丙装置可制备无水 MgCl2 |
| D.丁装置可探究碳酸氢钠的热稳定性 |
您最近半年使用:0次



