名校
1 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
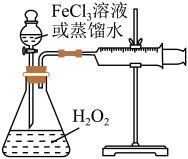
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近半年使用:0次
名校
解题方法
2 . 下列操作能达到相应实验目的的是
| 实验操作 | 实验目的 | |
| A | 向等体积、等pH的两种酸溶液HA和HB中分别加入足量锌粉,充分反应后,HA溶液产生更多的氢气 | 说明Ka(HA)>Ka(HB) |
| B | 向5mL0.1mol/LCuSO4溶液中先加入2mL0.4mol/LNaOH溶液,再加入1mL0.1mol/LNa2S溶液 | 探究常温下Ksp[Cu(OH)2]>Ksp(CuS) |
| C | 向滴有酚酞的碳酸钠溶液中加入适量BaCl2固体,溶液颜色变浅 | 说明碳酸钠溶液中存在水解平衡 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-27更新
|
376次组卷
|
2卷引用:河南省沁阳一中2023—2024学年高二下学期开学考试 化学试卷
名校
3 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① | 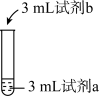 | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近半年使用:0次
2023-11-02更新
|
370次组卷
|
6卷引用:河南省濮阳市油田第一中学2023-2024学年高三上学期培优测试理科综合化学试题
名校
解题方法
4 . 下列说法不正确的是
| A.在一定条件下,Na2S溶液加入CuSO4固体,HS-浓度减小 |
| B.加水稀释,水解常数Kh增大,pH减小 |
| C.25℃时,Ka(HCOOH)=1.0×10-4,该温度下HCOO-的水解常数为1.0×10-10 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大 |
您最近半年使用:0次
2023-08-14更新
|
684次组卷
|
4卷引用:河南省宜阳县第一高级中学2023-2024学年高二上学期能力达标测试化学试题
5 . Mn3O4可用作电子计算机中存储信息的磁芯、磁盘等。常温下,以软锰矿(主要成分是MnO2,还含有少量的Fe2O3、Al2O3)为原料制备Mn3O4 的工艺流程如图所示。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸”后的浸取液中,锰、铁以Mn2+、Fe2+的形式存在, MnO2参加反应的离子方程式为______ 。
(2)①“调pH”的范围为_______ 。该过程中,加入H2O2发生反应的离子方程式为______ ;X试剂最适宜的是_______ (填字母)。
a.氨水 b. CaO固体
c. MnCO3 d. MnO2
②若用Mn+表示浸取液中的金属离子,结合化学用语用平衡移动原理解释形成滤渣1的原因:_____ 。
(3)“沉锰”时,为了加快沉锰的反应速率,可升高反应温度,当温度达到50° C后,随着温度升高,Mn2+的沉淀率会降低,其可能原因是_______ 。
(4)“沉锰”后的滤液2中存在的主要阳离子是_______ 。(填离子符号)。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 2.1 | 7.0 | 3.5 | 8.2 |
| 完全沉淀的pH | 3.4 | 8.3 | 4.6 | 10.2 |
(1)“酸浸”后的浸取液中,锰、铁以Mn2+、Fe2+的形式存在, MnO2参加反应的离子方程式为
(2)①“调pH”的范围为
a.氨水 b. CaO固体
c. MnCO3 d. MnO2
②若用Mn+表示浸取液中的金属离子,结合化学用语用平衡移动原理解释形成滤渣1的原因:
(3)“沉锰”时,为了加快沉锰的反应速率,可升高反应温度,当温度达到50° C后,随着温度升高,Mn2+的沉淀率会降低,其可能原因是
(4)“沉锰”后的滤液2中存在的主要阳离子是
您最近半年使用:0次
6 . 两种溶液混合后的成分与溶液酸碱性的变化可能有关,下列说法正确的是
A. 的 的 溶液与 溶液与 的NaOH溶液等体积混合后所得溶液中: 的NaOH溶液等体积混合后所得溶液中: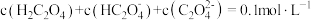 |
B.等体积、等物质的量浓度的 溶液和 溶液和 溶液混合: 溶液混合: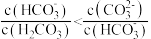 |
C.常温下, 的HA溶液与 的HA溶液与 的BOH溶液等体积混合,所得溶液pH>7,则 的BOH溶液等体积混合,所得溶液pH>7,则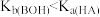 |
D.向某 溶液中加入少量 溶液中加入少量 晶体,所得溶液中 晶体,所得溶液中 水解程度增大,pH增大 水解程度增大,pH增大 |
您最近半年使用:0次
2022-11-24更新
|
549次组卷
|
6卷引用:河南省陕州中学2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
7 . 下列溶液中有关微粒的物质的量浓度和数目关系正确的是
A.常温下,将醋酸钠和盐酸两溶液混合至中性,混合后的溶液中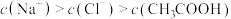 |
B.等浓度的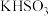 溶液与KOH溶液等体积混合: 溶液与KOH溶液等体积混合: |
C.pH相等的① 、② 、② 、③ 、③ 三种溶液, 三种溶液, 大小是②>①>③ 大小是②>①>③ |
D. 为二元弱酸,则等浓度等体积的 为二元弱酸,则等浓度等体积的 与NaHA溶液中阴离子数目前者大于后者 与NaHA溶液中阴离子数目前者大于后者 |
您最近半年使用:0次
2022-11-16更新
|
313次组卷
|
3卷引用:河南省南阳市第一中学校2022-2023学年高二上学期12月月考化学试题
名校
8 . 无水 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
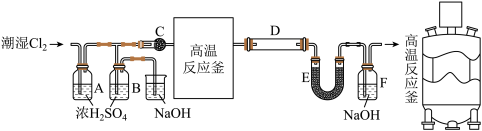
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70% 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
回答下列问题:
(1)C装置的名称为_______ ;
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
(3)高温反应釜中发生反应的化学方程式为_______ ;
(4)E装置的作用为_______ ;
(5)为研究 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:

已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是_______ ,D是_______ ;
②由C得到D的化学方程式为_______ 。
 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70%
 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。回答下列问题:
(1)C装置的名称为
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
A. | B.CaO | C. | D.NaOH |
(4)E装置的作用为
(5)为研究
 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是
②由C得到D的化学方程式为
您最近半年使用:0次
2022-11-03更新
|
421次组卷
|
3卷引用:河南省新乡市第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
9 . 氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
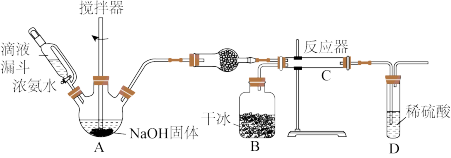
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近半年使用:0次
2022-10-09更新
|
271次组卷
|
3卷引用:河南省南阳市桐柏县实验高中2024届高三上学期阶段检测化学试题(12月)
名校
10 . 为了探究外界条件对氯化铵水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法不正确 的是
| 实验 | c(NH4Cl)/mol·L−1 | V(NH4Cl)/mL | 温度/℃ | pH |
| 1 | 0.02 | 5 | 25 | x |
| 2 | 0.02 | 5 | 30 | y |
| 3 | 0.2 | 5 | 25 | z |
| A.由 x>y可知:升高温度能促进氯化铵的水解 |
| B.由x >z可知:增大盐的浓度,水解平衡正向移动,水解程度增大 |
| C.由z < x < z +1可知:稀释氯化铵溶液,水解平衡正向移动 |
D.Kh(NH4Cl)与Kb(NH3·H2O)的关系为:Kh=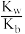 (Kw为水的离子积常数) (Kw为水的离子积常数) |
您最近半年使用:0次
2022-03-23更新
|
429次组卷
|
7卷引用:河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题



