名校
解题方法
1 . 回答下列问题。
(1)向滴有酚酞的氨水中加入少量的氯化铵固体,观察到的现象是___________ ,用平衡原理解释原因___________ 。
(2)常温下,0.1 mol/L 的NaOH溶液的pH=___________ ,0.05mol/L的硫酸的pH=___________ ,取一定体积的两溶液混合,所得混合液的pH=2,则所取硫酸溶液的体积与NaOH溶液的体积比为___________ 。
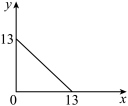
(3)某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示,此温度时,水的离子积常数Kw为___________ ,则该温度t___________ 25℃(填“>”“<”或“=”)。
(4)25℃时,pH=3的酸酸溶液和pH=11的NaOH溶液中由水电离出的c(H+)之比为___________ 。
(1)向滴有酚酞的氨水中加入少量的氯化铵固体,观察到的现象是
(2)常温下,0.1 mol/L 的NaOH溶液的pH=
(3)某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-ymol/L,x与y的关系如图所示,此温度时,水的离子积常数Kw为

(4)25℃时,pH=3的酸酸溶液和pH=11的NaOH溶液中由水电离出的c(H+)之比为
您最近半年使用:0次
名校
2 . 下列实验操作不能达到实验目的的是
| 实验操作 | 实验目的 | |
| A | 常温下,测定等物质的量浓度的盐酸和醋酸溶液的 | 证明相同条件下,在水溶液中 电离程度大于 电离程度大于 |
| B | 用 试纸测定 试纸测定 溶液的 溶液的 | 比较 电离程度和水解程度的大小 电离程度和水解程度的大小 |
| C | 向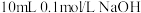 溶液中加入 溶液中加入 溶液,再向混合液中滴加 溶液,再向混合液中滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |  比 比 更难溶 更难溶 |
| D | 向含酚酞的 溶液中加入 溶液中加入 溶液 溶液 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① | 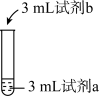 | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近半年使用:0次
2023-11-02更新
|
370次组卷
|
6卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
名校
4 .  溶液中存在水解平衡:
溶液中存在水解平衡: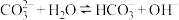 。下列说法错误的是
。下列说法错误的是
 溶液中存在水解平衡:
溶液中存在水解平衡: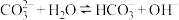 。下列说法错误的是
。下列说法错误的是A.通入 ,溶液pH减小 ,溶液pH减小 | B.升高温度,平衡常数增大 |
| C.加水稀释,溶液中所有离子的浓度都减小 | D.加入 固体, 固体,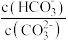 减小 减小 |
您最近半年使用:0次
2023-10-28更新
|
628次组卷
|
4卷引用:北京市第三中学2023-2024学年高二上学期期中练习化学试题
名校
解题方法
5 . 测定0.1
 溶液先升温再降温过程中的pH,数据如下表:
溶液先升温再降温过程中的pH,数据如下表:
实验过程中,取①、④时刻的溶液,加入盐酸酸化的 溶液做对比实验,④产生白色沉
溶液做对比实验,④产生白色沉
淀多。下列说法不正确 的是

 溶液先升温再降温过程中的pH,数据如下表:
溶液先升温再降温过程中的pH,数据如下表:时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
 溶液做对比实验,④产生白色沉
溶液做对比实验,④产生白色沉淀多。下列说法
A. 溶液中共有7种微粒 溶液中共有7种微粒 |
B.④产生的白色沉淀是 |
C.①与④的 值相等 值相等 |
D.①→③的过程中,温度对水解平衡的影响比 的影响更大 的影响更大 |
您最近半年使用:0次
名校
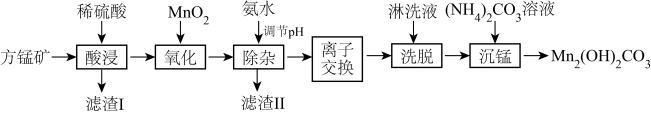
6 . 碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为 MnO,还含有少量的 Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
25℃时,相关物质的 Ksp如下表:
回答下列问题:
(1)“酸浸”时,滤渣I的成分是___________ (填化学式)。
(2)“氧化”时,该反应的离子方程式为___________ 。
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥______ ;若 A13+沉淀完全时,则溶液中 Fe3+的物质的量浓度为___________ mol·L-1(通常认为溶液中的离子浓度≤1×10-5mol·L-1沉淀完全)
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR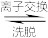 MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为___________ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水”)。
(5)“沉锰”时,反应的离子方程式为___________ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是___________ 。
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
①滴定终点的现象是___________ 。
②该产品中锰的质量分数为___________ 。(用含 a、V 的式子表示)。

25℃时,相关物质的 Ksp如下表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR
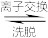 MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)“沉锰”时,反应的离子方程式为
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO
 ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。①滴定终点的现象是
②该产品中锰的质量分数为
您最近半年使用:0次
2022-06-01更新
|
603次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年高三上学期统练(VII)化学试题
名校
解题方法
7 . 下列说法正确的是
| A.一般情况下,盐类越稀越易水解,所以稀释盐溶液,Kh(水解平衡常数)变大 |
| B.一般情况下,一元弱碱的Kb值越大碱性越弱 |
| C.Kw随着溶液中c(H+)和c(OH-)的改变而改变 |
| D.一般情况下,Ksp越大,难溶电解质在水中的溶解程度就越高 |
您最近半年使用:0次
2022-02-19更新
|
130次组卷
|
2卷引用:北京市怀柔区2021-2022学年高二上学期期末考试化学试题
名校
8 . 探究铝片与 溶液的反应。
溶液的反应。
下列说法不正确的是
 溶液的反应。
溶液的反应。| 实验 | 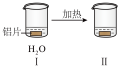 |  |
| 现象 | 无明显现象 | Ⅲ中铝片表面产生细小气泡 Ⅳ中出现白色浑浊,产生大量气泡(经检验为  和 和 ) ) |
A. 溶液中存在水解平衡: 溶液中存在水解平衡: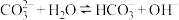 |
B.若将打磨过的铝片加入Ⅰ中,加热后会出现气泡。再对比上图Ⅰ、Ⅲ,说明 溶液能破坏铝表面的保护膜 溶液能破坏铝表面的保护膜 |
C.推测出现白色浑浊的原因可能为: |
D.加热和 逸出对 逸出对 水解平衡移动方向的影响是相反的 水解平衡移动方向的影响是相反的 |
您最近半年使用:0次
2021-06-29更新
|
203次组卷
|
3卷引用: 北京市回民学校2023-2024学年高三上学期统练二化学试题
北京市回民学校2023-2024学年高三上学期统练二化学试题浙江省湖州市2020-2021学年高二下学期期末调研测试卷化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
名校
9 . 下列关于FeCl3水解的说法错误的是
| A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动 |
| B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者 |
| C.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸 |
| D.其他条件相同时,同浓度的FeCl3溶液在50℃和20 ℃时发生水解,50℃时Fe3+的水解程度比20℃时的小 |
您最近半年使用:0次
2021-03-10更新
|
1006次组卷
|
17卷引用:2020年北京高二下学期 复习模拟试题二(选修4人教版)
2020年北京高二下学期 复习模拟试题二(选修4人教版)(已下线)2010年山东省济南外国语学校高三上学期第二次质量检测化学卷(已下线)2010年江西省新余一中 宜春中学 高安中学高二上学期第三次段考化学试卷2014-2015山东省淄博市沂源一中高二12月月考化学试卷2014-2015山东省淄博市沂源县第一中学高二12月月考化学试卷步步为赢高二化学寒假作业 :作业九 盐类水解的应用江苏苏州市第四中学2019-2020学年高二下学期5月自学能力测试化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 教材帮陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题(已下线)练习11 盐类的水解-2020-2021学年【补习教材·寒假作业】高二化学(人教版)吉林省长春外国语学校2020-2021学年高二下学期期初考试化学试题(已下线)作业09 盐类的水解-2021年高二化学暑假作业(人教版2019)(已下线)3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)第三节 盐类的水解 第2课时 盐类水解的影响因素及应用吉林省乾安县第七中学2021-2022学年高二上学期第三次质量检测化学试题作业(十八) 影响盐类水解的主要因素 盐类水解的应用(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4﹒7H2O)的流程如下:
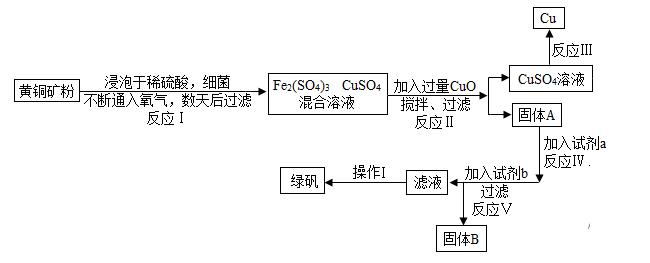
(1)已知:
加入CuO将溶液的pH调节到约为4,用平衡移动原理解释该操作的原因________ 。
(2)写出能实现反应III的化学方程式_______________ 。
(3)试剂b为___________________ 。
(4)反应|的化学方程式_______________________ 。

(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化为氢氧化物沉淀时的PH | 7.6 | 4.7 | 2.7 |
| 完全转化为氢氧化物沉淀时的PH | 9.6 | 6.7 | 3.7 |
加入CuO将溶液的pH调节到约为4,用平衡移动原理解释该操作的原因
(2)写出能实现反应III的化学方程式
(3)试剂b为
(4)反应|的化学方程式
您最近半年使用:0次



