名校
1 . 兴趣小组为探究FeCl3在溶液中显黄色的原因,进行如下实验。
下列说法不正确 的是
| 序号 | 操作 | 试剂a | 试剂b | 现象 |
| ① | 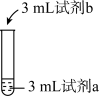 | 0.2mol/L FeCl3 | 蒸馏水 | 溶液为黄色 |
| ② | 0.2mol/L FeCl3 | 2mol/L盐酸 | 溶液为浅黄色 | |
| ③ | 0.2mol/L Fe(NO3)3 | 蒸馏水 | 溶液为浅黄色 | |
| ④ | 0.2mol/L Fe(NO3)3 | 2mol/L硝酸 | 溶液接近无色 |
| A.②中的溶液颜色比①中的浅,主要是因为Fe3+的水解平衡逆向移动 |
| B.由③④可知,Fe(NO3)3溶液显浅黄色与Fe3+水解有关 |
| C.由以上实验可推知,FeCl3溶液显黄色与Fe3+水解、Cl-存在均有关 |
| D.由以上实验可推知,导致②③溶液均为浅黄色的原因相同 |
您最近一年使用:0次
2023-11-02更新
|
376次组卷
|
6卷引用:北京市海淀区2023-2024学年高三上学期期中测试化学试题
名校
2 . 碱式碳酸锰[Mn2(OH)2CO3]是一种不溶于水的固体,是制造其他含锰化合物的原料。工业上以方锰矿(主要成分为 MnO,还含有少量的 Fe3O4、Al2O3、CaO、SiO2)为原料制备碱式碳酸锰。
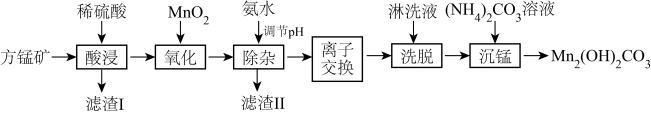
25℃时,相关物质的 Ksp如下表:
回答下列问题:
(1)“酸浸”时,滤渣I的成分是___________ (填化学式)。
(2)“氧化”时,该反应的离子方程式为___________ 。
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥______ ;若 A13+沉淀完全时,则溶液中 Fe3+的物质的量浓度为___________ mol·L-1(通常认为溶液中的离子浓度≤1×10-5mol·L-1沉淀完全)
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为___________ (填“硫酸”、“氢氧化钠溶液”或“蒸馏水”)。
(5)“沉锰”时,反应的离子方程式为___________ ,过滤、洗涤、干燥,得到Mn2(OH)2CO3,检验沉淀是否洗涤干净的操作是___________ 。
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
①滴定终点的现象是___________ 。
②该产品中锰的质量分数为___________ 。(用含 a、V 的式子表示)。

25℃时,相关物质的 Ksp如下表:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| Ksp | 2×10-13 | 5×10-17 | 3×10-39 | 1×10-32 | 6×10-6 |
(1)“酸浸”时,滤渣I的成分是
(2)“氧化”时,该反应的离子方程式为
(3)“除杂”时,使用氨水的目的是将 Fe3+和Al3+转化为沉淀而除去,则应调节溶液的pH≥
(4)“离子交换”和“洗脱”时,发生反应:Mn2+ +2HR
 MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为
MnR2 +2H+(HR 是氢型交换树脂)。洗脱为了提高“洗脱”效率,淋洗液应为(5)“沉锰”时,反应的离子方程式为
(6)为测定产品中锰的含量,取 a g 样品于烧杯中,加水溶解,加入足量的稀硫酸溶解,滴加过量的 0.1000 mol·L-1(NH4)2S2O8溶液将锰元素转化为 MnO
 ,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。
,充分反应后加热一段时间,冷却将烧杯中的溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用0.1000mol·L-1FeSO4标准溶液滴定,达滴定终点时,消耗 FeSO4溶液的体积为 V mL。①滴定终点的现象是
②该产品中锰的质量分数为
您最近一年使用:0次
2022-06-01更新
|
606次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年高三上学期统练(VII)化学试题
名校
3 . 探究铝片与 溶液的反应。
溶液的反应。
下列说法不正确的是
 溶液的反应。
溶液的反应。| 实验 | 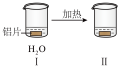 |  |
| 现象 | 无明显现象 | Ⅲ中铝片表面产生细小气泡 Ⅳ中出现白色浑浊,产生大量气泡(经检验为  和 和 ) ) |
A. 溶液中存在水解平衡: 溶液中存在水解平衡: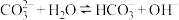 |
B.若将打磨过的铝片加入Ⅰ中,加热后会出现气泡。再对比上图Ⅰ、Ⅲ,说明 溶液能破坏铝表面的保护膜 溶液能破坏铝表面的保护膜 |
C.推测出现白色浑浊的原因可能为: |
D.加热和 逸出对 逸出对 水解平衡移动方向的影响是相反的 水解平衡移动方向的影响是相反的 |
您最近一年使用:0次
2021-06-29更新
|
203次组卷
|
3卷引用: 北京市回民学校2023-2024学年高三上学期统练二化学试题
北京市回民学校2023-2024学年高三上学期统练二化学试题浙江省湖州市2020-2021学年高二下学期期末调研测试卷化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
4 . 25℃时,下列有关电解质溶液的说法正确的是( )
A.加水稀释0.1mol/L氨水,溶液中c(H+)·c(OH-)和 均不变 均不变 |
| B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 |
C.向盐酸中滴加氨水至溶液呈中性,所得溶液中c(NH )=c(Cl-) )=c(Cl-) |
| D.向CH3COOH溶液中加入少量CH3COONa固体,溶液的pH降低 |
您最近一年使用:0次
2020-11-09更新
|
723次组卷
|
2卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
名校
解题方法
5 . 下列有关说法正确的是
| A.反应NH3(g)+HCl(g)==NH4Cl(s)在室温下可自发进行,则该反应的∆H<0 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
C.CH3COOH溶液加水稀释后,溶液中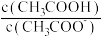 的值增大 的值增大 |
D.Na2CO3溶液中加入少量Ca(OH)2固体, 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
您最近一年使用:0次
2020-10-25更新
|
136次组卷
|
2卷引用:北京五中2021届高三上学期第二次月考化学试题
名校
6 . 下列各项比较中,一定相等的是
| A.相同质量的 Fe 完全转化为FeCl2和FeCl3 时转移的电子数 |
| B.相同质量的苯和乙炔所含的碳原子的数目 |
| C.标准状况下的 2.24 L HCl 气体和1 L 0.1 mol·L−1盐酸中所含Cl−的数目 |
D.相同物质的量浓度的NH4Cl和(NH4)2Fe(SO4)2溶液中 NH 的浓度 的浓度 |
您最近一年使用:0次
2020-07-01更新
|
89次组卷
|
2卷引用:北京市海淀区北京大学附中2020 届高三化学阶段性测试化学试题
名校
7 . 测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
| 时刻 | ① | ② | ③ | ④ |
温度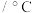 | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
A.Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3-+OH- HSO3-+OH- |
| B.④产生的白色沉淀是BaSO4 |
| C.①→③的过程中,c(SO32-)在降低 |
| D.①→③的过程中,温度与c(SO32-)相比,前者对水解平衡的影响更大 |
您最近一年使用:0次
2020-06-17更新
|
247次组卷
|
4卷引用:北京市房山区2020届高三第二次模拟考试化学试题
北京市房山区2020届高三第二次模拟考试化学试题【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题(已下线)北京市第四中学2022-2023高二上学期期中考试化学试题(已下线)第13讲 盐类的水解-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
解题方法
8 . 实验测得0.1mol·L-1Na2SO3溶液pH随温度升高而变化的曲线如图所示。将b点溶液冷却至25℃,加入盐酸酸化的BaC12溶液,能明显观察到白色沉淀。下列说法正确的是

A.Na2SO3溶液中存在水解平衡SO +2H2O +2H2O H2SO3+2OH- H2SO3+2OH- |
B.温度升高,溶液pH降低的主要原因是SO 水解程度减小 水解程度减小 |
C.a、b两点均有c(Na+)=2[c(SO )+c(HSO )+c(HSO )+c(H2SO3)] )+c(H2SO3)] |
| D.将b点溶液直接冷却至25℃后,其pH小于a点溶液 |
您最近一年使用:0次
2020-04-22更新
|
378次组卷
|
4卷引用:T12-电解质溶液
(已下线)T12-电解质溶液贵州省2020年普通高等学校招生适应性测试理综化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(11-16)江苏省徐州市2023-2024学年高三第四次模拟考试化学试卷
名校
解题方法
9 . 在药物制剂中,抗氧剂与被保护的药物在与 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。 、
、 和
和 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知: 溶于水发生反应:
溶于水发生反应: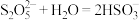

 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。 、
、 和
和 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是已知:
 溶于水发生反应:
溶于水发生反应: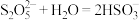
| 实验用品 | 实验操作和现象 |
① 溶液 溶液②    溶液 溶液③   溶液 溶液 | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与  反应,保持体系中 反应,保持体系中 浓度不变,不同pH条件下, 浓度不变,不同pH条件下, 随反应时间变化如图所示。 随反应时间变化如图所示。实验3:调溶液①②③的pH相同,保持体系中  浓度不变,测得三者与 浓度不变,测得三者与 的反应速率相同。 的反应速率相同。 |

A. 溶液显碱性,原因是: 溶液显碱性,原因是: |
B. 溶液中 溶液中 的电离程度大于水解程度 的电离程度大于水解程度 |
C.实验2说明, 在 在 时抗氧性最强 时抗氧性最强 |
| D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同 |
您最近一年使用:0次
2020-02-13更新
|
161次组卷
|
5卷引用:北京市海淀区中关村中学2020届高三三模化学试题
17-18高三上·北京·期中
名校
10 . ①分别取1mL0.0lmol/LFeCl3和0.01mol/LKSCN混合液两份;②向第一份中滴加3滴饱和FeCl3溶液,溶液颜色加深;③再向上述溶液中滴加3滴1mol・L-1NaOH溶液,溶液颜色变浅且出现浑浊:④向第二份中逐渐滴加1mol・L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析错误的是
| A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-=Fe(SCN)3正向移动 |
| B.实验③中发生反应:Fe3++3OH-=Fe(OH)3↓ |
| C.实验③和④中溶液颜色变浅的原因相同 |
| D.实验②、③、④均可说明浓度改变对平衡移动的影响 |
您最近一年使用:0次
2019-11-15更新
|
578次组卷
|
8卷引用:北京四中2018届上学期高三年级期中考试化学试卷



