1 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 往 溶液中滴加几滴浓硫酸,溶液由橙色变为黄色 溶液中滴加几滴浓硫酸,溶液由橙色变为黄色 |  呈橙色, 呈橙色, 呈黄色 呈黄色 |
| B | 将浓硫酸加入蔗糖中形成多孔炭 | 浓硫酸具有强氧化性和脱水性 |
| C | 低温石英(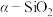 )制作石英手表 )制作石英手表 |  属于共价晶体,熔点高 属于共价晶体,熔点高 |
| D | 用钨钢钻头给混凝土墙面钻孔 | 合金硬度比其组成的纯金属低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 乙氨酸( )是一种两性有机物,可与盐酸反应生成盐酸盐(
)是一种两性有机物,可与盐酸反应生成盐酸盐( )。已知
)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是
 )是一种两性有机物,可与盐酸反应生成盐酸盐(
)是一种两性有机物,可与盐酸反应生成盐酸盐( )。已知
)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是A.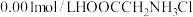 水溶液的pH=3 水溶液的pH=3 |
B.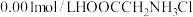 水溶液加水稀释,pH升高 水溶液加水稀释,pH升高 |
C. 在水中的电离方程式为: 在水中的电离方程式为: |
D. 水溶液中: 水溶液中: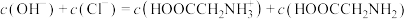 |
您最近一年使用:0次
3 . 安息香酸(HR)是最简单的一元芳香酸,其钠盐(用NaR表示)的水溶液呈碱性。已知常温下,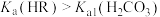 。下列说法正确的是
。下列说法正确的是
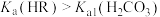 。下列说法正确的是
。下列说法正确的是A.常温下, HR水溶液的 HR水溶液的 |
| B.向NaR水溶液中加水稀释,溶液的pH升高 |
C.NaR水溶液中,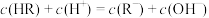 |
D.常温下,NaR溶液的碱性比同浓度的 溶液弱 溶液弱 |
您最近一年使用:0次
解题方法
4 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将 气体通入 气体通入 溶液,出现黑色沉淀 溶液,出现黑色沉淀 |  不溶于稀硫酸 不溶于稀硫酸 |
| B | 取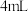 乙醇,加入 乙醇,加入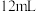 浓硫酸及少量沸石,迅速升温至 浓硫酸及少量沸石,迅速升温至 ,将产生的气体通过溴水,溴水褪色 ,将产生的气体通过溴水,溴水褪色 | 产物中有乙烯 |
| C | 向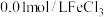 溶液中加入少量 溶液中加入少量 固体,溶液颜色加深 固体,溶液颜色加深 |  水解程度增大 水解程度增大 |
| D | 向硫酸铜溶液中逐滴滴加浓氨水,先产生蓝色沉淀,而后沉淀逐渐溶解 |  是两性氢氧化物 是两性氢氧化物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 苯甲酸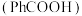 是一种弱酸,用于制备防腐剂苯甲酸钠,下列说法正确的是
是一种弱酸,用于制备防腐剂苯甲酸钠,下列说法正确的是
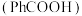 是一种弱酸,用于制备防腐剂苯甲酸钠,下列说法正确的是
是一种弱酸,用于制备防腐剂苯甲酸钠,下列说法正确的是A.稀释苯甲酸钠溶液,溶液的 减小 减小 |
B.苯甲酸钠的溶液中: |
C.常温下, 的苯甲酸溶液中,水电离的 的苯甲酸溶液中,水电离的 为 为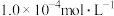 |
D.用 溶液滴定苯甲酸溶液测浓度时,用甲基橙作指示剂 溶液滴定苯甲酸溶液测浓度时,用甲基橙作指示剂 |
您最近一年使用:0次
6 . 优化的NaFePO4复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是FeS2,含少量SiO2等杂质)为原料制备NaFePO4的流程如图所示。
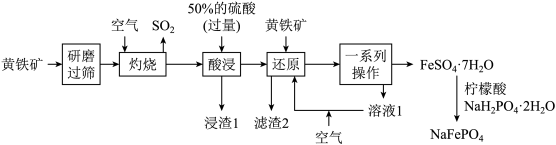
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为_______ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为_______ (答一条即可)。
(4)“浸渣1”的主要成分是_______ (填化学式) 。
(5)“还原”中FeS2与Fe3+反应的离子方程式为_______ ;通入空气的条件下, “溶液1”可在“还原”步骤中循环利用,则通入空气的目的是_______ 。
(6)“一系列操作”包括_______ 、_______ 、过滤、 洗涤和低温干燥。
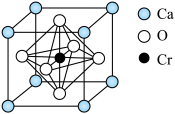
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为_______ ;与Cr最近的氧原子的个数为_______ ;Ca 和Cr的最近距离为a nm,设NA为阿伏加德常数的值,则该晶体密度为_______ (填含 a、NA的表达式)g· cm-3。

已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
| 离子 | Fe2+ | Fe3+ |
| Ksp | 8×10-16 | 4×0-38 |
(1)“研磨”的目的是
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中FeS2与Fe3+反应的离子方程式为
(6)“一系列操作”包括
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为

您最近一年使用:0次
名校
7 . 醛类可与 饱和溶液发生反应
饱和溶液发生反应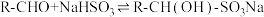 (水溶性)。下列叙述错误的是
(水溶性)。下列叙述错误的是
 饱和溶液发生反应
饱和溶液发生反应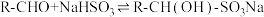 (水溶性)。下列叙述错误的是
(水溶性)。下列叙述错误的是A.除去氯苯(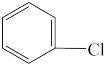 )中微量杂质苯甲醛( )中微量杂质苯甲醛(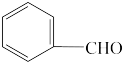 ),加入饱和 ),加入饱和 溶液,且浓度要尽可能大 溶液,且浓度要尽可能大 |
B.将 转化为 转化为 ,加入的试剂可为HCl或NaOH ,加入的试剂可为HCl或NaOH |
| C.将醛类从水相中分离出来,只宜采用蒸馏法 |
D.室温下, 的电离常数 的电离常数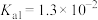 , ,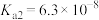 , , 的水溶液呈酸性 的水溶液呈酸性 |
您最近一年使用:0次
名校
解题方法
8 . 氨基羧酸盐在工农业、生活中有着广泛应用,其中氨基甲酸铵(NH2COONH4)可用作肥料、洗涤剂等。实验室用下图所示装置制备氨基甲酸铵,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则主要生成碳酸氢铵。
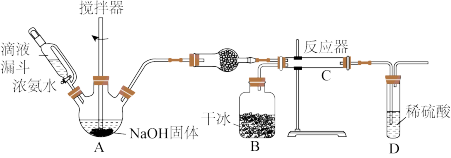
(1)盛放NaOH固体的仪器名称是_______ ,干燥管中的试剂为_______ 。
(2)无水条件下合成氨基甲酸铵的化学反应方程式为_______ ;若该反应能自发进行,则该反应的
_______ 0,(填“>”或“<”);对比碳酸钙和盐酸反应制取CO2,该实验利用干冰升华制取CO2,其优点有_______ 。
A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是_______ 。(写出其中任意1条)
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)______
(5)该小组在上述实验方案基础上又进行了探究,分别用两份不同初始浓度的氨基甲酸铵溶液在不同温度下测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。根据图中信息,能说明该水解反应速率随温度升高而加快的证据是_______ 。


(1)盛放NaOH固体的仪器名称是
(2)无水条件下合成氨基甲酸铵的化学反应方程式为

A.提供较低的反应温度,有利于过程的自发进行
B.所得氨基甲酸铵含杂质较少
C.更加绿色环保
D.对CO2的流速能更好的调控与掌握
(3)上述实验装置存在缺陷,改进的方法是
(4)某小组拟在相同温度下,探究氨基甲酸铵浓度对氨基甲酸铵水解反应速率的影响。限选试剂与仪器:2.0mol/L NH2COONH4溶液、蒸馏水、烧杯、量筒、秒表、电导率仪、恒温水浴槽。设计实验方案:在不同氨基甲酸铵溶液浓度下,测定电导率数值的变化量相同所需的时间。参照下表格式,在表中的空白栏目填上需记录的待测物理量和所拟定的数据。(数据用字母表示,其中体积用V1、V2等表示)
| 物理量 实验序号 | 温度T(℃) | 导电率变化量∆S | … | |||
| 1 | a | b | ||||
| 2 | a | b |

您最近一年使用:0次
2022-10-09更新
|
275次组卷
|
3卷引用:广东省六校2022-2023学年高三上学期第二次联考化学试题
9 . 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是
 )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是A.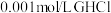 水溶液的 水溶液的 |
B.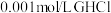 水溶液加水稀释, 水溶液加水稀释, 升高 升高 |
C. 在水中的电离方程式为: 在水中的电离方程式为: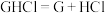 |
D. 水溶液中: 水溶液中: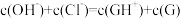 |
您最近一年使用:0次
2021-06-11更新
|
10404次组卷
|
44卷引用:2021年新高考广东化学高考真题
2021年新高考广东化学高考真题2021年广东省高考化学试卷变式题1-10题2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)天津市南开区2022届高三一模化学试题上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题广东省深圳市龙华区2021-2022学年高二上学期期末学业质量监测化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第49讲 盐类的水解(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第4讲 盐类的水解广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题山东省淄博市2020-2021学年高二下学期期末考试化学试题浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题福建省泉州市泉港一中、厦门外国语石狮分校2021-2022学年高二下学期期中联考化学试题(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题重庆市长寿区2022-2023学年高二上学期期末质量检测化学试题(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)天津市耀华中学2023-2024学年高二上学期11月期中化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷
解题方法
10 . 实验测得0.1mol·L-1Na2SO3溶液pH随温度升高而变化的曲线如图所示。将b点溶液冷却至25℃,加入盐酸酸化的BaC12溶液,能明显观察到白色沉淀。下列说法正确的是

A.Na2SO3溶液中存在水解平衡SO +2H2O +2H2O H2SO3+2OH- H2SO3+2OH- |
B.温度升高,溶液pH降低的主要原因是SO 水解程度减小 水解程度减小 |
C.a、b两点均有c(Na+)=2[c(SO )+c(HSO )+c(HSO )+c(H2SO3)] )+c(H2SO3)] |
| D.将b点溶液直接冷却至25℃后,其pH小于a点溶液 |
您最近一年使用:0次
2020-04-22更新
|
378次组卷
|
4卷引用:广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(11-16)
(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(11-16)贵州省2020年普通高等学校招生适应性测试理综化学试题(已下线)T12-电解质溶液江苏省徐州市2023-2024学年高三第四次模拟考试化学试卷



