1 . 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_______ 。(单项)
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.铵根离子浓度增大,抑制了氨水的电离,使c(OH-)减小
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.铵根离子浓度增大,抑制了氨水的电离,使c(OH-)减小
您最近一年使用:0次
解题方法
2 . 新冠疫情期间,家庭常备84消毒液、医用酒精等。某瓶84消毒液所贴标签的部分内容见图。有关该瓶消毒液的说法正确的是
84 消毒液 [用途]适用于一般物品的表面消毒,含餐具、果蔬、白色织物等。可杀灭肠道致病菌、化脓性球菌。 [性状]无色透明液体 [有效成分]次氯酸 [规格]500mL/瓶,约505g [含量]氯含量为 6.00% [贮藏]阴凉处密封保存 |
| A.每瓶消毒液含次氯酸钠约505g |
| B.消毒液的密度为1.10g⋅cm-3 |
| C.密封保存的目的是防止次氯酸钠见光分解 |
D.每瓶消毒液中含氯微粒的物质的量浓度约为1.71 |
您最近一年使用:0次
3 . 冰壶比赛称为“冰上的国际象棋”,制作冰壶用的标准砥石的化学成分为石英碱长正长岩,常见的组分有钾长石K[AlSi3O8]和钠长石Na[AlSi3O8]等。完成下列填空:
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是_______ ,原子核外有两个未成对电子的元素有_______ 。
(2)用一个化学方程式比较钠和铝的金属性的强弱_______ ,并用原子结构知识的观点解释原因_______ 。
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式_______ 。
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为_______ 。
(4)KAlO2溶液中,n(K+)_______ n(AlO )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因_______ 。
(1)上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是
(2)用一个化学方程式比较钠和铝的金属性的强弱
(3)我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式
______Al+_______K[AlSi3O8]+_______AlCl3→_______Si+_______AlOCl+_______KAlO2;
上述反应中若产生14g硅,转移的电子数为
(4)KAlO2溶液中,n(K+)
 )(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因
您最近一年使用:0次
名校
解题方法
4 . 对于0.1mol/LNa2SO3溶液,正确的是
| A.升高温度,溶液的pH降低 |
B.加入少量NaOH固体,c( )与c(Na+)均增大 )与c(Na+)均增大 |
C.c(Na+)+c(H+)=2c( )+2c( )+2c( )+c(OH-) )+c(OH-) |
D.c(Na+)=2c( )+c( )+c( )+c(H2SO3) )+c(H2SO3) |
您最近一年使用:0次
2022-01-05更新
|
318次组卷
|
3卷引用:上海市吴淞中学2022-2023学年高三上学期期中考试化学试题
上海市吴淞中学2022-2023学年高三上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题(已下线)专题20 用守恒思想破解溶液中粒子浓度大小的比较-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
5 . 关于联合制碱法的说法正确的是
| A.原料CO2来自石灰石分解 | B.向母液中通入NH3可抑制NH 水解 水解 |
| C.循环利用NH3 | D.将母液蒸发结晶析出NH4Cl |
您最近一年使用:0次
6 . 鸟嘌呤( )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是
 )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用 表示)。已知
表示)。已知 水溶液呈酸性,下列叙述正确的是
水溶液呈酸性,下列叙述正确的是A.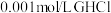 水溶液的 水溶液的 |
B.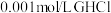 水溶液加水稀释, 水溶液加水稀释, 升高 升高 |
C. 在水中的电离方程式为: 在水中的电离方程式为: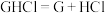 |
D. 水溶液中: 水溶液中: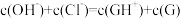 |
您最近一年使用:0次
2021-06-11更新
|
10404次组卷
|
44卷引用:上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题
上海市曹杨中学2021-2022 学年高三下学期期中考试化学试题2021年新高考广东化学高考真题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题1-10题(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)天津市南开区2022届高三一模化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第49讲 盐类的水解(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第4讲 盐类的水解2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题山东省淄博市2020-2021学年高二下学期期末考试化学试题浙江省吴兴高级中学2021-2022学年高二上学期12月月考化学试题福建省泉州市泉港一中、厦门外国语石狮分校2021-2022学年高二下学期期中联考化学试题(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)云南省玉溪市通海县第三中学2021-2022学年高二上学期期末考试化学试题广东省深圳市龙华区2021-2022学年高二上学期期末学业质量监测化学试题甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题重庆市长寿区2022-2023学年高二上学期期末质量检测化学试题(已下线)第14练 水溶液中粒子浓度的关系判断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题天津市耀华中学2023-2024学年高二上学期11月期中化学试题陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷
7 . 土壤中游离 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用
越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用
 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用
越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用| A.硫酸亚铁 | B.硝酸钾 | C.碳酸钾 | D.氯化铵 |
您最近一年使用:0次
2021-04-20更新
|
250次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题陕西省咸阳市2020-2021学年高二下学期期末质量检测化学试题(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
8 . 下列对 溶液进行实验操作的有关说法中错误的是
溶液进行实验操作的有关说法中错误的是
 溶液进行实验操作的有关说法中错误的是
溶液进行实验操作的有关说法中错误的是| A.加水稀释,溶液中所有离子的浓度都减小 |
B.保持温度不变,通入 后溶液pH减小 后溶液pH减小 |
C.加入 固体后, 固体后,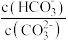 减小 减小 |
D.升高温度,溶液中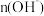 增大 增大 |
您最近一年使用:0次
2021-04-08更新
|
158次组卷
|
2卷引用:上海市奉贤区2021届高三高中等级考质量调研(4月)化学试题
9 . 测定0.1 mol/L Na2SO3溶液先升温再降温过程中的pH,数据如下:
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡: +H2O +H2O  +OH− +OH− |
B.④的pH与①不同,是由于 浓度增大造成的 浓度增大造成的 |
| C.①→③的过程中,水的电离程度变大 |
| D.①与④的Kw值相等 |
您最近一年使用:0次
10 . 煤炭是我国最主要能源。煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K= ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:___________ ,若该反应只有在持续高温下才能自发进行 则该反应为___________ (“吸热”或“放热”)反应。
(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
①实验1中以v(CO2)表示的反应速率为___________ 。
②900 ℃时,反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数___________ 。向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,平衡___________ (选填“正反应方向”、“逆反应方向”或“不”)移动。
(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
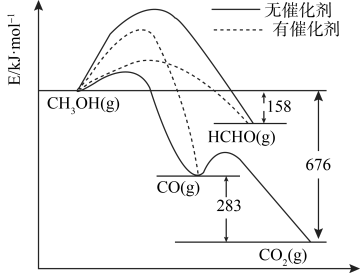
①在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)→CO(g)+H2O(g)___________ 。
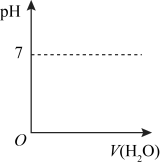
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化__________ 。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=
 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:(2) 将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
②900 ℃时,反应CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数
CO2(g)+H2(g)的平衡常数(3)将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。

①在有催化剂作用下,CH3OH与O2反应主要生成
②HCHO可进一步被氧化为重要工业原料 HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次



