名校
1 . 无水 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
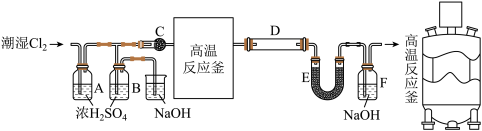
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70% 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
回答下列问题:
(1)C装置的名称为_______ ;
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
(3)高温反应釜中发生反应的化学方程式为_______ ;
(4)E装置的作用为_______ ;
(5)为研究 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:

已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是_______ ,D是_______ ;
②由C得到D的化学方程式为_______ 。
 是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
是一种重要的化工原料,其熔点306℃、沸点316℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。一般采用低共熔混合物反应法(熔融法)制备高纯度的三氯化铁,其模拟反应装置如下:
实验过程:在一个带有耐酸衬里的反应器中(即图中的高温反应釜),将70%
 和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。
和30%KCl在600℃下共熔。再将铁屑溶解于共熔物中,再通入干燥氯气。反应生成的升华后导出,再经冷凝收集。回答下列问题:
(1)C装置的名称为
(2)当氯气通入时,A中有酸雾产生。为吸收酸雾,C中应盛放的物质为_______;(填字母)
A.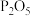 | B.CaO | C. | D.NaOH |
(4)E装置的作用为
(5)为研究
 的性质,某化学兴趣小组取一定质量的
的性质,某化学兴趣小组取一定质量的 (摩尔质量为
(摩尔质量为 )在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
)在惰性气体保护下受热分解时,所得固体产物的剩余质量分数(剩余质量与原样品质量的百分比)随温度变化的曲线如图所示。试利用图中信息并结合所学的知识,回答下列各问题:
已知:A为红褐色固体,B中含有三种元素,C为红棕色固体,D为黑色固体。
①固体产物的化学式B是
②由C得到D的化学方程式为
您最近一年使用:0次
2022-11-03更新
|
422次组卷
|
3卷引用:河南省新乡市第一中学2023-2024学年高三上学期12月月考化学试题
2 . 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置___________
(2)过程Ⅰ中,在 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅰ中, 催化过程可表示为:
催化过程可表示为:
ⅰ: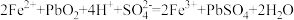
ⅱ:……
①写出ⅱ的化学方程式:___________ 。
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的 溶液中加入
溶液中加入___________ 溶液,溶液无颜色变化,再加入少量 ,溶液变为
,溶液变为___________ 色。
b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制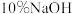 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有___________ (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;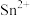 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

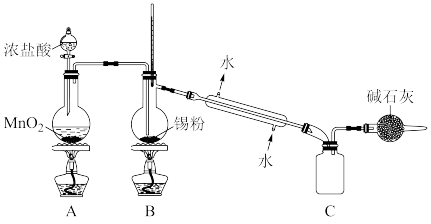
①骤Ⅰ加入Sn粉的作用:___________ 。
②步骤Ⅳ中检验 是否洗涤干净的操作是
是否洗涤干净的操作是___________ ,证明已洗净。
③实验室欲用下图装置制备少量 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是___________ ,装有碱石灰的球形干燥管的作用是___________ 。

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置
(2)过程Ⅰ中,在
 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是(3)过程Ⅰ中,
 催化过程可表示为:
催化过程可表示为:ⅰ:
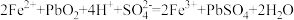
ⅱ:……
①写出ⅱ的化学方程式:
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的
 溶液中加入
溶液中加入 ,溶液变为
,溶液变为b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制
 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;
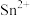 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
①骤Ⅰ加入Sn粉的作用:
②步骤Ⅳ中检验
 是否洗涤干净的操作是
是否洗涤干净的操作是③实验室欲用下图装置制备少量
 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是
您最近一年使用:0次
解题方法
3 . I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
(1)下列情况表明反应达到平衡状态的是________ (填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________ 。
(3)实验3和实验2相比,改变的条件是_____________ 。
II.(1)硫化钠溶液具有较强碱性,其原因是___________ (用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 的值增大,可采取的措施是
的值增大,可采取的措施是___________ (填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
 CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为
(3)实验3和实验2相比,改变的条件是
II.(1)硫化钠溶液具有较强碱性,其原因是
(2)欲使0.1mol的Na2S溶液中,
 的值增大,可采取的措施是
的值增大,可采取的措施是A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
您最近一年使用:0次
2017-04-28更新
|
165次组卷
|
2卷引用:河南省豫南九校2016-2017学年高二下学期期中联考化学试题



