1 . 下列溶液中各离子的物质的量浓度关系正确的是
A. 溶液中:滴加几滴稀盐酸, 溶液中:滴加几滴稀盐酸, 增大 增大 |
B.饱和小苏打溶液中: |
C. 与 与 混合溶液呈酸性: 混合溶液呈酸性: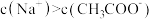 |
D. 时, 时, 的纯碱溶液: 的纯碱溶液: |
您最近半年使用:0次
名校
解题方法
2 . 下列操作能达到相应实验目的的是
| 实验操作 | 实验目的 | |
| A | 向等体积、等pH的两种酸溶液HA和HB中分别加入足量锌粉,充分反应后,HA溶液产生更多的氢气 | 说明Ka(HA)>Ka(HB) |
| B | 向5mL0.1mol/LCuSO4溶液中先加入2mL0.4mol/LNaOH溶液,再加入1mL0.1mol/LNa2S溶液 | 探究常温下Ksp[Cu(OH)2]>Ksp(CuS) |
| C | 向滴有酚酞的碳酸钠溶液中加入适量BaCl2固体,溶液颜色变浅 | 说明碳酸钠溶液中存在水解平衡 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-27更新
|
376次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
3 . 某研究小组利用电解锰渣(主要成分是MnS,含少量 、
、 、CaO)制备高纯
、CaO)制备高纯 晶体,流程如下:
晶体,流程如下:
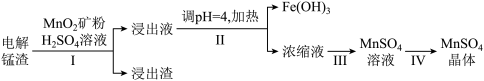
(1)下列有关说法不正确 的是___________。
(2)过程II需持续加热一段时间,目的是___________ 。
(3)过程III除去 并富集
并富集 的原理为:
的原理为: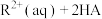 (油相)
(油相) (油相)
(油相) [
[ 表示
表示 或
或 ]。
]。
实验步骤如下:
①调节浓缩液pH,加入溶有HA的磺化煤油,系列操作,分离得水层;
②继续调节水层pH,加入溶有HA的磺化煤油,系列操作,分离得油层;
③向②所得油层中加入试剂X,系列操作,得 溶液。
溶液。
上述步骤中的进行“系列操作”的主要仪器名称是___________ ,试剂X为___________ 。
(4)不同温度下 的溶解度如下表。
的溶解度如下表。
从下列选项中选择“过程IV”的正确操作并排序:___________ 。
将 溶液加热至100℃→_________→________→洗涤→干燥
溶液加热至100℃→_________→________→洗涤→干燥
a.蒸发至出现大量晶体 b.蒸发至溶液表面出现晶膜
c.冷却结晶,过滤 d.趁热过滤
(5) 纯度的测定:准确称取mg产品,加入足量稀硫酸充分溶解后,加入足量
纯度的测定:准确称取mg产品,加入足量稀硫酸充分溶解后,加入足量 固体(不溶于水)将
固体(不溶于水)将 完全转化为
完全转化为 过滤,用
过滤,用 的
的 标准溶液滴定至终点,消耗20.00mL标准溶液,则
标准溶液滴定至终点,消耗20.00mL标准溶液,则 的纯度为
的纯度为___________ (用含m的代数式表示)。
 、
、 、CaO)制备高纯
、CaO)制备高纯 晶体,流程如下:
晶体,流程如下:
(1)下列有关说法
| A.过程I、II均涉及过滤操作 |
B.过程I,适当提高 溶液浓度可提高锰的浸出率 溶液浓度可提高锰的浸出率 |
C.过程I,加 可减少有毒气体的生成 可减少有毒气体的生成 |
| D.过程II,调pH最好选用NaOH溶液 |
(3)过程III除去
 并富集
并富集 的原理为:
的原理为: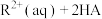 (油相)
(油相) (油相)
(油相) [
[ 表示
表示 或
或 ]。
]。实验步骤如下:
①调节浓缩液pH,加入溶有HA的磺化煤油,系列操作,分离得水层;
②继续调节水层pH,加入溶有HA的磺化煤油,系列操作,分离得油层;
③向②所得油层中加入试剂X,系列操作,得
 溶液。
溶液。上述步骤中的进行“系列操作”的主要仪器名称是
(4)不同温度下
 的溶解度如下表。
的溶解度如下表。| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 52.9 | 62.9 | 60.0 | 53.6 | 45.6 | 35.3 |
将
 溶液加热至100℃→_________→________→洗涤→干燥
溶液加热至100℃→_________→________→洗涤→干燥a.蒸发至出现大量晶体 b.蒸发至溶液表面出现晶膜
c.冷却结晶,过滤 d.趁热过滤
(5)
 纯度的测定:准确称取mg产品,加入足量稀硫酸充分溶解后,加入足量
纯度的测定:准确称取mg产品,加入足量稀硫酸充分溶解后,加入足量 固体(不溶于水)将
固体(不溶于水)将 完全转化为
完全转化为 过滤,用
过滤,用 的
的 标准溶液滴定至终点,消耗20.00mL标准溶液,则
标准溶液滴定至终点,消耗20.00mL标准溶液,则 的纯度为
的纯度为
您最近半年使用:0次
名校
解题方法
4 . 为了配制NH 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量NH4NO3;②适量NaCl;③适量氨水;④适量HCl
 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量NH4NO3;②适量NaCl;③适量氨水;④适量HCl
| A.①② | B.②③ | C.①③ | D.②④ |
您最近半年使用:0次
名校
5 . MnCl2极易吸水潮解,易溶于水和醋酸,不溶于苯;金属活泼性Mn>Fe。某科研小组由粗锰粉(含Mn及少量Fe、Ni、Pb等单质)为原料制备MnCl2,部分实验过程如下:

(1)“酸溶”时,盐酸要缓慢滴加的原因是___________ 。酸溶过程中溶液中Fe2+的浓度先增大后略有减少,减少的原因是___________ 。
(2)“除铁”时,先加入H2O2,后加入MnCO3固体。加入MnCO3固体时有CO2生成,反应的离子方程式为___________ 。
(3)MnCl2·4H2O经加热脱水可制得MnCl2,测得加热升温过程中固体的质量变化如图所示。
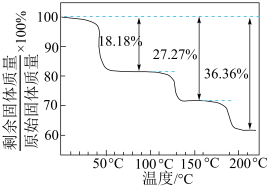
① 若要获得MnCl2·H2O,需控制的温度范围是___________ (写出计算推理过程)。
② MnCl2·H2O继续脱去结晶水时易发生副反应,产生MnO2和碱式氯化锰杂质,为减少副反应的发生,可采取的实验操作是___________ 。
(4) MnCl2·4H2O经加热脱水制得的MnCl2纯度不高,实验室可由固体四水醋酸锰[(CH3COO)2Mn·4H2O]和液体乙酰氯(CH3COCl)经过室温除水、加热回流等步骤制得高纯MnCl2,涉及的主要反应有CH3COCl+H2O→CH3COOH+HCl、(CH3COO)2Mn+2CH3COCl MnCl2↓+2(CH3CO)2O。为获得较高产率的高纯MnCl2,请补充实验方案:取四水醋酸锰24.5 g(0.1 mol)和50 mL苯置于烧瓶中,边搅拌边加入
MnCl2↓+2(CH3CO)2O。为获得较高产率的高纯MnCl2,请补充实验方案:取四水醋酸锰24.5 g(0.1 mol)和50 mL苯置于烧瓶中,边搅拌边加入___________ ,充分反应后过滤,___________ ,干燥,得到MnCl2.[供选择的试剂:CH3COCl(0.1 mol CH3COCl的体积约7 mL)、苯、水]

(1)“酸溶”时,盐酸要缓慢滴加的原因是
(2)“除铁”时,先加入H2O2,后加入MnCO3固体。加入MnCO3固体时有CO2生成,反应的离子方程式为
(3)MnCl2·4H2O经加热脱水可制得MnCl2,测得加热升温过程中固体的质量变化如图所示。

① 若要获得MnCl2·H2O,需控制的温度范围是
② MnCl2·H2O继续脱去结晶水时易发生副反应,产生MnO2和碱式氯化锰杂质,为减少副反应的发生,可采取的实验操作是
(4) MnCl2·4H2O经加热脱水制得的MnCl2纯度不高,实验室可由固体四水醋酸锰[(CH3COO)2Mn·4H2O]和液体乙酰氯(CH3COCl)经过室温除水、加热回流等步骤制得高纯MnCl2,涉及的主要反应有CH3COCl+H2O→CH3COOH+HCl、(CH3COO)2Mn+2CH3COCl
 MnCl2↓+2(CH3CO)2O。为获得较高产率的高纯MnCl2,请补充实验方案:取四水醋酸锰24.5 g(0.1 mol)和50 mL苯置于烧瓶中,边搅拌边加入
MnCl2↓+2(CH3CO)2O。为获得较高产率的高纯MnCl2,请补充实验方案:取四水醋酸锰24.5 g(0.1 mol)和50 mL苯置于烧瓶中,边搅拌边加入
您最近半年使用:0次
2023-05-03更新
|
422次组卷
|
2卷引用:江苏省泰州市2022-2023学年高三上学期期末模拟考试化学试题
6 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mL0.01mol/LNa2S溶液中先滴入几滴0.01mol∙L-1CuSO4溶液有黑色沉淀生成,再滴入0.01mol/LZnSO4溶液,又有白色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
| B | 室温下,用pH计测得0.1mol/LCH3COONH4溶液的pH小于0.1mol/LNaHCO3溶液 | 水解平衡常数:Kh(CH3COO-)<Kh( ) ) |
| C | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2B溶液的pH | 酸性:HA>H2B |
| D | 向5mL0.005mol/LFeCl3溶液中加入5mL0.015mol/LKSCN溶液,溶液变红,再加入少量铁粉,溶液颜色变浅 | 加入铁粉后,Fe3++3SCN-⇌Fe(SCN)3向逆反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
7 . 下列有关实验说法不正确的是
| A.中和反应反应热的测定实验中,为了保证盐酸完全被中和,采用稍过量的NaOH溶液 |
B.除去 溶液中的 溶液中的 ,在加热并搅拌的条件下加入足量 ,在加热并搅拌的条件下加入足量 ,过滤,向滤液中加入适量盐酸 ,过滤,向滤液中加入适量盐酸 |
| C.往饱和氯化钠溶液中滴加浓盐酸,不能观察到白色沉淀产生 |
D.往 溶液中加入大量水,同时加热,促使水解趋于完全,得到 溶液中加入大量水,同时加热,促使水解趋于完全,得到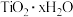 |
您最近半年使用:0次
8 . 常温下,pH=10的 溶液1mL加水稀释至10mL,下列说法错误的是
溶液1mL加水稀释至10mL,下列说法错误的是
 溶液1mL加水稀释至10mL,下列说法错误的是
溶液1mL加水稀释至10mL,下列说法错误的是A.稀释前溶液中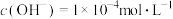 |
B.稀释后溶液中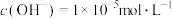 |
| C.加水过程中使水解平衡正向移动 |
D.加水过程中 逐渐减小 逐渐减小 |
您最近半年使用:0次
2023-04-22更新
|
391次组卷
|
4卷引用:四川省泸州市2022-2023学年高二上学期期末考试化学试题
四川省泸州市2022-2023学年高二上学期期末考试化学试题(已下线)专题07 盐类水解-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)课时2影响盐类水解的主要因素课堂例题(已下线)寒假收官卷01-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
9 . 硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体(CuSO4·xH2O)在不同温度下会逐步失去结晶水甚至分解。某小组对硫酸铜晶体性质进行探究,回答下列问题:
[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:
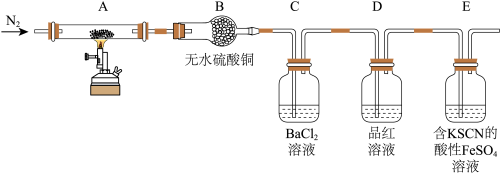
观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为_______ ,C、D两装置位置_______ (填“ 能”或“不能”)交换。
(2)C中产生的沉淀的化学式为_______ ,E中Fe2+发生反应的离子方程式为______ 。
(3)该实验设计的不足之处是_______ 。
[探究二]测定硫酸铜晶体中结晶水含量
实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
(4)步骤①酸A应该选择_______ ( 填“稀盐酸”或者“稀硫酸”),滴加酸A的目的是______ 。
(5)步骤②检验沉淀是否洗涤干净的方法是_______ 。
(6)根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x=_______ (用含 m、a的代数式表示)。
[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:

观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为
(2)C中产生的沉淀的化学式为
(3)该实验设计的不足之处是
[探究二]测定硫酸铜晶体中结晶水含量
实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
(4)步骤①酸A应该选择
(5)步骤②检验沉淀是否洗涤干净的方法是
(6)根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x=
您最近半年使用:0次
2023-03-22更新
|
372次组卷
|
3卷引用:四川省泸州市四川省泸县第五中学2023-2024学年高二上学期1月期末化学试题
名校
10 . 常温下,下列关于电解质溶液的说法不正确的是
| A.加水稀释稀醋酸溶液过程中,醋酸的电离平衡正向移动,电离度增大,电离平衡常数不变 |
B.pH=3的 溶液和pH=11的 溶液和pH=11的 溶液等体积混合后显酸性 溶液等体积混合后显酸性 |
C.配制 溶液时,先将 溶液时,先将 固体溶于适量浓硝酸中,再用蒸馏水稀释 固体溶于适量浓硝酸中,再用蒸馏水稀释 |
D.若向 溶液中加入少量 溶液中加入少量 ,则溶液中 ,则溶液中 减小 减小 |
您最近半年使用:0次



