下列溶液中各离子的物质的量浓度关系正确的是
A. 溶液中:滴加几滴稀盐酸, 溶液中:滴加几滴稀盐酸, 增大 增大 |
B.饱和小苏打溶液中: |
C. 与 与 混合溶液呈酸性: 混合溶液呈酸性: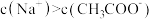 |
D. 时, 时, 的纯碱溶液: 的纯碱溶液: |
更新时间:2024-03-03 08:59:26
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向1mol•L-1NH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。验观察到b点开始溶液中有白色沉淀生成,已知Ksp[Mg(OH)2]=1.8×10-11。下列说法错误的是


| A.常温下,NH4Cl的水解平衡常数数量级为10-10 |
| B.体系中,水的电离程度大小关系为a>c>b |
| C.b点时,溶液中c(Mg2+)=0.18mol∙L-1 |
D.a点溶液中,c( )+c(H+)<c(Cl-)+c(OH-) )+c(H+)<c(Cl-)+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃下,电离平衡常数Ka(CH3COOH) = Kb(NH3•H2O) = 1.75×10-5,下列说法正确的是( )
| A.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂 |
| B.0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c(H+) |
| C.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中c(OH -) > c(H+) |
| D.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的c(H+)=1×10-7mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】四种酸在25℃的电离平衡常数:①H2CO3:K1=4.30×10-7 ②H3AsO4:K1=6.30×10-3③CH3COOH:K=1.75×10-5 ④HF:K=3.53×10-4 ,以下说法正确的是
| A.若四种酸的浓度均为0.1mol/L,则c(H+)的大小顺序:H3AsO4 > H2CO3 > HF > CH3COOH |
| B.当H3AsO4与足量Na2CO3反应时,一定生成CO2和H2O |
| C.等体积、等浓度的四种酸,中和碱的能力为:H3AsO4 > H2CO3 > HF > CH3COOH |
| D.等体积、等浓度的四种酸溶液中,由水电离出来的c(H+)的大小顺序为:H2CO3 >CH3COOH>HF>H3AsO4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的PH与离子浓度变化关系如图所示,下列说法不正确的是( )


| A.0.1mol/L的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+) |
B.L1表示-lg 与pH的变化关系 与pH的变化关系 |
| C.Kb(YOH)=10-10.5 |
| D.a点时两溶液中水的电离程度不相同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,分别在 、
、 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 与pH关系如图所示。已知:X代表
与pH关系如图所示。已知:X代表 、
、 、
、 、
、 ;
;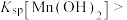
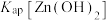 。下列叙述正确的是
。下列叙述正确的是
 、
、 、
、 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 与pH关系如图所示。已知:X代表
与pH关系如图所示。已知:X代表 、
、 、
、 、
、 ;
;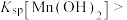
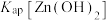 。下列叙述正确的是
。下列叙述正确的是
A.图中曲线 代表 代表 , , 代表 代表 |
B.室温下,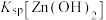 的数量级为 的数量级为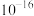 |
C.a点对应的溶液中: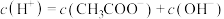 |
D.反应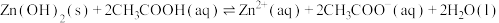 的平衡常数K的值为 的平衡常数K的值为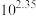 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,用 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和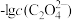 的关系如图所示,已知:
的关系如图所示,已知: 的电离平衡常数
的电离平衡常数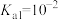 ,下列说法错误的是
,下列说法错误的是

 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和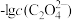 的关系如图所示,已知:
的关系如图所示,已知: 的电离平衡常数
的电离平衡常数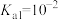 ,下列说法错误的是
,下列说法错误的是
A.常温下, 的电离平衡常数 的电离平衡常数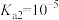 |
B. 溶液呈酸性 溶液呈酸性 |
C.滴定过程中,当 时, 时,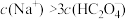 |
D.滴定过程中, 不变 不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】在25 ℃时,在50 mL 0.1 mol·L-1的盐酸中逐滴加入0.2 mol·L-1的氨水,溶液pH随所加氨水的体积变化曲线如图。下列说法正确的是


A.在A、B之间任意一点都满足:c(Cl-)>c(NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.在B点:a>25,且c(Cl-)=c(NH )=c(H+)=c(OH-) )=c(H+)=c(OH-) |
C.在C点:c(Cl-)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
| D.在D点:c(OH-)+c(NH3·H2O)=c(Cl-)+c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】实验室使用pH传感器来测定某Na2A和NaHA混合溶液中NaHA的含量。用0.1mol·L-1盐酸滴定该混合溶液,得到如下曲线。以下说法不正确的是


| A.该混合溶液中Na2A和NaHA的浓度之比为1:2 |
| B.滴加10mL盐酸时:2c(Cl-)=c(H2A)+c(HA-)+c(A2-) |
| C.滴加30 mL盐酸时:c(Na+)=c(Cl-)>c(H2A) >c(H+)>c(HA-)>c(OH-) |
| D.若将等浓度的H2A和Na2A溶液混合,溶液可能显酸性 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】已知25℃,Ksp (CaC2O4)=4.0×10-8,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=1.5×10-4;Ksp(CaCO3)=3.4×10-9,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。下列有关说法正确的是
| A.25℃时,同浓度的NaHC2O4溶液的pH比NaHCO3大 |
| B.用0.5mol/L的草酸钠溶液浸泡CaCO3,可实现CaCO3完全转化为CaC2O4 |
| C.某温度下,向含CaC2O4固体的饱和CaC2O4溶液中加入少量草酸钠固体,则CaC2O4溶解性将减小 |
D.过量CaCO3溶于水达到溶解平衡,其上层清液中含碳微粒主要是CO |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】20℃时,0.1 mol • L-1 NH4Al(SO4)2溶液的pH随温度变化的关系如曲线Ⅰ所示,下列说法中正确的是
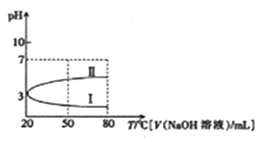
| A.0.1mol·L-1的NH4Al(SO4)2溶液中c(NH4+)大于等浓度的NH4HSO4溶液中的c(NH4+) |
| B.0.1mol·L-1的NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol·L-1 |
| C.向100mL0.1mol·L-1的NH4Al(SO4)2溶液中逐渐滴加80mL0.05mol·L-1NaOH溶液时,溶液pH的变化如曲线Ⅱ |
| D.升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法或表不方法正确的是
| A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(1) △H;若将0.5molH2SO4的浓硫酸与含1 molNaOH的溶液混合的反应热大于△H |
| B.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9KJ/mol, 该反应是吸热反应,因此一定不能自发进行 |
| C.只含NH4+、Cl-、H+、OH-四种离子的溶液中离子浓度可能满足: c(Cl-)>c(H+)> c(NH4+)>c(OH-) |
| D.降低温度和加水稀释,都会使NH4Cl 溶液中c(H+)变小,水解平衡向逆方向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】常温下,CH3COONa溶液和NaHCO3溶液的浓度与pH的关系如图所示。已知a为CH3COONa溶液和NaHCO3溶液的交点。下列说法错误的是
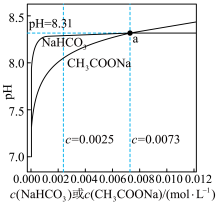
| A.c(NaHCO3)>0.0025mol·L-1时,其溶液的pH基本不变 |
| B.浓度越大CH3COONa溶液的碱性越强,是因为CH3COONa的水解程度随浓度的增大而增大 |
| C.a点CH3COONa溶液中的c(CH3COOH)小于NaHCO3溶液中的c(H2CO3) |
D.0.01mol·L-1的NaHCO3溶液中,满足c(Na+)>c( )>c(H2CO3)>c( )>c(H2CO3)>c( ) ) |
您最近一年使用:0次



