微专题(9) 利用图像判断溶液粒子浓度关系
全国
高二
课后作业
2023-08-14
325次
整体难度:
适中
考查范围:
化学反应原理
微专题(9) 利用图像判断溶液粒子浓度关系
全国
高二
课后作业
2023-08-14
325次
整体难度:
适中
考查范围:
化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 常温下,HB的电离常数Ka=1.0×10−6,向20 mL 0.01 mol·L−1的HB溶液中逐滴加入0.01 mol·L−1的NaOH溶液,溶液的pH与加入V(NaOH)之间的关系如下图所示,下列说法正确的是


| A.a点对应溶液的pH约为4,且溶液中只存在HB的电离平衡 |
| B.b点对应的溶液中存在:c(OH−)−c(H+)=c(B−) |
| C.d点对应的溶液中存在:c(Na+)>c(B−)>c(OH−)>c(H+) |
| D.a、b、c、d四点中c点溶液中水的电离程度最大 |
您最近一年使用:0次
2018-06-09更新
|
312次组卷
|
5卷引用:2018年5月14日 押高考化学第13题(1)——《每日一题》2018年高三化学四轮复习
(已下线)2018年5月14日 押高考化学第13题(1)——《每日一题》2018年高三化学四轮复习黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二下学期开学考试化学试题微专题(9) 利用图像判断溶液粒子浓度关系 四川省成都市第八中学校2023-2024学年高二上学期第二次月考化学试题河北省高碑店市崇德实验中学2023-2024学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
2. 已知H2A为二元弱酸,25℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随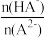 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

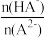 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是
| A.NaHA溶液中:c(H+)>c(OH-) | B.Na2A溶液中:c(A2-)>c(HA-) |
| C.H2A的第二步电离常数为10-7.2 | D.当吸收液呈中性时:c(Na+)=c(A2-)+c(HA-) |
您最近一年使用:0次
2022-09-22更新
|
504次组卷
|
8卷引用:湖南H11教育联盟2018年1月高三联考化学试题
湖南H11教育联盟2018年1月高三联考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系选择性必修1(SJ)专题3第三单元课时3 溶液中粒子浓度的大小关系山东省济南黄河双语实验学校2021-2022学年高二上学期期中考试化学试题3.3.3盐类水解的应用 课后(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)微专题(9) 利用图像判断溶液粒子浓度关系
单选题
|
适中(0.65)
名校
3. 常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )


A.常温下,0.1 mol·L-1氨水中 的电离常数 的电离常数 约为 约为 |
B.a、b之间的点一定满足:c(NH )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
C.c点溶液中c(NH )<c(Cl-) )<c(Cl-) |
| D.b点代表溶液呈中性 |
您最近一年使用:0次
2019-06-03更新
|
1164次组卷
|
5卷引用:甘肃省定西市陇西县第一中学2019届高三下学期适应性训练化学试题
甘肃省定西市陇西县第一中学2019届高三下学期适应性训练化学试题(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编浙江省温州市平阳中学2020届高三下学期“居家考试”化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第二次高考适应性考试理综化学试题微专题(9) 利用图像判断溶液粒子浓度关系
单选题
|
适中(0.65)
名校
解题方法
4. 用 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是

 溶液分别滴定溶液体积均为20.00mL的
溶液分别滴定溶液体积均为20.00mL的 醋酸溶液和
醋酸溶液和 草酸
草酸 溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列叙述正确的是
A.X曲线代表草酸,Y曲线代表醋酸, |
B.醋酸溶液在滴定过程中始终有 |
C.若b点时 ,则b点溶液中 ,则b点溶液中 |
D.若a点 ,则a点有 ,则a点有 |
您最近一年使用:0次
2022-09-06更新
|
684次组卷
|
6卷引用:安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题
单选题
|
适中(0.65)
5. 常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序正确的是


| A.c(Na+)+c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) |
| B.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A) |
| C.c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) |
| D.c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
【知识点】 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
单选题
|
较难(0.4)
6. 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、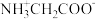 和
和 的分布分数【如
的分布分数【如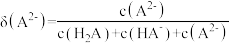 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、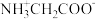 和
和 的分布分数【如
的分布分数【如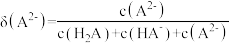 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是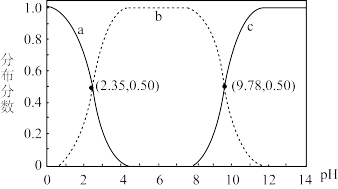
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.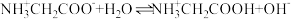 的平衡常数 的平衡常数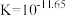 |
D.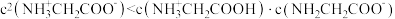 |
您最近一年使用:0次
2022-07-06更新
|
12597次组卷
|
32卷引用:专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编
(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第二中学2022-2023学年高三上学期12月考化学试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题
单选题
|
较难(0.4)
解题方法
7. 向NaOH溶液中缓慢通入 气体,溶液中
气体,溶液中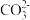 的物质的量与通入
的物质的量与通入 的物质的量的关系如图。下列说法错误的是
的物质的量的关系如图。下列说法错误的是

 气体,溶液中
气体,溶液中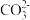 的物质的量与通入
的物质的量与通入 的物质的量的关系如图。下列说法错误的是
的物质的量的关系如图。下列说法错误的是
A.水的电离程度: |
B.a、b两点溶液的pH满足: |
C.c点溶液满足: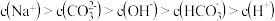 |
D.a、b、c三点溶液都满足: |
您最近一年使用:0次
2020-02-07更新
|
282次组卷
|
3卷引用:夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——电解质溶液中的曲线问题(强化练习)
试卷分析
整体难度:适中
考查范围:化学反应原理
试卷题型(共 7题)
题型
数量
单选题
7
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 影响水电离的因素 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 2 | 0.65 | 弱电解质在水溶液中的电离平衡 盐类水解规律理解及应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 3 | 0.65 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 4 | 0.65 | 弱电解质在水溶液中的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 5 | 0.65 | 盐溶液中离子浓度大小的比较 | |
| 6 | 0.4 | 化学平衡常数的影响因素及应用 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 7 | 0.4 | 影响水电离的因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |



