1 . 根据抑制癌细胞增殖药物的恩杂鲁胺 的两条合成路线,回答下列问题。
的两条合成路线,回答下列问题。
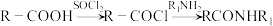 ;
;②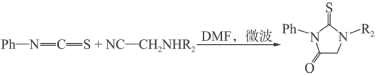 。
。
(2)
 反应的化学方程式为
反应的化学方程式为路线二:
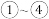 中仅发生取代反应的是
中仅发生取代反应的是
您最近一年使用:0次
2 . 有机物K是一种可用于肺癌治疗的药物。其一条合成路线如下: 。
。
回答下列问题:
(1)A的结构简式为___________ ,J中含氧官能团名称为___________ 。
(2)E与NaOH溶液反应的化学方程式为___________ 。
(3)反应①→⑤中属于取代反应的有___________ 个。
(4)设计A→B、C→D的目的是___________ 。
(5)符合下列条件的F的同分异构体有___________ 种,其中一种结构简式为___________ 。
(6)参照以上合成路线,以 为原料设计
为原料设计 的合成路线
的合成路线___________ 。

ⅰ.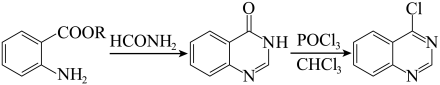 (R为烃基,下同)
(R为烃基,下同)
 。
。回答下列问题:
(1)A的结构简式为
(2)E与NaOH溶液反应的化学方程式为
(3)反应①→⑤中属于取代反应的有
(4)设计A→B、C→D的目的是
(5)符合下列条件的F的同分异构体有
①属于芳香族化合物,且不含有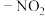 、
、 、
、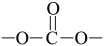 ;
;
(6)参照以上合成路线,以
 为原料设计
为原料设计 的合成路线
的合成路线
您最近一年使用:0次
名校
3 . 回答下列问题
(1)下列反应中,属于吸热反应的是___________ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥ 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol 过程中放出46kJ的热量。则
过程中放出46kJ的热量。则 的键能为
的键能为__________ kJ/mol。
(3)工业上可以通过 (g)与
(g)与 (g)反应制备
(g)反应制备 (g):
(g):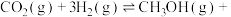
 △H<0
△H<0
①保持温度不变,向2L恒容密闭容器中充入2mol 和6mol
和6mol  ,能说明该反应已达平衡状态的是(填字母)
,能说明该反应已达平衡状态的是(填字母)__________ 。
a.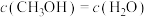 b.容器内压强保持不变
b.容器内压强保持不变
c.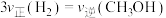
②在2L恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
0~5min内的平均反应速率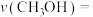
______ ;反应达平衡时,
_______ 。
③向恒容密闭容器中充入一定量 和
和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态), 的转化率随反应温度的变化如图所示。其中a点
的转化率随反应温度的变化如图所示。其中a点 的转化率高于b点的原因是
的转化率高于b点的原因是________________________ 。
(1)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥
 与
与 反应 ⑦铁粉与稀盐酸反应
反应 ⑦铁粉与稀盐酸反应(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol
 过程中放出46kJ的热量。则
过程中放出46kJ的热量。则 的键能为
的键能为(3)工业上可以通过
 (g)与
(g)与 (g)反应制备
(g)反应制备 (g):
(g):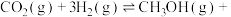
 △H<0
△H<0①保持温度不变,向2L恒容密闭容器中充入2mol
 和6mol
和6mol  ,能说明该反应已达平衡状态的是(填字母)
,能说明该反应已达平衡状态的是(填字母)a.
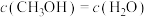 b.容器内压强保持不变
b.容器内压强保持不变c.
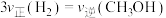
②在2L恒容密闭容器中,反应过程中反应物和生成物的物质的量数据见下表:
反应时间 |
|
|
|
0min | 2 | 6 | 0 |
5min | 1 | ||
15min | 1.5 | ||
20min | 1.5 |
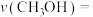

③向恒容密闭容器中充入一定量
 和
和 ,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态),
,在不同催化剂作用下合成甲醇,反应进行相同时间后(均未达到化学平衡状态), 的转化率随反应温度的变化如图所示。其中a点
的转化率随反应温度的变化如图所示。其中a点 的转化率高于b点的原因是
的转化率高于b点的原因是
您最近一年使用:0次
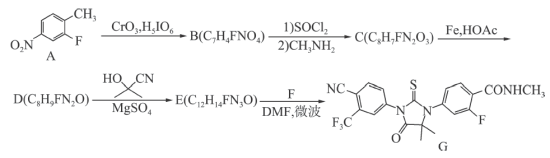
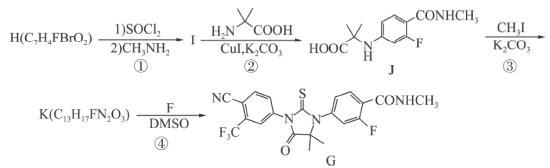
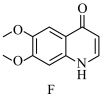
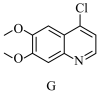
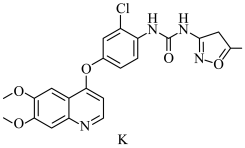
4 . 一水合盐酸替沃扎尼盐是一种治疗肾癌的小分子靶向新药。根据替沃扎尼(K)的两种合成路线,回答下列问题:
已知:
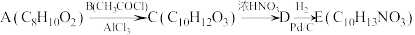
___________ ;D的结构简式为___________ 。
(2)G→I的化学方程式为___________ 。
路线二:
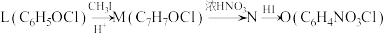
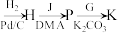
(3)设计L→M和N→O的目的是___________ ,P→K的反应类型为___________ 。
(4)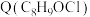 为M的同系物,满足下列条件的Q的同分异构体有
为M的同系物,满足下列条件的Q的同分异构体有___________ 种。
①遇 溶液显紫色 ②苯环上有3个取代基
溶液显紫色 ②苯环上有3个取代基
(5)根据上述信息,写出以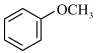 和丙酮为主要原料,合成
和丙酮为主要原料,合成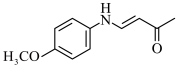 的路线
的路线___________ 。
已知:
Ⅰ.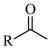
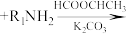
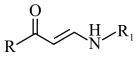
Ⅱ.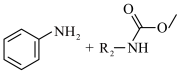
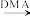
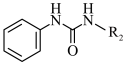
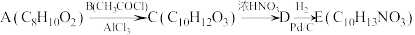
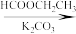
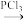
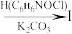
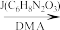
(2)G→I的化学方程式为
路线二:
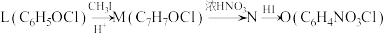
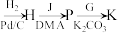
(3)设计L→M和N→O的目的是
(4)
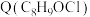 为M的同系物,满足下列条件的Q的同分异构体有
为M的同系物,满足下列条件的Q的同分异构体有①遇
 溶液显紫色 ②苯环上有3个取代基
溶液显紫色 ②苯环上有3个取代基(5)根据上述信息,写出以
 和丙酮为主要原料,合成
和丙酮为主要原料,合成 的路线
的路线
您最近一年使用:0次
解题方法
5 . 利用 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。
Ⅰ.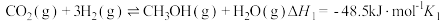
Ⅱ.
回答下列问题:
(1)已知反应Ⅲ的平衡常数 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式___________ 。
(2)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是___________ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是___________ 。
②生成 的最佳条件是
的最佳条件是___________ (填标号)。


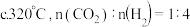

(3)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为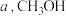 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数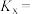
___________ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
(4)向压强恒为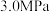 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气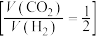 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是___________ 。
② 时,
时, 的平均反应速率
的平均反应速率
___________  。
。
③反应Ⅰ的速率方程可表示为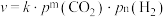 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,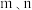 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则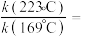
___________ 。
 为原料合成
为原料合成 的主要反应如下。
的主要反应如下。Ⅰ.
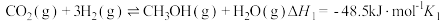
Ⅱ.

回答下列问题:
(1)已知反应Ⅲ的平衡常数
 ,写出反应Ⅲ的热化学方程式
,写出反应Ⅲ的热化学方程式(2)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性
选择性 随温度、投料比的变化曲线如图所示。
随温度、投料比的变化曲线如图所示。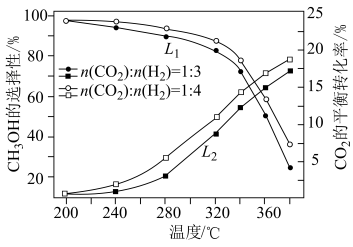
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是


(3)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为
平衡转化率为 选择性为
选择性为 ,该温度下反应Ⅰ的平衡常数
,该温度下反应Ⅰ的平衡常数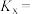
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。(4)向压强恒为
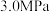 的密闭容器中通入反应混合气
的密闭容器中通入反应混合气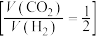 ,在
,在 催化作用下只发生反应Ⅰ,测得
催化作用下只发生反应Ⅰ,测得 时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
 时空收率随温度升高先增大后减小的原因是
时空收率随温度升高先增大后减小的原因是②
 时,
时, 的平均反应速率
的平均反应速率
 。
。③反应Ⅰ的速率方程可表示为
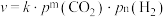 ,其中
,其中 为速率常数,
为速率常数, (单位:
(单位: )为各物质的起始分压,
)为各物质的起始分压,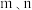 分别为
分别为 的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由
的反应级数。实验结果表明速率常数与反应级数均受温度影响,当反应温度由 升高到
升高到 ,则
,则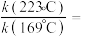
您最近一年使用:0次
6 . 甲烷蒸汽重整是制氢的主要途径,涉及反应如下:
反应Ⅰ:

反应Ⅱ:
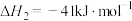
回答下列问题:
(1)标准摩尔生成焓( )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的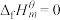 。根据下表数据计算a=
。根据下表数据计算a=________ 。
(2)向恒容密闭容器中按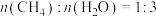 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。________ 。
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是________ 。
③600℃时, 的平衡转化率为
的平衡转化率为________ (保留两位有效数字),反应Ⅱ的
________ 。
(3)镍基复合催化剂可作为 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。
①在催化剂(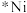 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。
a.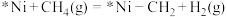
b.________
c.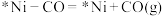
d.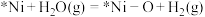
e.
补充b反应的方程式:________ 。
②镍基复合催化剂可吸收部分 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按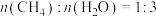 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
________ (用含 、p的表达式表示)。
、p的表达式表示)。
反应Ⅰ:


反应Ⅱ:

回答下列问题:
(1)标准摩尔生成焓(
 )是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的
)是指标准状态下,由稳定的单质生成1mol该物质的焓变。稳定单质的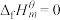 。根据下表数据计算a=
。根据下表数据计算a=物质 |
|
|
|
| -74.8 | -110.5 | -241.8 |
(2)向恒容密闭容器中按
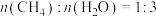 投料,初始总压强为
投料,初始总压强为 ,测得平衡时各组分的物质的量分数与温度的关系如图所示。
,测得平衡时各组分的物质的量分数与温度的关系如图所示。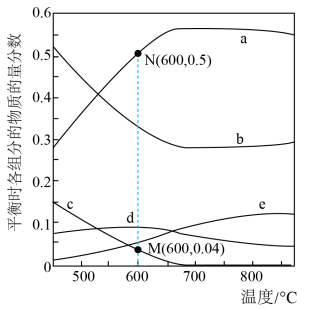
②温度低于600℃时,d的物质的量分数随温度升高而增大,原因是
③600℃时,
 的平衡转化率为
的平衡转化率为
(3)镍基复合催化剂可作为
 重整的催化剂和
重整的催化剂和 吸收剂。
吸收剂。①在催化剂(
 )表面
)表面 和
和 发生反应,生成CO、
发生反应,生成CO、 和
和 的反应机理如下。
的反应机理如下。a.
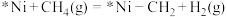
b.________
c.
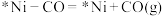
d.
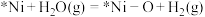
e.

补充b反应的方程式:
②镍基复合催化剂可吸收部分
 。某温度下,向恒容密闭容器中按
。某温度下,向恒容密闭容器中按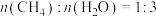 投料,初始总压强为
投料,初始总压强为 ,平衡后总压强为p,
,平衡后总压强为p, 的转化率为50%,
的转化率为50%, 。则
。则
 、p的表达式表示)。
、p的表达式表示)。
您最近一年使用:0次
2024-05-28更新
|
214次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
7 . 常温下,用盐酸调节草酸钡(用 表示)浊液的
表示)浊液的 ,测得溶液中
,测得溶液中 [
[ 为
为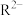 、
、 或
或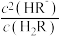 ]随
]随 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
 表示)浊液的
表示)浊液的 ,测得溶液中
,测得溶液中 [
[ 为
为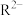 、
、 或
或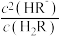 ]随
]随 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是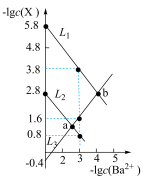
A.曲线 表示 表示 与 与 变化曲线 变化曲线 |
B.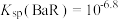 |
C. 点溶液中: 点溶液中: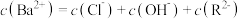 |
D. 点溶液中: 点溶液中: |
您最近一年使用:0次
解题方法
8 . 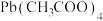 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为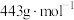 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有:
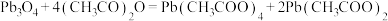
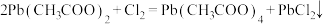
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为_______ 。
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是_______ 。
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为_______ (填仪器接口的小写字母),干燥管中碱石灰的作用是_______ ,步骤Ⅲ中,现象1为_______ 。 ,实验结束理论上可生成
,实验结束理论上可生成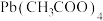 质量为
质量为_______ 。
(5)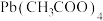 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是_______ ,实验前后,干燥管I质量增加 ,则样品的纯度为
,则样品的纯度为_______ 。
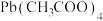 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为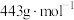 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有: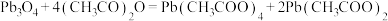
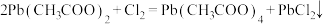
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入
 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到
 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为

 ,实验结束理论上可生成
,实验结束理论上可生成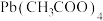 质量为
质量为(5)
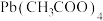 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是 ,则样品的纯度为
,则样品的纯度为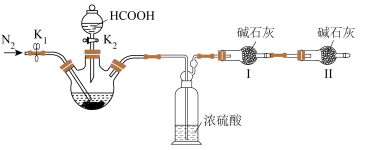
您最近一年使用:0次
9 . 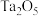 和
和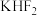 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数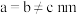 ,
, ,
, 键键长为
键键长为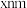 。下列说法错误的是
。下列说法错误的是
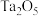 和
和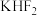 按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数
按计量比混合,一定条件下,获得晶体产物的晶胞结构如图所示,晶胞参数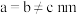 ,
, ,
, 键键长为
键键长为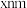 。下列说法错误的是
。下列说法错误的是
A.制备晶体的化学方程式: |
B.O原子分数坐标可能为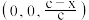 , ,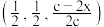 |
C.与棱心 等距且紧邻的 等距且紧邻的 有8个 有8个 |
D.该晶体密度为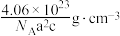 |
您最近一年使用:0次
解题方法
10 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: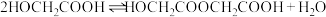
n聚: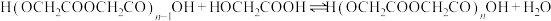
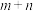 聚:
聚: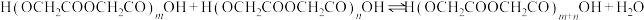 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1) 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中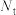 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,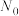 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则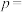
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
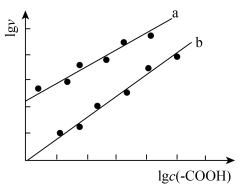
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为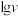 与
与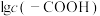 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.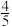 D.
D.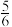
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
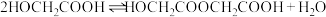
n聚:
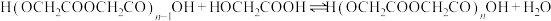
 聚:
聚: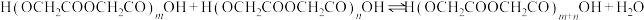 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中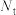 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,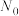 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则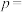
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为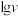 与
与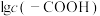 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.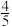 D.
D.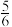
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次






