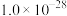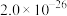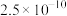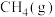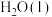名校
1 . 草酸常用于稀土加工分离过程,其含草酸根离子废水多用钙离子处理,研究在不同pH下草酸钙存在形态,对污水处理具有指导性意义。以下为足量草酸钙固体与水混合体系,加HCl或NaOH调节pH过程中溶质各微粒浓度 随pH变化曲线,已知:草酸钙的
随pH变化曲线,已知:草酸钙的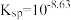 。下列说法正确的是
。下列说法正确的是
 随pH变化曲线,已知:草酸钙的
随pH变化曲线,已知:草酸钙的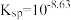 。下列说法正确的是
。下列说法正确的是
A. 的 的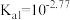 |
B.pH=2.77时,溶液中 的浓度等于 的浓度等于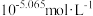 |
C.用 处理草酸根离子废水,应控制溶液pH大约在5~11区间内 处理草酸根离子废水,应控制溶液pH大约在5~11区间内 |
| D.pH=13.81以后,草酸分子浓度保持不变 |
您最近一年使用:0次
2 . 氮化钒(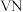 )作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。
)作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。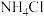 溶液与
溶液与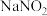 溶液反应制取
溶液反应制取 。
。
(1)检验装置的气密性方法是___________ 。
(2)制备氮化钒的一种方法为将 先用碳还原后再氮化,此法需将
先用碳还原后再氮化,此法需将 与焦炭混合放入石英管,关闭
与焦炭混合放入石英管,关闭___________ (填开关代号,下同),打开___________ 和真空泵,加热热电偶。
(3)氮化反应为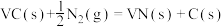 ,
,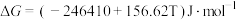 ,则此反应能自发进行的上限温度(反应截止温度)为
,则此反应能自发进行的上限温度(反应截止温度)为___________ K(T的单位为K)。氮化过程中,反应截止温度 还受氮气分压的影响,其影响如下图,则
还受氮气分压的影响,其影响如下图,则___________ (填“增大”或“减小”)氮气分压有利于氮化反应进行。 热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的
热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的 与
与 的物质的量比为3:1,则装置C中反应的化学方程式为
的物质的量比为3:1,则装置C中反应的化学方程式为___________ ,每生成 氮化钒,转移电子
氮化钒,转移电子___________  。
。
(5)向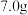 所得
所得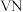 中加入足量
中加入足量 溶液,将产生的
溶液,将产生的 用
用 1mol/L
1mol/L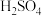 溶液恰好完全吸收生成正盐,则所得产品中
溶液恰好完全吸收生成正盐,则所得产品中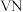 的质量分数为
的质量分数为___________ (结果保留三位有效数字)。
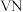 )作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。
)作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。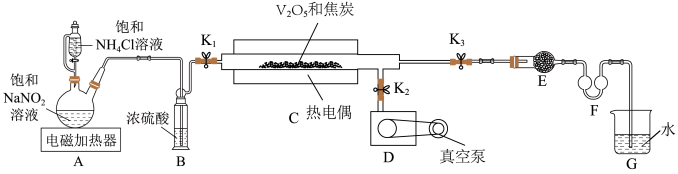
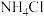 溶液与
溶液与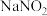 溶液反应制取
溶液反应制取 。
。(1)检验装置的气密性方法是
(2)制备氮化钒的一种方法为将
 先用碳还原后再氮化,此法需将
先用碳还原后再氮化,此法需将 与焦炭混合放入石英管,关闭
与焦炭混合放入石英管,关闭(3)氮化反应为
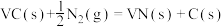 ,
,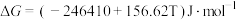 ,则此反应能自发进行的上限温度(反应截止温度)为
,则此反应能自发进行的上限温度(反应截止温度)为 还受氮气分压的影响,其影响如下图,则
还受氮气分压的影响,其影响如下图,则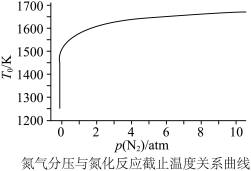
 热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的
热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的 与
与 的物质的量比为3:1,则装置C中反应的化学方程式为
的物质的量比为3:1,则装置C中反应的化学方程式为 氮化钒,转移电子
氮化钒,转移电子 。
。(5)向
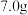 所得
所得 中加入足量
中加入足量 溶液,将产生的
溶液,将产生的 用
用 1mol/L
1mol/L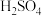 溶液恰好完全吸收生成正盐,则所得产品中
溶液恰好完全吸收生成正盐,则所得产品中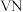 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
3 . 锰锌铁氧体是一种典型的软磁材料,广泛应用于电子,通讯等领域,主要成分是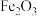 、
、 、
、 ,由黄钾铁矾渣(主要成分为
,由黄钾铁矾渣(主要成分为 ,还含有
,还含有 ,
, ,
, 、
、 、
、 、
、 等硫酸盐及
等硫酸盐及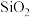 ]制备锰锌铁氧体的流程如图。
]制备锰锌铁氧体的流程如图。
(1)“酸浸”后,浸渣的主要成分有___________ (填化学式),能提高浸出率的措施有___________ (任写两点即可)。
(2)加入铁粉时,反应温度对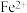 浓度的影响如图,反应的最佳温度为
浓度的影响如图,反应的最佳温度为___________ 。___________ 。
(4)“除铜、镉”中,最先沉淀的离子是___________ (填离子符号),若要将溶液中的铜和镉完全沉淀,溶液中的 不低于
不低于___________ mol/L。
(5)若锰锌铁氧体中金属元素理论质量配比为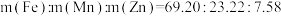 ,若调节成分前溶液中
,若调节成分前溶液中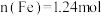 ,
, ,则应加入的
,则应加入的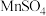 质量为
质量为___________ g。
(6)若以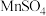 代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
代表溶液成分,则“共沉反应”中,发生反应的离子方程式为___________ 。
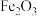 、
、 、
、 ,由黄钾铁矾渣(主要成分为
,由黄钾铁矾渣(主要成分为 ,还含有
,还含有 ,
, ,
, 、
、 、
、 、
、 等硫酸盐及
等硫酸盐及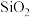 ]制备锰锌铁氧体的流程如图。
]制备锰锌铁氧体的流程如图。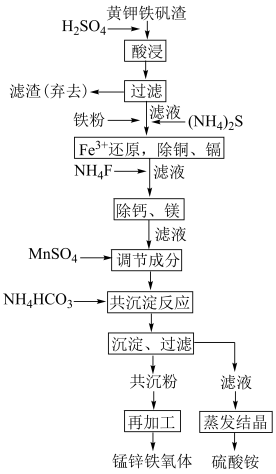
| 表1 有关离子沉淀的pH | |||||
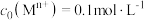 ( (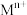 为金属离子) 为金属离子) | 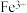 | 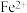 | 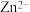 |  | 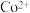 |
| 开始沉淀pH | 2.2 | 5.8 | 6.2 | 4.4 | 7.2 |
完全沉淀pH(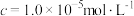 ) ) | 3.2 | 8.3 | 8.2 | 6.4 | 9.2 |
| 表2 物质的溶度积常数 | ||||
| 物质 |  |  |  |  |
 | 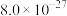 |  | 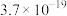 | 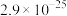 |
(1)“酸浸”后,浸渣的主要成分有
(2)加入铁粉时,反应温度对
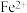 浓度的影响如图,反应的最佳温度为
浓度的影响如图,反应的最佳温度为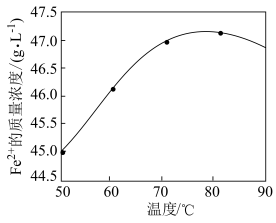
(4)“除铜、镉”中,最先沉淀的离子是
 不低于
不低于(5)若锰锌铁氧体中金属元素理论质量配比为
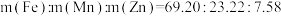 ,若调节成分前溶液中
,若调节成分前溶液中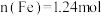 ,
, ,则应加入的
,则应加入的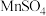 质量为
质量为(6)若以
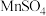 代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
代表溶液成分,则“共沉反应”中,发生反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 硼烷-四氢呋喃(BH3·THF,结构简式为)是一种硼氢化和还原性的试剂,易溶于四氢呋喃(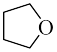 )、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
)、蚂水剧烈反应放出氢气 工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
A.1s22s22p1 B.1s22s2 C.1s22s12p1 D.1s22p2
(2)先将NaBH4和BF3溶于二乙二醇二甲醚(CH3OCH2CH2OCH2CH2OCH3)中,充分溶解,再加入四氢呋喃,反应30 min、缘分离提纯即得较纯净的 BH3·THF,同时还有另一种产物 NaF。
①制备BH3·THF的化学方程式为
②制备过程中,BF3中B的杂化方式的变化是
③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3GPa下转变为四方晶体(如图乙所示)。

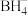 最近的
最近的 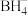 有
有 围成
围成②硼氢化钠的四方晶体中,晶胞中 A、B间距离d=
您最近一年使用:0次
解题方法
5 . 污染物的处理和资源的充分利用是化学重要的研究课题,工业上用化工厂尾气中低浓度 还原软锰矿(主要成分为
还原软锰矿(主要成分为 ,另含有少量铁、铝、铜、镍、铅等金属化合物)制备高性能磁性材料的主要原料
,另含有少量铁、铝、铜、镍、铅等金属化合物)制备高性能磁性材料的主要原料 的流程如下:
的流程如下: 即如下
即如下
② 难溶于水、乙醇,潮湿时易被空气氧化,
难溶于水、乙醇,潮湿时易被空气氧化, 时开始分解;
时开始分解;
③溶液中某离子的浓度 时,即可认为该离子已沉淀完全。
时,即可认为该离子已沉淀完全。
(1)为提高“还原酸浸”的效率,可以采取的措施有_______ (答出一条即可);上述流程多次涉及过滤操作,实验室进行过滤操作时需要用到的玻璃仪器有烧杯、_______ 。
(2)“还原酸浸”中所发生的最主要的氧化还原反应的离子方程式为_______ 。
(3)“除铁铝”时用 除去溶液中的
除去溶液中的 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。
(4)“除铜镍铅”时,为使它们完全沉淀,需控制溶液中 的浓度的最小值为
的浓度的最小值为_______  。
。
(5)“沉锰”反应的离子方程式为_______ 。
(6)“洗涤、干燥”中,为减少损失,宜选用的洗涤剂为_______ 。
 还原软锰矿(主要成分为
还原软锰矿(主要成分为 ,另含有少量铁、铝、铜、镍、铅等金属化合物)制备高性能磁性材料的主要原料
,另含有少量铁、铝、铜、镍、铅等金属化合物)制备高性能磁性材料的主要原料 的流程如下:
的流程如下: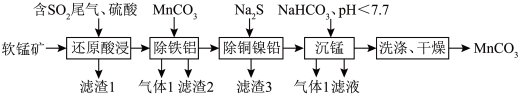
 即如下
即如下难溶物 |
|
|
|
|
|
|
|
|
|
 难溶于水、乙醇,潮湿时易被空气氧化,
难溶于水、乙醇,潮湿时易被空气氧化, 时开始分解;
时开始分解;③溶液中某离子的浓度
 时,即可认为该离子已沉淀完全。
时,即可认为该离子已沉淀完全。(1)为提高“还原酸浸”的效率,可以采取的措施有
(2)“还原酸浸”中所发生的最主要的氧化还原反应的离子方程式为
(3)“除铁铝”时用
 除去溶液中的
除去溶液中的 时发生反应的离子方程式为
时发生反应的离子方程式为(4)“除铜镍铅”时,为使它们完全沉淀,需控制溶液中
 的浓度的最小值为
的浓度的最小值为 。
。(5)“沉锰”反应的离子方程式为
(6)“洗涤、干燥”中,为减少损失,宜选用的洗涤剂为
您最近一年使用:0次
解题方法
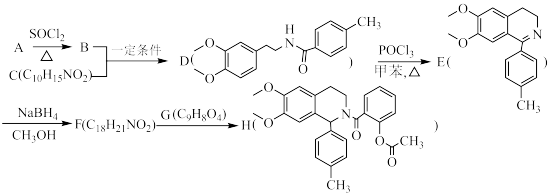
6 . 有机物H具有抑制血小板凝聚的作用,其合成路线如下: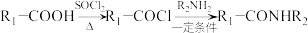
回答下列问题:
(1)A的化学名称为___________ ;B、C反应生成D的化学方程式为___________ 。
(2)D→E过程中,还可能生成一种与E互为同分异构体的副产物,该副产物的结构简式为___________ ;E→F的反应类型为___________ 。
(3)G中含氧官能团名称为_________ ;符合下列条件的G的同分异构体有________ 种。
①含有苯环且无其它环状结构②1mol有机物最多能与4molNaOH反应③含有四种不同化学环境的氢
(4)根据上述信息,写出以乙醛和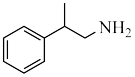 为主要原料制备
为主要原料制备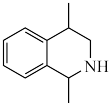 的合成路线
的合成路线_________ 。
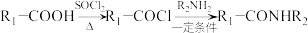
回答下列问题:
(1)A的化学名称为
(2)D→E过程中,还可能生成一种与E互为同分异构体的副产物,该副产物的结构简式为
(3)G中含氧官能团名称为
①含有苯环且无其它环状结构②1mol有机物最多能与4molNaOH反应③含有四种不同化学环境的氢
(4)根据上述信息,写出以乙醛和
 为主要原料制备
为主要原料制备 的合成路线
的合成路线
您最近一年使用:0次
7 . 氯化磷酸三钠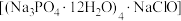 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为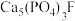 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
b.常温下 的
的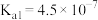 ,
,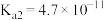 ;
; 。
。
c.常温下,磷酸中含磷微粒分布分数[如 的分布分数表示为
的分布分数表示为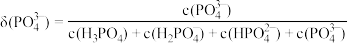 ]与pH的关系如下图所示:
]与pH的关系如下图所示:___________ 。
(2)常温下,“中和Ⅰ”应控制的pH约为___________ , 的
的
___________ 。
(3)“中和Ⅱ”不用 溶液,其原因是
溶液,其原因是___________ 。
(4)“合成”过程中两种溶液混合后需快速冷却,原因是___________ ;“系列操作”中包含“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,干燥时需控制温度不超过60℃的原因是___________ 。母液可以进入___________ (填操作单元名称)进行循环利用。
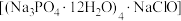 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为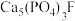 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题: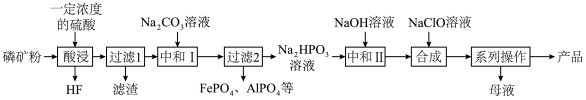
b.常温下
 的
的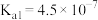 ,
,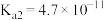 ;
; 。
。c.常温下,磷酸中含磷微粒分布分数[如
 的分布分数表示为
的分布分数表示为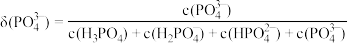 ]与pH的关系如下图所示:
]与pH的关系如下图所示: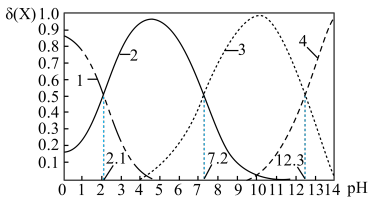
(2)常温下,“中和Ⅰ”应控制的pH约为
 的
的
(3)“中和Ⅱ”不用
 溶液,其原因是
溶液,其原因是(4)“合成”过程中两种溶液混合后需快速冷却,原因是
您最近一年使用:0次
解题方法
8 . 第二周期元素其单质及化合物具有一些特殊的化学性质。回答下列问题。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为_______ 。
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷( )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为_______ 。甲中化学键①为“二中心二电子键”,记作“2c-2e”,则乙硼烷的桥键②记作_______ 。氢原子仅用1s轨道就可形成桥键的原因为_______ 。_______ 。乙中由12个B与12个C构成的多面体含_______ 个棱。 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因_______ 。
(1)Li、Be、B三种元素第二电离能由大到小的顺序为
(2)由于硼的氢化物与烷烃相似,故又称之为硼烷。乙硼烷(
 )的分子结构如图,该分子中B原子的杂化方式为
)的分子结构如图,该分子中B原子的杂化方式为
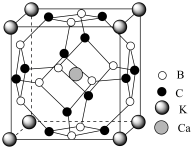
 溶解度(S=22g)大于
溶解度(S=22g)大于 (S=9.6g),从结构角度解释原因
(S=9.6g),从结构角度解释原因
您最近一年使用:0次
名校
9 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ:

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(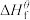 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: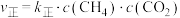 、
、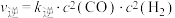 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
______  ,升高温度
,升高温度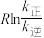 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,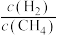 的值
的值______ (填“增大”“减小”或“不变”)。
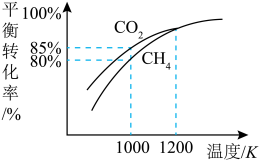
(5)在101kPa时,工业上按投料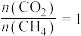 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:


回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
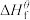 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
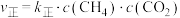 、
、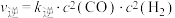 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
 ,升高温度
,升高温度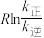 的值
的值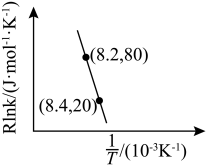
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为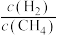 的值
的值(5)在101kPa时,工业上按投料
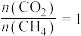 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2024-06-02更新
|
223次组卷
|
3卷引用:2024届山东省菏泽市高三下学期二模化学试题
名校
解题方法
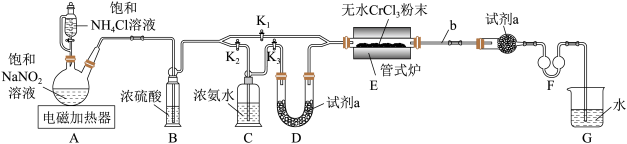
10 . 氮化铬(CrN)是一种耐磨性良好的新型材料,难溶于水。探究小组同学用下图所示装置(夹持装置略去)在实验室中制取氮化铬并测定所得氮化铬的纯度。 溶液与饱和
溶液与饱和 溶液反应制取
溶液反应制取 ;
; 易潮解,高温下易被氧气氧化;E中发生反应:
易潮解,高温下易被氧气氧化;E中发生反应: 。
。
(1)实验中 的作用是
的作用是___________ 。
(2)为保证反应顺利进行,开关 、
、 、
、 中,应首先打开
中,应首先打开___________ ,试剂a的名称是___________ 。
(3)盛放饱和 溶液的仪器叫“恒压滴液漏斗”,与普通分液漏斗相比,使用该仪器的好处是
溶液的仪器叫“恒压滴液漏斗”,与普通分液漏斗相比,使用该仪器的好处是___________ ;实验过程中需间歇性微热b处导管的目的是___________ 。
(4)向7.0g所得CrN中加入足量NaOH溶液,然后通入水蒸气将 全部蒸出,将
全部蒸出,将 用60mL
用60mL
 溶液完全吸收,剩余的
溶液完全吸收,剩余的 用10mL
用10mL NaOH溶液恰好中和,则所得产品中CrN的质量分数为
NaOH溶液恰好中和,则所得产品中CrN的质量分数为___________ (保留三位有效数字)。
 溶液与饱和
溶液与饱和 溶液反应制取
溶液反应制取 ;
; 易潮解,高温下易被氧气氧化;E中发生反应:
易潮解,高温下易被氧气氧化;E中发生反应: 。
。(1)实验中
 的作用是
的作用是(2)为保证反应顺利进行,开关
 、
、 、
、 中,应首先打开
中,应首先打开(3)盛放饱和
 溶液的仪器叫“恒压滴液漏斗”,与普通分液漏斗相比,使用该仪器的好处是
溶液的仪器叫“恒压滴液漏斗”,与普通分液漏斗相比,使用该仪器的好处是(4)向7.0g所得CrN中加入足量NaOH溶液,然后通入水蒸气将
 全部蒸出,将
全部蒸出,将 用60mL
用60mL
 溶液完全吸收,剩余的
溶液完全吸收,剩余的 用10mL
用10mL NaOH溶液恰好中和,则所得产品中CrN的质量分数为
NaOH溶液恰好中和,则所得产品中CrN的质量分数为
您最近一年使用:0次