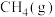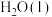还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:


回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
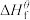 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
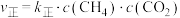 、
、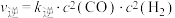 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能
 ,升高温度
,升高温度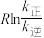 的值
的值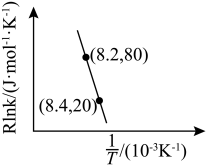
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为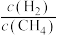 的值
的值(5)在101kPa时,工业上按投料
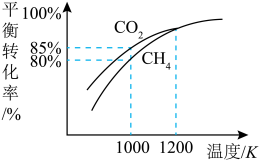
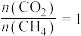 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
更新时间:2024-06-02 09:22:10
|
相似题推荐
【推荐1】随着氮氧化物对环境及人类活动影响的日趋严正,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一,
已知: 还原
还原 的主反应为
的主反应为

副反应为
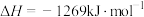 。
。
(1)则

___________ 。
(2)在某钒催化剂中添加一定量 可加快
可加快 的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物质未画出,X、Y处V元素的化合价为+4价或+5价)。
的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物质未画出,X、Y处V元素的化合价为+4价或+5价)。
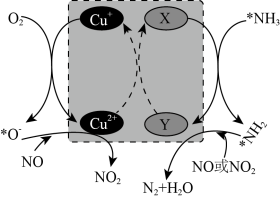
①X处V元素的化合价为___________ 价。
② 在催化剂
在催化剂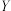 处发生的反应为
处发生的反应为___________ (不考虑钒元素参与反应)。
③烟气中杜绝含有 ,否则催化剂效率将严正下降,理由是
,否则催化剂效率将严正下降,理由是___________ 。
(3)氨气也可以直接还原 从而达到消除污染的目的,其原理为
从而达到消除污染的目的,其原理为
 ,已知该反应速率
,已知该反应速率 ,
,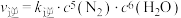 (
( 、
、 分别是正、逆反应速率常数),其他条件不变,升高温度,
分别是正、逆反应速率常数),其他条件不变,升高温度, 、
、 增大倍数:
增大倍数:
___________ (填“<”、“>”或“=”) 。
。
(4)电解硝酸工业的尾气 可制备
可制备 ,其工作原理如图所示。
,其工作原理如图所示。
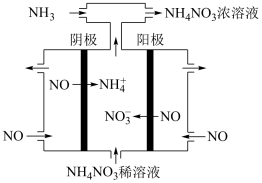
①阴极的电极反应式为___________ 。
②将电解生成的 全部转化为
全部转化为 ,则通入的
,则通入的 与实际参加反应的
与实际参加反应的 的物质的量之比至少为
的物质的量之比至少为___________ 。
已知:
 还原
还原 的主反应为
的主反应为

副反应为

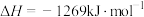 。
。(1)则


(2)在某钒催化剂中添加一定量
 可加快
可加快 的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物质未画出,X、Y处V元素的化合价为+4价或+5价)。
的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物质未画出,X、Y处V元素的化合价为+4价或+5价)。
①X处V元素的化合价为
②
 在催化剂
在催化剂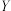 处发生的反应为
处发生的反应为③烟气中杜绝含有
 ,否则催化剂效率将严正下降,理由是
,否则催化剂效率将严正下降,理由是(3)氨气也可以直接还原
 从而达到消除污染的目的,其原理为
从而达到消除污染的目的,其原理为
 ,已知该反应速率
,已知该反应速率 ,
,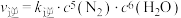 (
( 、
、 分别是正、逆反应速率常数),其他条件不变,升高温度,
分别是正、逆反应速率常数),其他条件不变,升高温度, 、
、 增大倍数:
增大倍数:
 。
。(4)电解硝酸工业的尾气
 可制备
可制备 ,其工作原理如图所示。
,其工作原理如图所示。
①阴极的电极反应式为
②将电解生成的
 全部转化为
全部转化为 ,则通入的
,则通入的 与实际参加反应的
与实际参加反应的 的物质的量之比至少为
的物质的量之比至少为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】I、(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为________ 。
②负极反应式为______________________________________ 。
③放电时NH 向
向________ (填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________ ,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________ (填序号)。
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
(1)H2O2的分解反应________ 氧化还原反应(填“是”或“不是”)。
(2)该分解反应0~20 min的平均反应速率v(H2O2)为________ mol/(L·min)。
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出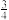 气体所需要的时间为
气体所需要的时间为________ ;A、B、C、D四点化学反应速率快慢的顺序为________ 。

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应: ④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________

①电池中电解质溶液为
②负极反应式为
③放电时NH
 向
向(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2
 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0~20 min的平均反应速率v(H2O2)为
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出
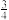 气体所需要的时间为
气体所需要的时间为
(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应: ④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。已知:CO(g)+2H2(g) CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
①5min时三个容器中的反应达到化学平衡状态的是容器_______ (填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______ 。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器___________ 。(填序号)
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是_____ (填字母)。
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
请写出加入(通入)a物质一极的电极反应式_________ ;每消耗6.4g甲醇转移的电子数为____ 。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________ 。
 CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。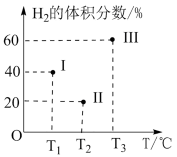
①5min时三个容器中的反应达到化学平衡状态的是容器
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg
 与温度(T)的关系如图所示。下列说法正确的是
与温度(T)的关系如图所示。下列说法正确的是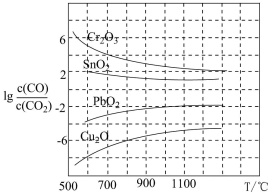
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)a物质一极的电极反应式
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,图示如下:

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
则反应Ⅰ的ΔH=_______ kJ/mol。反应Ⅲ的化学方程式为__________________ 。
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式_________ 。
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c( )为
)为________ [25℃,Ksp(NH4VO3) =1.6×10-3,溶液体积变化忽略不计]。
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体, 将
将_______ (填“变大”“不变”或“变小”)。
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =
=_______ (用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | 472 | 496 |
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(
 )为
)为(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,
 将
将②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】甲醇是重要的工业原料。
(1)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
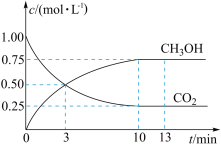
①T℃时,计算该反应的平衡常数为_______ (结果保留3位有效数字)。
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正_______ v逆(填“>”、“<”或=)。
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=_______ 。
(2)已知:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
(Ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1
(Ⅲ)2H2(g)+CO(g) CH3OH(g) △H3
CH3OH(g) △H3
①△H3=_______ kJ/mol。
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=________ (用K1、K2表示)。
(1)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
①T℃时,计算该反应的平衡常数为
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=
| 物质 | CO2 | H2 | CH3OH | H2O |
| 总键能/kJ•mol | 1620 | a | 2047 | 930 |
 CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1(Ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1(Ⅲ)2H2(g)+CO(g)
 CH3OH(g) △H3
CH3OH(g) △H3①△H3=
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________ 热量(填:“吸收”或“放出”) _______ kJ;事实上,反应的热量总小于理论值,理由是__________________________ 。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________ ;若XY2是共价化合物其结构式是____________ 。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________ 。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________ 。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb的量占总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq) HbH+(aq) ΔH1
HbH+(aq) ΔH1
Ⅱ.HbH+(aq)+O2(g) HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2
Ⅲ.Hb(aq)+O2(g) HbO2(aq) ΔH3
HbO2(aq) ΔH3
ΔH3 =_______ (用ΔH1、ΔH2表示),K3=_______ (用K1、K2表示)
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq) HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度a的关系如图1所示,pH=7.6时对应的曲线为
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度a的关系如图1所示,pH=7.6时对应的曲线为__________ (填“A”或“B”)。
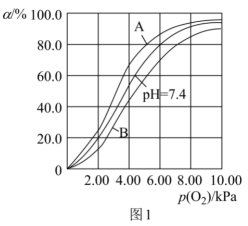
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g) MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
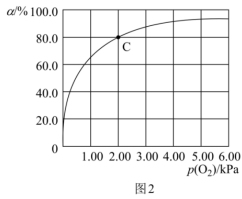
①已知Mb与氧气结合的平衡常数的表达式K= ,计算37 ℃时K=
,计算37 ℃时K=_______ kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为_______ (结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH_______ (填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=_______ 。
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下:
Ⅰ.Hb(aq)+H+(aq)
 HbH+(aq) ΔH1
HbH+(aq) ΔH1 Ⅱ.HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2 Ⅲ.Hb(aq)+O2(g)
 HbO2(aq) ΔH3
HbO2(aq) ΔH3 ΔH3 =
(2)Hb与氧气的结合能力受到c(H+)的影响,相关反应如下:HbO2(aq)+H+(aq)
 HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度a的关系如图1所示,pH=7.6时对应的曲线为
HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度a的关系如图1所示,pH=7.6时对应的曲线为
(3)Mb与氧气结合的反应如下:Mb(aq)+O2(g)
 MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
MbO2(aq) ΔH,37 ℃时,氧气分压p (O2)与达平衡时Mb与氧气的结合度a的关系如图2所示。
①已知Mb与氧气结合的平衡常数的表达式K=
 ,计算37 ℃时K=
,计算37 ℃时K=②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,计算此时Mb与氧气的最大结合度为
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH
④已知37 ℃时,上述反应的正反应速率v(正)=k1·c(Mb)·p(O2),逆反应速率v(逆)=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】丙烯腈(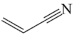 )是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以
)是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以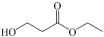 为原料合成丙烯腈的主要反应如下:
为原料合成丙烯腈的主要反应如下:
Ⅰ. (g)
(g)
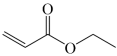 (g)+H2O(g) ∆H1>0
(g)+H2O(g) ∆H1>0
Ⅱ. (g)+NH3(g)
(g)+NH3(g) 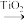
 (g)+H2O(g)+
(g)+H2O(g)+  (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
(1)已知部分化学键的键能如下表所示:
据此计算
_______ 。
(2)在盛有催化剂 、压强为
、压强为 的恒压密闭容器中按体积比2∶15充入
的恒压密闭容器中按体积比2∶15充入 (g)和
(g)和 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如 的物质的量分数ω%=
的物质的量分数ω%=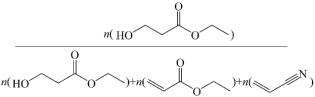 ×100%)。
×100%)。
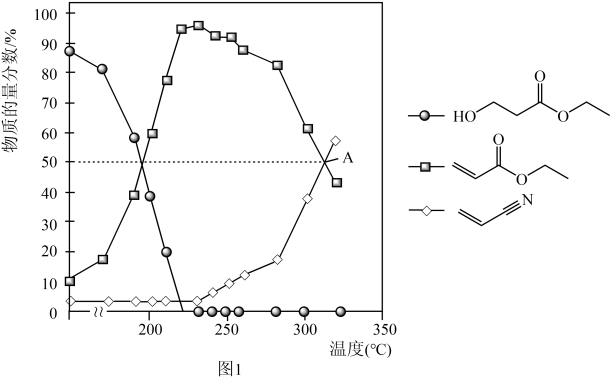
① 的名称为
的名称为_______ (用系统命名法命名)。
②随着温度的升高, 的平衡体积分数先增大后减小的原因为
的平衡体积分数先增大后减小的原因为_______ 。
③图中A点对应反应Ⅱ的标准平衡常数
_______ (保留两位有效数字)。【其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为 )除以
)除以 】
】
④实际生产中若充入一定量氨气可提高丙烯腈的平衡产率,原因为_______ 。
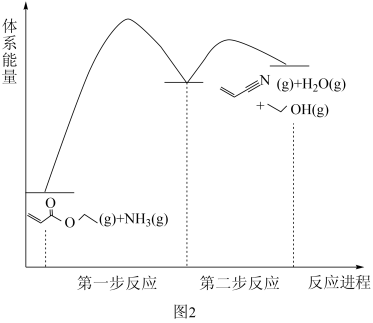
(3)科学家通过DFT计算得出反应Ⅱ的机理如图2所示,其中第二步反应为 (g)
(g)
 (g)+H2O(g),则第一步反应的化学方程式为
(g)+H2O(g),则第一步反应的化学方程式为_______ 。
(4)利用电解法由丙烯腈制备己二腈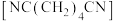 的装置如图3所示。
的装置如图3所示。

通电过程中,石墨电极2上的电极反应式为_______ 。
 )是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以
)是一种重要的化工原料,广泛应用于三大有机合成材料的生产中。以 为原料合成丙烯腈的主要反应如下:
为原料合成丙烯腈的主要反应如下:Ⅰ.
 (g)
(g)
 (g)+H2O(g) ∆H1>0
(g)+H2O(g) ∆H1>0Ⅱ.
 (g)+NH3(g)
(g)+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+  (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)已知部分化学键的键能如下表所示:
| 化学键 | 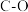 | 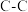 | 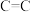 |  | 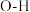 |  |
键能( ) ) | 351 | 348 | 615 | 413 | 463 | 745 |

(2)在盛有催化剂
 、压强为
、压强为 的恒压密闭容器中按体积比2∶15充入
的恒压密闭容器中按体积比2∶15充入 (g)和
(g)和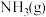 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图1所示(例如 的物质的量分数ω%=
的物质的量分数ω%= ×100%)。
×100%)。
①
 的名称为
的名称为②随着温度的升高,
 的平衡体积分数先增大后减小的原因为
的平衡体积分数先增大后减小的原因为③图中A点对应反应Ⅱ的标准平衡常数

 )除以
)除以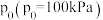 】
】④实际生产中若充入一定量氨气可提高丙烯腈的平衡产率,原因为
(3)科学家通过DFT计算得出反应Ⅱ的机理如图2所示,其中第二步反应为
 (g)
(g)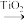
 (g)+H2O(g),则第一步反应的化学方程式为
(g)+H2O(g),则第一步反应的化学方程式为
(4)利用电解法由丙烯腈制备己二腈
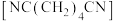 的装置如图3所示。
的装置如图3所示。
通电过程中,石墨电极2上的电极反应式为
您最近一年使用:0次
【推荐3】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①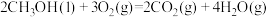 ∆H1=
∆H1=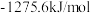
②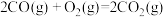 ∆H2=
∆H2=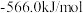
③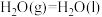 ∆H3=
∆H3=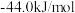
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____ 。
(2)生产甲醇的原料CO和 来源于:
来源于: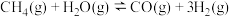 ∆H>0
∆H>0
①一定条件下 的平衡转化率与温度、压强的关系如图a。则T1
的平衡转化率与温度、压强的关系如图a。则T1___ T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___ 。

②100℃时,将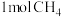 和
和 通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是
通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是___ 。
a.容器内气体密度恒定
b.单位时间内消耗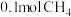 同时生成
同时生成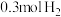
c.容器的压强恒定
d. 3v正(CH4)= v逆(H2)
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K=
的转化率为0.5,则100℃时该反应的平衡常数K=____ 。
(3)现以 、
、 、熔融盐
、熔融盐 组成的燃料电池,采用电解法制备
组成的燃料电池,采用电解法制备 ,装置如图所示,其中Y为
,装置如图所示,其中Y为 。
。

写出石墨I电极上发生反应的电极反应式________ 。
在电解池中生成N2O5的电极反应式为_______ 。
(1)已知:①
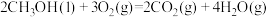 ∆H1=
∆H1=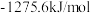
②
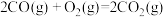 ∆H2=
∆H2=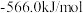
③
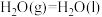 ∆H3=
∆H3=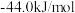
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和
 来源于:
来源于: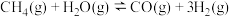 ∆H>0
∆H>0 ①一定条件下
 的平衡转化率与温度、压强的关系如图a。则T1
的平衡转化率与温度、压强的关系如图a。则T1
②100℃时,将
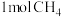 和
和 通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是
通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是a.容器内气体密度恒定
b.单位时间内消耗
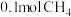 同时生成
同时生成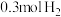
c.容器的压强恒定
d. 3v正(CH4)= v逆(H2)
如果达到平衡时
 的转化率为0.5,则100℃时该反应的平衡常数K=
的转化率为0.5,则100℃时该反应的平衡常数K=(3)现以
 、
、 、熔融盐
、熔融盐 组成的燃料电池,采用电解法制备
组成的燃料电池,采用电解法制备 ,装置如图所示,其中Y为
,装置如图所示,其中Y为 。
。
写出石墨I电极上发生反应的电极反应式
在电解池中生成N2O5的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】氯化亚砜(SOCl2)具有很强的氯化能力和脱水能力,在有机合成中具有重要的应用。工业上用硫酸厂尾气中的SO2与SCl2、Cl2为原料合成SOCl2,反应如下:
Ⅰ. SO2(g)+Cl2(g) SO2Cl2(g) ΔH = −471.7 kJ·mol−1
SO2Cl2(g) ΔH = −471.7 kJ·mol−1
Ⅱ. SCl2(g)+SO2Cl2(g) 2SOCl2(g) ΔH = −5.6 kJ·mol−1
2SOCl2(g) ΔH = −5.6 kJ·mol−1
回答下列问题:
(1)该条件下,由SO2(g)、Cl2(g)和SCl2(g),制备1 mol SOCl2(g)放出的热量为______ kJ。
(2)一定条件下,在5 L的恒容密闭容器中通入一定量的SO2、SCl2与Cl2,反应4 min后达到平衡。若初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。

容器内各组分物质的量如下表。
①0~1 min容器内压强增大的原因为___________ 。
②反应Ⅰ、Ⅱ达平衡时,SCl2的平衡转化率为________ 。
③K为平衡常数,pK=−lg K,该温度下,反应Ⅱ的pK =______ (保留两位有效数字,lg2 = 0.30)。
(3)常温下,将SO2通入到NaOH溶液中,充分反应后得到a mol·L−1的NaHSO3溶液,该溶液的pH=5,则溶液中c( )
)_____ c(H2SO3)(填“>”“=”或“<”), 的电离常数约为
的电离常数约为_________ (用含a的式子表示)。
Ⅰ. SO2(g)+Cl2(g)
 SO2Cl2(g) ΔH = −471.7 kJ·mol−1
SO2Cl2(g) ΔH = −471.7 kJ·mol−1Ⅱ. SCl2(g)+SO2Cl2(g)
 2SOCl2(g) ΔH = −5.6 kJ·mol−1
2SOCl2(g) ΔH = −5.6 kJ·mol−1回答下列问题:
(1)该条件下,由SO2(g)、Cl2(g)和SCl2(g),制备1 mol SOCl2(g)放出的热量为
(2)一定条件下,在5 L的恒容密闭容器中通入一定量的SO2、SCl2与Cl2,反应4 min后达到平衡。若初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化如下图所示(平衡时温度与初始温度相同)。

容器内各组分物质的量如下表。
| 组分 | SO2 | Cl2 | SCl2 | SO2Cl2 | SOCl2 |
| 起始/mol | 0.25 | 0.25 | 0.25 | 0 | 0 |
| 平衡/mol | 0.1 |
②反应Ⅰ、Ⅱ达平衡时,SCl2的平衡转化率为
③K为平衡常数,pK=−lg K,该温度下,反应Ⅱ的pK =
(3)常温下,将SO2通入到NaOH溶液中,充分反应后得到a mol·L−1的NaHSO3溶液,该溶液的pH=5,则溶液中c(
 )
) 的电离常数约为
的电离常数约为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】硫酸是化学工业当中最基本也是最重要的化工原料之一,硫酸的产量是衡量一个国家化工水平的标志。请回答:
(1)工业上大规模制备浓硫酸一般采用硫铁矿或硫磺粉为原料。
①298K,101kPa下,下列反应
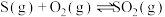
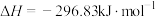
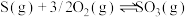
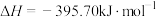
则反应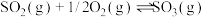 能自发进行的条件是
能自发进行的条件是_______ 。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)_______ 。
A.在制备 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在 转化为
转化为 阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)对于反应
①某温度下,假设进入接触室内 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使
的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使 的平衡转化率提高到90%,则
的平衡转化率提高到90%,则 和
和 的物质的量比为应为
的物质的量比为应为_______ (计算结果保留1位小数)。
② 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:_______ 。
步骤Ⅲ:
(3) 能溶于液态
能溶于液态 中,并存在如下两个平衡(未配平)
中,并存在如下两个平衡(未配平)

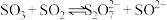
当稀释 时,
时,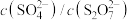 的值
的值_______ (增大、减小或不变),理由是_______ 。
(1)工业上大规模制备浓硫酸一般采用硫铁矿或硫磺粉为原料。
①298K,101kPa下,下列反应
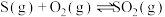
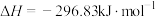
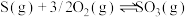
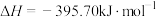
则反应
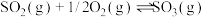 能自发进行的条件是
能自发进行的条件是②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)
A.在制备
 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多B.两种方法产生的气体都不需要干燥
C.在
 转化为
转化为 阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)对于反应

①某温度下,假设进入接触室内
 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使
的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使 的平衡转化率提高到90%,则
的平衡转化率提高到90%,则 和
和 的物质的量比为应为
的物质的量比为应为②
 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:步骤Ⅰ:

步骤Ⅱ:
步骤Ⅲ:

(3)
 能溶于液态
能溶于液态 中,并存在如下两个平衡(未配平)
中,并存在如下两个平衡(未配平)
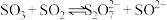
当稀释
 时,
时,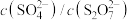 的值
的值
您最近一年使用:0次
【推荐3】NOx、SO2是大气的主要污染物。研究消除NOx、SO2的方法和机理一直是环境专家不断追求的目标。
I.以V2O5为催化剂,将SO2氧化为SO3,进一步生产硫酸,变废为宝。该过程的机理如下:
SO2(g)+V2O5(s) SO3(g)+V2O4(s),活化能为Ea1
SO3(g)+V2O4(s),活化能为Ea1
2V2O4(s)+O2(g) 2V2O5(s),活化能为Ea2。
2V2O5(s),活化能为Ea2。
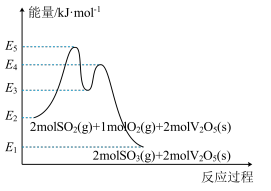
(1)则2SO2(g)+O2(g) 2SO3(g)的△H=
2SO3(g)的△H=______ kJ•mol-1(用E1~E5中的合理数据组成的代数式表示)。
Ⅱ.已知:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-akJ•mol-1,在保持其他初始条件不变的情况下,分别在相同时间内,不同温度、不同催化剂下,测得NO转化率与温度的关系如图所示。
N2(g)+2CO2(g) △H=-akJ•mol-1,在保持其他初始条件不变的情况下,分别在相同时间内,不同温度、不同催化剂下,测得NO转化率与温度的关系如图所示。
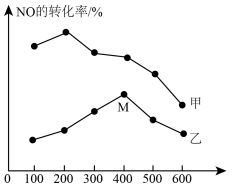
(2)在催化剂乙作用下,图中M点______ (填“是”或“不是”)平衡点,温度高于400℃,NO转化率降低的原因可能是______ 。
Ⅲ.中南大学某教授研究团队以CO同时还原NOx和SO2过程为研究对象,发现在一定温度下,平衡体系中发生的反应为:
①4CO(g)+2SO2(g) 4CO2(g)+S2(g)
4CO2(g)+S2(g)
②4CO(g)+2NO2(g) N2(g)+4CO2(g)
N2(g)+4CO2(g)
在该温度下,总压为4MPa条件下,以n(CO):n(SO2):n(NO2)=2:1∶1通入,t1s后达到平衡,CO2的分压为aMPa,N2的分压为bMPa。
(3)当t1s达平衡时,以CO表示的反应速率为______ MPa/s。
(4)反应①在该温度下的Kp=______ (MPa)-1。(列出计算式即可以)
Ⅳ.湖大化工团队在酸性的条件下,以电化学原理消除NOx、SO2,同时又变废为宝。
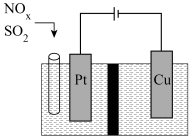
(5)写出NOx转化的电极反应方程式:______ 。
(6)电解生成的硫酸,电离方程式可表示为:H2SO4=H++HSO ,HSO
,HSO
 H++SO
H++SO 。
。
①25℃时,Na2SO4溶液的pH______ (填“>”“<”或“=”)7。
②0.100mol•L-1的稀硫酸中,c(H+)=0.109mol•L-1,求硫酸第二步电离的电离常数:______ (写出计算过程,结果保留三位有效数字)。
I.以V2O5为催化剂,将SO2氧化为SO3,进一步生产硫酸,变废为宝。该过程的机理如下:
SO2(g)+V2O5(s)
 SO3(g)+V2O4(s),活化能为Ea1
SO3(g)+V2O4(s),活化能为Ea12V2O4(s)+O2(g)
 2V2O5(s),活化能为Ea2。
2V2O5(s),活化能为Ea2。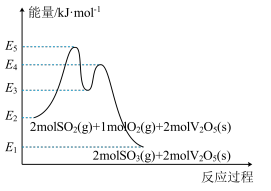
(1)则2SO2(g)+O2(g)
 2SO3(g)的△H=
2SO3(g)的△H=Ⅱ.已知:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-akJ•mol-1,在保持其他初始条件不变的情况下,分别在相同时间内,不同温度、不同催化剂下,测得NO转化率与温度的关系如图所示。
N2(g)+2CO2(g) △H=-akJ•mol-1,在保持其他初始条件不变的情况下,分别在相同时间内,不同温度、不同催化剂下,测得NO转化率与温度的关系如图所示。
(2)在催化剂乙作用下,图中M点
Ⅲ.中南大学某教授研究团队以CO同时还原NOx和SO2过程为研究对象,发现在一定温度下,平衡体系中发生的反应为:
①4CO(g)+2SO2(g)
 4CO2(g)+S2(g)
4CO2(g)+S2(g)②4CO(g)+2NO2(g)
 N2(g)+4CO2(g)
N2(g)+4CO2(g)在该温度下,总压为4MPa条件下,以n(CO):n(SO2):n(NO2)=2:1∶1通入,t1s后达到平衡,CO2的分压为aMPa,N2的分压为bMPa。
(3)当t1s达平衡时,以CO表示的反应速率为
(4)反应①在该温度下的Kp=
Ⅳ.湖大化工团队在酸性的条件下,以电化学原理消除NOx、SO2,同时又变废为宝。

(5)写出NOx转化的电极反应方程式:
(6)电解生成的硫酸,电离方程式可表示为:H2SO4=H++HSO
 ,HSO
,HSO
 H++SO
H++SO 。
。①25℃时,Na2SO4溶液的pH
②0.100mol•L-1的稀硫酸中,c(H+)=0.109mol•L-1,求硫酸第二步电离的电离常数:
您最近一年使用:0次