名校
1 . 一节1号干电池可以让1平方米土地上的庄稼颗粒无收,回收电池既可以防止污染又可以变废为宝。废旧锌锰干电池内部的黑色物质A主要含有 、
、 、
、 、
、 、碳单质、少量有机物(有机物易燃烧生成
、碳单质、少量有机物(有机物易燃烧生成 和
和 ),用黑色物质A制备高纯
),用黑色物质A制备高纯 的流程如图:
的流程如图:________ (填化学式)。
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为 ,另一个是
,另一个是________ 。灼烧时,MnOOH与空气中的氧气反应的化学方程式为________________ 。
(3)第III步中为提高反应速率,可以采取的措施有________ (任写一条)。
(4)已知: 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为 沉淀。第IV步中的多步操作可按如图步骤进行:
沉淀。第IV步中的多步操作可按如图步骤进行: 溶液调节溶液pH的过程中有
溶液调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为________________ ;
②操作VI中需要的玻璃仪器有________ ;
③你认为操作VII中检测的方法及现象是________ 时可继续进行操作VIII;
④操作VIII中用无水乙醇洗涤的目的是________ 。
 、
、 、
、 、
、 、碳单质、少量有机物(有机物易燃烧生成
、碳单质、少量有机物(有机物易燃烧生成 和
和 ),用黑色物质A制备高纯
),用黑色物质A制备高纯 的流程如图:
的流程如图:
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为
 ,另一个是
,另一个是(3)第III步中为提高反应速率,可以采取的措施有
(4)已知:
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为 沉淀。第IV步中的多步操作可按如图步骤进行:
沉淀。第IV步中的多步操作可按如图步骤进行: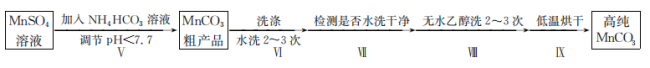
 溶液调节溶液pH的过程中有
溶液调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为②操作VI中需要的玻璃仪器有
③你认为操作VII中检测的方法及现象是
④操作VIII中用无水乙醇洗涤的目的是
您最近半年使用:0次
名校
2 . 利用软锰矿(主要成分是 )和黄铁矿[主要成分是二硫化亚铁
)和黄铁矿[主要成分是二硫化亚铁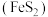 ]联合生产锰的化合物的工艺流程如图所示:
]联合生产锰的化合物的工艺流程如图所示: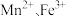 ,还含有少量的
,还含有少量的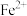 和
和 。
。
②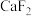 难溶于水,
难溶于水,
(1)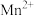 的核外电子排布式是
的核外电子排布式是___________ 。
(2)“酸浸”时所用的稀酸 是
是___________ ,两种矿石的主要成分在稀酸 中反应生成两种可溶性盐和一种淡黄色固体单质,则酸浸时发生主要反应的离子方程式是
中反应生成两种可溶性盐和一种淡黄色固体单质,则酸浸时发生主要反应的离子方程式是___________ 。
(3)“除铁、铝”时废渣2的主要成分为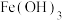 和
和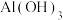 ,则加入
,则加入 的目的是
的目的是___________ ;“净化”后得到 溶液,废渣3的主要成分是
溶液,废渣3的主要成分是___________ 。
(4)由 溶液得到
溶液得到 的过程如下;
的过程如下;
①过程Ⅰ:制备 难溶于水,能溶于强酸,可用
难溶于水,能溶于强酸,可用 溶液和
溶液和 溶液混合得到
溶液混合得到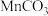 沉淀和一种气体,每制得
沉淀和一种气体,每制得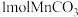 ,至少消耗
,至少消耗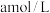 的
的 溶液的体积为
溶液的体积为___________ 。
②过程Ⅱ:制备 ,其流程如图所示:
,其流程如图所示: 时溶液
时溶液 随时间的变化曲线(溶液酸性越强,
随时间的变化曲线(溶液酸性越强, 值越小),
值越小),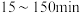 内滤饼中一定参与反应的成分是
内滤饼中一定参与反应的成分是___________ (填化学式),判断的理由是___________ (用化学方程式表示)。
 )和黄铁矿[主要成分是二硫化亚铁
)和黄铁矿[主要成分是二硫化亚铁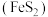 ]联合生产锰的化合物的工艺流程如图所示:
]联合生产锰的化合物的工艺流程如图所示: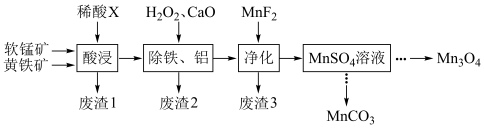
 ,还含有少量的
,还含有少量的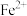 和
和 。
。②
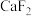 难溶于水,
难溶于水,(1)
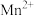 的核外电子排布式是
的核外电子排布式是(2)“酸浸”时所用的稀酸
 是
是 中反应生成两种可溶性盐和一种淡黄色固体单质,则酸浸时发生主要反应的离子方程式是
中反应生成两种可溶性盐和一种淡黄色固体单质,则酸浸时发生主要反应的离子方程式是(3)“除铁、铝”时废渣2的主要成分为
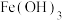 和
和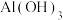 ,则加入
,则加入 的目的是
的目的是 溶液,废渣3的主要成分是
溶液,废渣3的主要成分是(4)由
 溶液得到
溶液得到 的过程如下;
的过程如下;①过程Ⅰ:制备
 难溶于水,能溶于强酸,可用
难溶于水,能溶于强酸,可用 溶液和
溶液和 溶液混合得到
溶液混合得到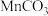 沉淀和一种气体,每制得
沉淀和一种气体,每制得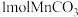 ,至少消耗
,至少消耗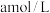 的
的 溶液的体积为
溶液的体积为②过程Ⅱ:制备
 ,其流程如图所示:
,其流程如图所示:
 时溶液
时溶液 随时间的变化曲线(溶液酸性越强,
随时间的变化曲线(溶液酸性越强, 值越小),
值越小),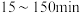 内滤饼中一定参与反应的成分是
内滤饼中一定参与反应的成分是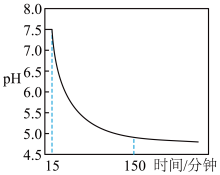
您最近半年使用:0次
3 . 锰可用于制造特种钢材,在汽车电池、高端装备制造、新材料等领域有广泛应用。二氧化锰广泛应用于电池、电子工业。以主要成分为 的某锰矿(杂质为
的某锰矿(杂质为 、
、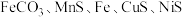 等)为原料制备单质锰的一种流程如图所示:
等)为原料制备单质锰的一种流程如图所示: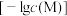 与溶液
与溶液 的关系如图所示:
的关系如图所示:
(1)滤液中的溶质为 、
、___________ (填化学式),“氧化除硫”过程中有红褐色固体生成,则 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(2)“酸浸氧化”过程 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
(3)为何不通过调 的方法将
的方法将 除去:
除去: ___________ ;已知若溶液中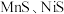 同时沉淀完全时,溶液中
同时沉淀完全时,溶液中 ,则相同温度下,
,则相同温度下,
___________ 。
(4)通过控制适当的反应条件,电解 溶液时,既可得到
溶液时,既可得到 也可得到
也可得到 ,则生成单质时,
,则生成单质时, 应在
应在___________ (填“阳极”或“阴极”)上放电;写出生成 时的电极反应式:
时的电极反应式:___________ 。
(5)已知单质锰的立方晶胞结构如图所示:___________ ;若锰原子半径为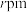 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则单质锰的密度为
,则单质锰的密度为___________  (用含
(用含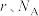 的代数式表示)。
的代数式表示)。
 的某锰矿(杂质为
的某锰矿(杂质为 、
、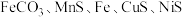 等)为原料制备单质锰的一种流程如图所示:
等)为原料制备单质锰的一种流程如图所示:
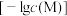 与溶液
与溶液 的关系如图所示:
的关系如图所示: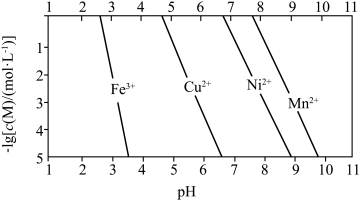
(1)滤液中的溶质为
 、
、 参与反应的化学方程式为
参与反应的化学方程式为(2)“酸浸氧化”过程
 被氧化的离子方程式为
被氧化的离子方程式为(3)为何不通过调
 的方法将
的方法将 除去:
除去: 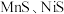 同时沉淀完全时,溶液中
同时沉淀完全时,溶液中 ,则相同温度下,
,则相同温度下,
(4)通过控制适当的反应条件,电解
 溶液时,既可得到
溶液时,既可得到 也可得到
也可得到 ,则生成单质时,
,则生成单质时, 应在
应在 时的电极反应式:
时的电极反应式:(5)已知单质锰的立方晶胞结构如图所示:

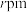 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则单质锰的密度为
,则单质锰的密度为 (用含
(用含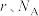 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解题方法
4 . 工业上用软锰矿(主要含 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。_______ 个未成对电子,Mn元素位于元素周期表的______ 区。
(2)提高“酸浸”浸出率可采取的措施有______ (写两条),“冰水沉积”的目的是____________ 。
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是______ (填化学式)。
(4)“酸浸”时,PbS与 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式____________ 。
(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是____________ 。
(6)“氧化”时,发生的主要反应的离子方程式为____________ 。
(7)通过 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式______________ 。
 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。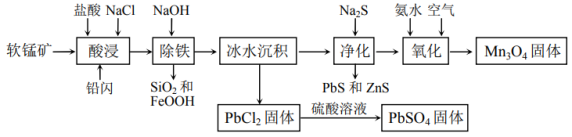
(2)提高“酸浸”浸出率可采取的措施有
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是
(4)“酸浸”时,PbS与
 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是
(6)“氧化”时,发生的主要反应的离子方程式为
(7)通过
 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式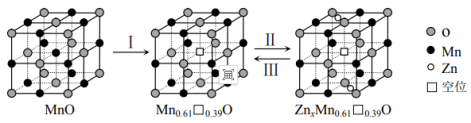
您最近半年使用:0次
5 . 工业上以碳酸锰矿(主要含MnCO3,还含有SiO2、Al2O3、FeCO3等杂质)为原料制备MnO2的工艺流程如下图所示。
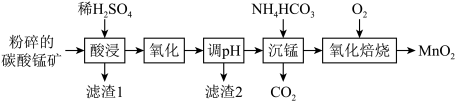
已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
回答下列问题:
(1)“酸浸”前将碳酸锰矿粉碎的目的是___________ 。
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为___________ 。
(3)滤渣2的主要成分为Al(OH)3和___________ ,应“调pH”时应控制pH范围为___________ 。
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是___________ 。要使Mn2+沉淀完全(通常认为溶液中离子浓度小于1.0×10-5mol/L为沉淀完全),溶液中CO 的浓度应大于
的浓度应大于___________ 。[25℃时,Ksp(MnCO3)=2.0×10-11]。
(5)“氧化焙烧”的化学方程式为___________ 。
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是___________ 。(忽略流程中锰元素的损失)。

已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.3 |
完全沉淀pH | 3.7 | 9.7 | 5.2 | 9.8 |
(1)“酸浸”前将碳酸锰矿粉碎的目的是
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为
(3)滤渣2的主要成分为Al(OH)3和
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是
 的浓度应大于
的浓度应大于(5)“氧化焙烧”的化学方程式为
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是
您最近半年使用:0次
名校
解题方法
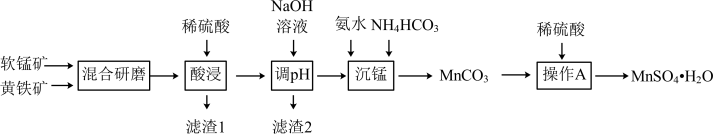
6 . 以黄铁矿(主要成分是 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知: 时,
时,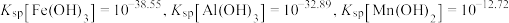 。
。
(1)研磨黄铁矿、软锰矿的目的是_______ 。
(2)酸浸过程得到的滤液中含有的金属阳离子有 和
和_______ ,滤渣1的成分为 和
和_______ 写出酸浸过程中主要反应的离子方程式_______ 。
(3)调 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是_______ 。
(4)沉锰过程需控制温度为 的原因是
的原因是_______ 。
(5)写出沉锰过程中生成 的离子方程式
的离子方程式_______ 。
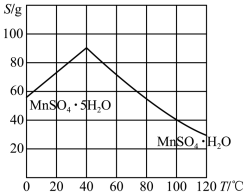
(6)下图为 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,_______ 洗涤干燥。
 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量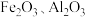 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:
 时,
时,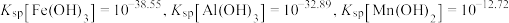 。
。(1)研磨黄铁矿、软锰矿的目的是
(2)酸浸过程得到的滤液中含有的金属阳离子有
 和
和 和
和(3)调
 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是(4)沉锰过程需控制温度为
 的原因是
的原因是(5)写出沉锰过程中生成
 的离子方程式
的离子方程式(6)下图为
 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
您最近半年使用:0次
2024-03-31更新
|
386次组卷
|
2卷引用:广东省广州市第六十五中学2023-2024学年高三下学期期初综合训练化学试题
7 . 以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取精银、Mn及MnO2的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是_______ 。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:_______ 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:
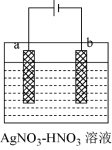
①_______ 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为_______ ;当电路中通过0.025NA电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为_______ mL(保留三位有效数字)。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以
 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:

①
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为
您最近半年使用:0次
解题方法
8 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近半年使用:0次
名校
9 . 次锰酸根离子( ),水溶液呈亮蓝色。工业上常用软锰矿(主要成分
),水溶液呈亮蓝色。工业上常用软锰矿(主要成分 ,含有少量的
,含有少量的 、
、 、
、 以及其他少量不溶于水、不反应的杂质)为原料制备。现有一种制备流程如图:
以及其他少量不溶于水、不反应的杂质)为原料制备。现有一种制备流程如图:
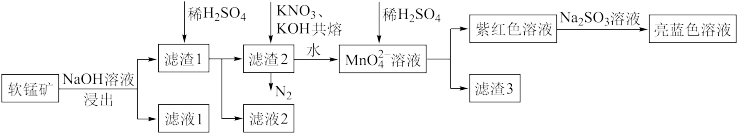
(1)滤渣1的主要成分是___________ , 在周期表中的位置
在周期表中的位置___________ 。
(2)流程中共熔时发生的主要反应的化学方程式为___________ 。
(3)写出 转变为紫红色溶液的离子反应方程式
转变为紫红色溶液的离子反应方程式___________ 。
(4)整个流程中的___________ (填化学式)能重复利用。
(5) 在高温条件下还原软锰矿制备
在高温条件下还原软锰矿制备 的化学方程式为
的化学方程式为___________ 。
 ),水溶液呈亮蓝色。工业上常用软锰矿(主要成分
),水溶液呈亮蓝色。工业上常用软锰矿(主要成分 ,含有少量的
,含有少量的 、
、 、
、 以及其他少量不溶于水、不反应的杂质)为原料制备。现有一种制备流程如图:
以及其他少量不溶于水、不反应的杂质)为原料制备。现有一种制备流程如图: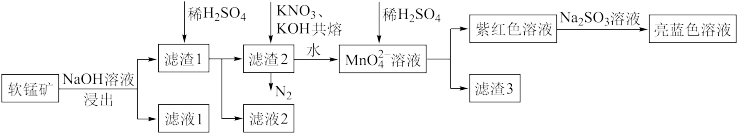
(1)滤渣1的主要成分是
 在周期表中的位置
在周期表中的位置(2)流程中共熔时发生的主要反应的化学方程式为
(3)写出
 转变为紫红色溶液的离子反应方程式
转变为紫红色溶液的离子反应方程式(4)整个流程中的
(5)
 在高温条件下还原软锰矿制备
在高温条件下还原软锰矿制备 的化学方程式为
的化学方程式为
您最近半年使用:0次
2024-02-20更新
|
146次组卷
|
2卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题
名校
解题方法
10 .  是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和
是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和 的工艺流程如下:
的工艺流程如下:
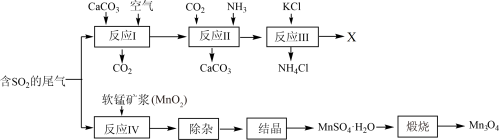
请回答下列问题:
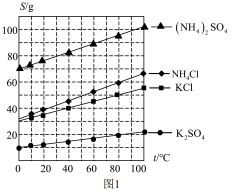
(1)几种盐的溶解度见下图1,化肥X的化学式为_____ ;
(2)为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应_____ (填操作名称),再洗涤、干燥晶体。
(3)反应Ⅳ中发生反应的方程式为_____ 。
(4)图2是隔绝空气条件煅烧 时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:
时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:_____ 。

(5)为测定产品中 的纯度,取2.500g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉-KI溶液中,稀释至250mL,从中取25.00mL用
的纯度,取2.500g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉-KI溶液中,稀释至250mL,从中取25.00mL用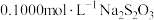 标准溶液滴定至终点时,消耗20.00mL标准溶液(
标准溶液滴定至终点时,消耗20.00mL标准溶液(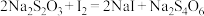 )。
)。
①样品与浓盐酸发生反应( 的还原产物为
的还原产物为 )的离子方程式为
)的离子方程式为_____ 。
②求样品的纯度(写出计算过程,计算结果保留1位小数)_____ 。
 是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和
是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和 的工艺流程如下:
的工艺流程如下:
请回答下列问题:
(1)几种盐的溶解度见下图1,化肥X的化学式为
(2)为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应
(3)反应Ⅳ中发生反应的方程式为
(4)图2是隔绝空气条件煅烧
 时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:
时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:

(5)为测定产品中
 的纯度,取2.500g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉-KI溶液中,稀释至250mL,从中取25.00mL用
的纯度,取2.500g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉-KI溶液中,稀释至250mL,从中取25.00mL用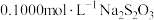 标准溶液滴定至终点时,消耗20.00mL标准溶液(
标准溶液滴定至终点时,消耗20.00mL标准溶液(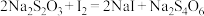 )。
)。①样品与浓盐酸发生反应(
 的还原产物为
的还原产物为 )的离子方程式为
)的离子方程式为②求样品的纯度(写出计算过程,计算结果保留1位小数)
您最近半年使用:0次



