名校
1 . D为芳香族化合物,有机物M可由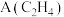 按如图路线合成:
按如图路线合成:
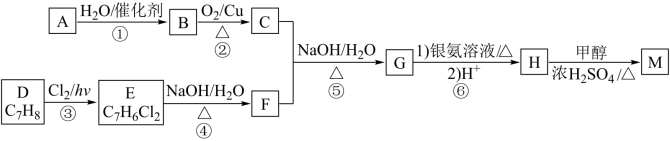
已知:
i.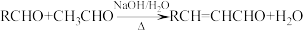
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是_________ ,F中含有的官能团名称是__________________ 。
(2)③的反应类型是__________________ 。
(3)H的结构简式是___________________________ 。
(4)反应④的化学方程式是____________________________________ 。
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链, 的L可与
的L可与 的
的 反应,L共有
反应,L共有_________ 种(不考虑立体异构):其中核磁共振氢谱为六组峰,峰面积比为 的结构简式是
的结构简式是__________________ (任写一种)。
(6)参照上述合成路线,设计以C为原料制备高吸水性树脂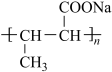 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)____________________________________ 。
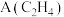 按如图路线合成:
按如图路线合成:
已知:
i.
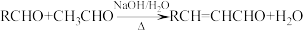
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是
(2)③的反应类型是
(3)H的结构简式是
(4)反应④的化学方程式是
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链,
 的L可与
的L可与 的
的 反应,L共有
反应,L共有 的结构简式是
的结构简式是(6)参照上述合成路线,设计以C为原料制备高吸水性树脂
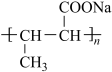 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
名校
解题方法
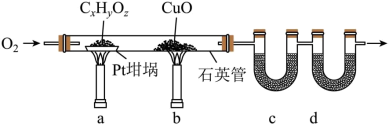
2 . 元素分析是有机化合物的表征手段之一,按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
(1)将装有样品的Pt坩埚和CuO放入石英管中,先通入一定的O2,而后将已称重的U型管c、d与石英管连接,检查装置气密性。依次点燃煤气灯___________ (排a、b顺序),进行实验。
(2)O2的作用有为实验提供氧化剂、提供气流保证反应产物完全进入到U型管中。CuO的作用是___________ (举1例,用化学方程式表示)。
(3)c和d中的试剂分别是___________ 、___________ (填标号)。c和d中的试剂不可调换,理由是___________ 。
A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:___________ 。取下c和d管称重。
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为___________ 。
(1)将装有样品的Pt坩埚和CuO放入石英管中,先通入一定的O2,而后将已称重的U型管c、d与石英管连接,检查装置气密性。依次点燃煤气灯
(2)O2的作用有为实验提供氧化剂、提供气流保证反应产物完全进入到U型管中。CuO的作用是
(3)c和d中的试剂分别是
A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为
您最近一年使用:0次
2024-02-26更新
|
409次组卷
|
3卷引用:吉林省通化市梅河口市博文学校2022-2023学年高二下学期期末考试化学试题
名校
解题方法
3 . 某无色溶液可能由Na+、Ba2+、Cu2+、 、
、 、
、 、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。
下列关于原溶液说法正确的是
 、
、 、
、 、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:
、Cl-中的一种或几种。为了确定该溶液的成分,进行如下实验:①取少量该溶液加入足量氯水,有气体产生,得到甲溶液;
②取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀甲;
③取少量原溶液,向其中加入Ba(OH)2溶液,产生白色沉淀乙,加足量稀盐酸,沉淀部分溶解。
下列关于原溶液说法正确的是
A.肯定存在 |
| B.肯定不存在 Ba2+,可能存在Cu2+ |
C. 、 、 均不存在 均不存在 |
| D.是否存在Na+需要通过焰色试验来确定 |
您最近一年使用:0次
2024-02-02更新
|
127次组卷
|
3卷引用:吉林省“BEST合作体”2023-2024学年高一上学期期末考试化学试题
名校
4 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、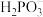 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: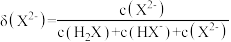 。
。
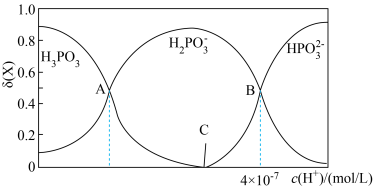
①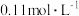 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点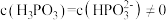 ,那C点对应的
,那C点对应的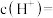
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中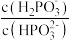 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
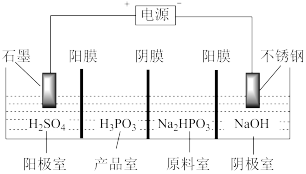
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、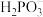 、
、 的物质的量分数
的物质的量分数 随
随 的变化如图所示。已知:
的变化如图所示。已知: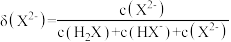 。
。
①
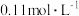 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
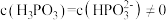 ,那C点对应的
,那C点对应的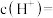
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中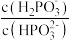 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近一年使用:0次
解题方法
5 . 模拟工业上用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产Cu(NO3)2溶液的流程如下图所示。
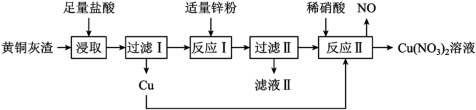
回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用_____ 量取浓硝酸的体积为________ mL。
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、______ 0.5%、Si 0.7%,它的密度小、强度高、具有较强的抗腐蚀能力。(填元素符号)
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是________ (写化学式)。
②参与反应的铁粉的质量是______ g。
③假设溶液的体积不变,最后所得溶液c(Fe2+)=_____ mol·L-1。

回答下列问题:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。若要获得100mL1.4mol·L-1的稀硝酸,需要用
(5)金属材料的使用见证了人类文明发展过程,铝合金是目前用途广泛的合金之一、例如,硬铝(一种铝合金)中含Cu 4%、Mg 0.5%、
(6)工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mL FeCl3溶液中使铜全部溶解得到浸泡液(电路板上其他物质均不发生反应),测得电路板质量减少了6.4g,在浸泡液中加足量的铁粉并使之充分反应,过滤并干燥固体,固体质量比加入的铁粉质量减少了4.8g,请回答下列问题:
①浸泡液中的溶质是
②参与反应的铁粉的质量是
③假设溶液的体积不变,最后所得溶液c(Fe2+)=
您最近一年使用:0次
6 . 某药物成分I具有抗炎、抗病毒、抗氧化等生物活性,其合成路线如下:
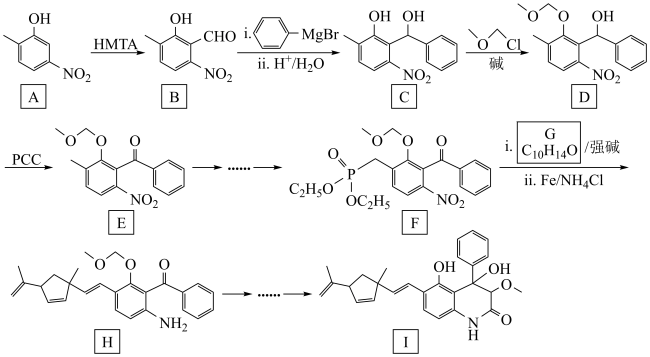
已知: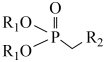 +R3-CHO
+R3-CHO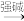
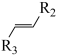
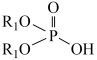 +
+
回答下列问题:
(1)A中官能团名称为___________ 。
(2)在NaOH溶液中,C→D的化学方程式为___________ 。
(3)D→E的反应类型为___________ 。
(4)G的结构简式为___________ 。
(5)化合物A的同分异构体满足以下条件的有___________ 种(不考虑立体异构);
i.含苯环 ii.含硝基,且硝基与碳原子相连。
(6)参照上述流程,设计以HCHO和 (R基自己确定)为原料合成
(R基自己确定)为原料合成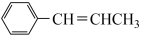 的路线如下:
的路线如下:

则X的结构简式为___________ ,Y的结构简式为___________ ,Z的结构简式为___________ 。

已知:
 +R3-CHO
+R3-CHO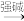
 +
+
回答下列问题:
(1)A中官能团名称为
(2)在NaOH溶液中,C→D的化学方程式为
(3)D→E的反应类型为
(4)G的结构简式为
(5)化合物A的同分异构体满足以下条件的有
i.含苯环 ii.含硝基,且硝基与碳原子相连。
(6)参照上述流程,设计以HCHO和
 (R基自己确定)为原料合成
(R基自己确定)为原料合成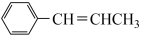 的路线如下:
的路线如下:
则X的结构简式为
您最近一年使用:0次
2024-01-14更新
|
383次组卷
|
5卷引用:吉林省吉林市2023-2024学年高三上学期第二次模拟考试 化学试题
吉林省吉林市2023-2024学年高三上学期第二次模拟考试 化学试题吉林省吉林市2023-2024学年高三上学期第二次模拟考试化学试题(已下线)有机综合题(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)专题11 有机推断综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
7 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
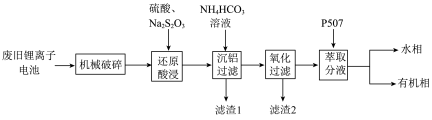
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成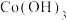 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,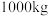 废料生产得到
废料生产得到 的质量为
的质量为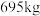 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成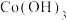 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
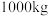 废料生产得到
废料生产得到 的质量为
的质量为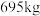 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
869次组卷
|
3卷引用:吉林省长春市东北师大附中2023-2024学年高三上学期第三次摸底考试化学科试卷
8 . Ⅰ.某探究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
(1)通过实验A、B可探究_______ (填外部因素)的改变对反应速率的影响,其中
_______ ;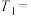
_______ ;通过实验_______ 可探究温度变化对化学反应速率的影响。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ ;利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为_______ 。
Ⅱ.在 密闭容器中进行反应:
密闭容器中进行反应: ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在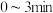 内,各物质物质的量的变化如下表所示:
内,各物质物质的量的变化如下表所示:
已知 内
内 ,
,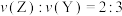 。
。
(3)确定以下物质的物质的量:起始时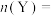
_______ ,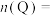
_______ 。
 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。| 实验 序号 | 实验温度/K |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间/s | ||
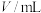 |  | 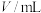 |  | 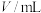 | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| B |  | 2 | 0.02 | 4 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 6 |  |

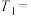
(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为Ⅱ.在
 密闭容器中进行反应:
密闭容器中进行反应: ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在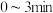 内,各物质物质的量的变化如下表所示:
内,各物质物质的量的变化如下表所示:| X | Y | Z | Q | |
| 起始/mol | 1.2 | 0 | ||
 末/mol 末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
 末/mol 末/mol | 0.8 |
 内
内 ,
,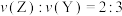 。
。(3)确定以下物质的物质的量:起始时
您最近一年使用:0次
名校
解题方法
9 . 已知PdCl2能被CO还原得到黑色的Pd。实验室中利用稀盐酸与石灰石制备CO2并探究金属钠与CO2的反应,装置如图。实验开始后,观察到PdCl2溶液的试管中有黑色物质产生;充分反应后的直形玻璃管中的固体加水能全部溶解,加入澄清石灰水,观察到白色浑浊。下列说法不正确的是
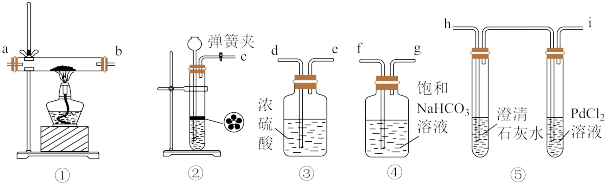

| A.装置的连接顺序为c→f→g→d→e→a→b→h→i |
| B.装置⑤中澄清石灰水的作用是为了吸收反应后剩余的CO2 |
| C.装置①中的反应为2Na+2CO2=Na2CO3+CO |
| D.装置②中药品不能用稀硫酸与碳酸钠代替 |
您最近一年使用:0次
名校
10 . 如图所示,常温下,往甲和乙两室中分别加入等体积、浓度均为0.1mol/L的CH3COONH4溶液(pH≈7)和CH3COOH溶液(pH≈3),中间用交换膜隔开(只有未电离的CH3COOH分子可自由通过交换膜,且不考虑溶液体积的变化),达到平衡后,下列说法不正确的是


A.常温下, |
B.平衡后,甲室中: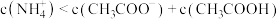 |
| C.平衡后,甲、乙两室pH相等 |
| D.平衡前,CH3COOH分子从乙到甲室 |
您最近一年使用:0次
2023-10-15更新
|
565次组卷
|
2卷引用:吉林省长春吉大附中实验学校2023-2024学年高二上学期11月期中化学试题



