解题方法
1 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将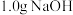 溶于
溶于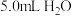 中,添加
中,添加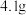 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在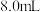 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在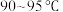 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
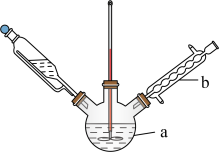
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
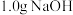 溶于
溶于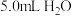 中,添加
中,添加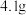 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在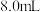 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
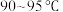 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
名校
2 . 某探究性学习小组利用 溶液和酸性
溶液和酸性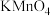 溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法不正确的是
溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法不正确的是
 溶液和酸性
溶液和酸性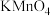 溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法不正确的是
溶液之间的反应来探究外界条件对化学反应速率的影响,实验操作如下。下列有关说法不正确的是| 实验序号 | 实验温度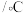 | 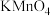 溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时所需时间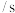 | ||
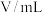 |  | 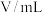 |  | 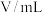 | |||
| 甲 | 25 | 2 | 0.06 | 3 | 0.3 | 5 | 12 |
| 乙 |  | 2 | 0.06 | 5 | 0.3 | 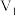 | 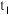 |
| 丙 | 35 | 2 | 0.06 | 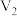 | 0.3 | 3 | 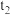 |
A. |
| B.通过实验乙、丙探究温度对化学反应速率的影响 |
C.反应的离子方程式为 |
D.甲组用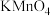 的浓度变化表示的平均反应速率为 的浓度变化表示的平均反应速率为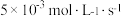 |
您最近一年使用:0次
2024-04-22更新
|
322次组卷
|
3卷引用:吉林省白山市抚松县第一中学2023-2024学年高一下学期5月期中化学试题
3 . 苯酚是一种重要的化工原料,其废水对生物具有毒害作用,在排放前必须经过处理。
为回收利用含苯酚的废水,某小组设计如下方案,有关说法正确的是
为回收利用含苯酚的废水,某小组设计如下方案,有关说法正确的是

| A.步骤①中,分液时从分液漏斗下口先放出废水,再放出有机溶液 |
| B.试剂①可用NaOH溶液或Na2CO3溶液 |
| C.步骤①②的操作为分液,步骤③的操作为过滤 |
D.试剂②若为少量CO2,则反应为2 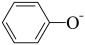 +CO2+H2O=2 +CO2+H2O=2  + + |
您最近一年使用:0次
解题方法
4 . 氢能作为清洁能源是最佳碳中和能源载体,为应对气候变化全球掀起了氢能发展热潮,制备氢气有多种途径。
I.甲醇产生氢气的反应为:
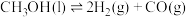
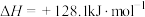
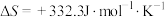
(1) 时,该反应能否自发进行
时,该反应能否自发进行___________ (填“能”或“否”)。
II.乙酸制氢过程发生如下反应:
反应1: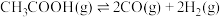
反应2: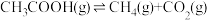
(2)已知反应: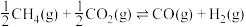

___________  ;
;
②恒温恒容下发生上述反应,下列说法正确的是___________ 。
A.混合气体密度不变时,反应达到平衡 B.充入 ,可提高
,可提高 的平衡转化率
的平衡转化率
C.加入催化剂,可提高 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变
(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,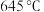 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是___________ (答出一点即可)。 ,乙酸体积分数为
,乙酸体积分数为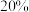 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的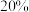 ,则反应2的平衡常数
,则反应2的平衡常数 为
为___________ (用平衡分压代替平衡浓度计算)。
III.热分解也可制氢,其原理为: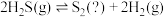 。
。
(5)不同温度和压强下, 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为___________ (填“气态”或“非气态”),
___________  (填“>”或“<”)。
(填“>”或“<”)。
I.甲醇产生氢气的反应为:
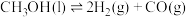
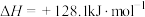
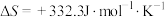
(1)
 时,该反应能否自发进行
时,该反应能否自发进行II.乙酸制氢过程发生如下反应:
反应1:
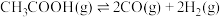
反应2:
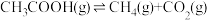
(2)已知反应:
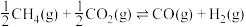


 ;
;②恒温恒容下发生上述反应,下列说法正确的是
A.混合气体密度不变时,反应达到平衡 B.充入
 ,可提高
,可提高 的平衡转化率
的平衡转化率C.加入催化剂,可提高
 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,
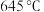 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是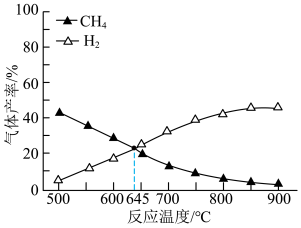
 ,乙酸体积分数为
,乙酸体积分数为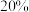 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的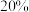 ,则反应2的平衡常数
,则反应2的平衡常数 为
为III.热分解也可制氢,其原理为:
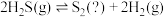 。
。(5)不同温度和压强下,
 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为
 (填“>”或“<”)。
(填“>”或“<”)。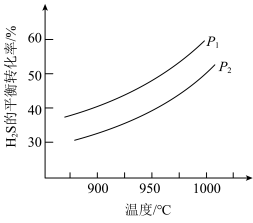
您最近一年使用:0次
解题方法
5 . 下列物质熔化时,所克服的粒子间作用力与碘升华时所克服的粒子间作用力属于同种类型的是
| A.NaCl | B. | C.S | D.Mg |
您最近一年使用:0次
名校
解题方法
6 . 1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
| A.C>D>B>A | B.D>B>A>C | C.A>D>C>B | D.B>A>C>D |
您最近一年使用:0次
2024-04-13更新
|
32次组卷
|
23卷引用:吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题
吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题2015-2016学年贵州省遵义一中高一下第二次联考化学试卷河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题步步为赢 初高中衔接教材化学暑假作业:第1课时 人类对原子结构的认识云南省广南县二中2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律章末综合检测卷湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题江苏省盐城市响水中学2020-2021学年高一上学期期中考试化学试题(已下线)4.1.1 原子结构 元素周期表 核素(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省如皋中学2020-2021学年高一上学期第二次阶段考试化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题甘肃省张掖市2021-2022学年高一上学期期末学业水平质量检测化学试题(已下线)易错专题26 原子的构成-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题第一节 原子结构与元素周期表 第1课时 原子结构 核素山东省菏泽市郓城县第一中学2021-2022学年高一下学期3月阶段性检测化学试题宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题江苏省邳州市宿羊山高级中学2021-2022学年高一上学期第二次学情检测化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题北京市第一六六中学2022-2023学年高一上学期期末考试化学试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
7 . 冠醚能与阳离子作用,将阳离子以及对应的阴离子都带入有机溶剂,例如 水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如下。
水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如下。
 水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如下。
水溶液对烯烃的氧化效果较差,在烯烃中溶入冠醚,可使氧化反应迅速发生,原理如下。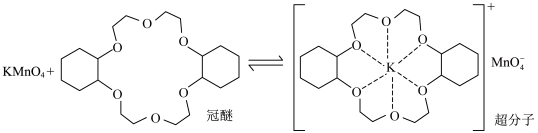
A.该冠醚的分子式为 |
| B.该冠醚的一氯代物有5种 |
| C.该冠醚可与任意碱金属离子结合形成超分子 |
D.该冠醚可增大 在液态烯烃中的溶解度 在液态烯烃中的溶解度 |
您最近一年使用:0次
2024-04-11更新
|
233次组卷
|
2卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
名校
解题方法
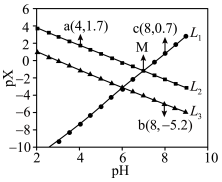
8 . 常温下,在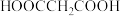 (简记为
(简记为 )和
)和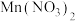 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、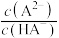 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
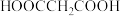 (简记为
(简记为 )和
)和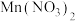 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、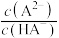 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的关系 的关系 |
B.直线 和 和 的交叉点坐标为 的交叉点坐标为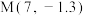 |
C.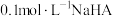 溶液中: 溶液中: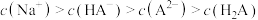 |
D.常温下,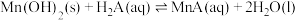 的 的 值为 值为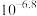 |
您最近一年使用:0次
2024-04-05更新
|
201次组卷
|
2卷引用:吉林省白山市2023-2024学年高三第二次模拟考试化学试题
名校
解题方法
9 . 已知: 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,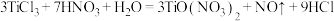 .回答下列问题:
.回答下列问题:
(1)基态钛原子的核外电子排布式为_____________ .
(2)N、H、O三种元素的电负性由大到小的顺序为_____________ .
(3)上述方程式中涉及的元素中属于P区元素的是_____________ (填元素符号).
(4) 的空间结构为
的空间结构为_____________ .
(5)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被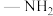 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有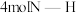 键断裂,则形成的
键断裂,则形成的 键有
键有_____________  .
.
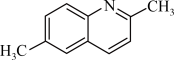
(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为_____________ ,C原子的杂化方式为_____________ .
 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,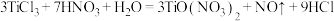 .回答下列问题:
.回答下列问题:(1)基态钛原子的核外电子排布式为
(2)N、H、O三种元素的电负性由大到小的顺序为
(3)上述方程式中涉及的元素中属于P区元素的是
(4)
 的空间结构为
的空间结构为(5)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被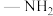 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有 键断裂,则形成的
键断裂,则形成的 键有
键有 .
.(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为
您最近一年使用:0次
2024-04-04更新
|
99次组卷
|
2卷引用:吉林省长春市第二实验中学2023-2024学年高二下学期期中考试化学试题
解题方法
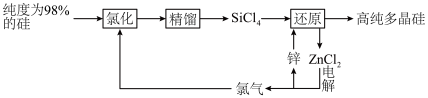
10 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在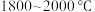 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成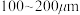 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯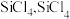 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗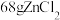 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在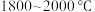 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
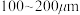 的粉末,这样做的目的是
的粉末,这样做的目的是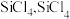 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于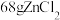 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
39次组卷
|
2卷引用:吉林省长春市榆树市第一高级中学校等五校2023-2024学年高一下学期期中考试联考化学试题



