名校
解题方法
1 . 工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
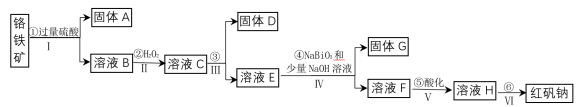
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
回答下列问题:
(1)固体A的成分是____________ 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和_______ 、______ (填仪器名称)。
(3)③为加入物质来调节溶液的pH,则pH的合适范围是_______ 。
(4)写出④反应的离子方程式_____________________________ 。
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式_________________ 。
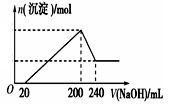
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________ ,固体D中含Fe化合物的物质的量为___________ 。

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
| 物质 | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr(OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)固体A的成分是
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和
(3)③为加入物质来调节溶液的pH,则pH的合适范围是
(4)写出④反应的离子方程式
(5)⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为

您最近一年使用:0次
名校
解题方法
2 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)_____ 。
(2)装置B的作用是除杂,所用试剂为______ 。
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:____ ,此反应表明:氧化性Cl2____  (填“>”或“<”)。
(填“>”或“<”)。
(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):_____ 。
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是_____ 。
(6)此实验得出Cl2和 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是___ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)
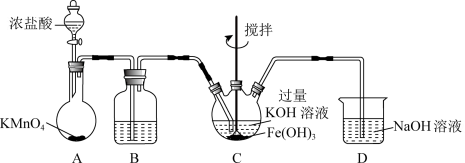
(2)装置B的作用是除杂,所用试剂为
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:
 (填“>”或“<”)。
(填“>”或“<”)。(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是
 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是(6)此实验得出Cl2和
 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次
2020-10-24更新
|
726次组卷
|
3卷引用:吉林省辽源市第五中学2019-2020学年高一下学期期中考试化学试题
名校
解题方法
3 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
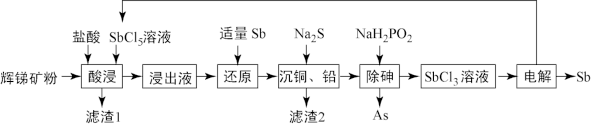
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1112次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
名校
解题方法
4 . 随着小型电子设备以及新能源汽车产业的蓬勃发展,退役锂离子电池数量逐年递增,废旧锂离子电池的回收成为目前新能源产业重要的发展方向,科研人员通过对大量废旧钴酸锂( )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
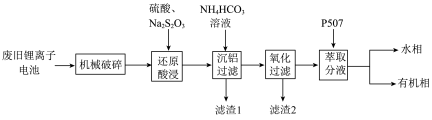
表1 粉料金属成分质量分数%
表2 部分阳离子以氢氧化物形式沉淀时溶液的
已知:Co(III)有较强氧化性, 有较强还原性。
有较强还原性。
(1)机械破碎的目的是_______
(2)还原酸浸的主要反应中 和
和 的物质的量之比为
的物质的量之比为_______
(3)沉铝操作中,加入 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分_______ 、_______ 。
(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:① 氧化成
氧化成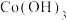 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②_______
(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为_______ 左右。

(6)该工艺中,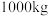 废料生产得到
废料生产得到 的质量为
的质量为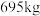 ,则该工艺的产率为
,则该工艺的产率为_______ (保留2位有效数字)。
 )电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
)电池进行手工拆壳、电池芯粉碎、筛分得到混合粉料(成分分析见表1),并成功制得了草酸钴,其流程如下:
表1 粉料金属成分质量分数%
| Co | Li | Al | Cu | Fe | Mn | Ni |
| 23.6 | 3.4 | 3.2 | 0.84 | 2.8 | 1.1 | 0.34 |

| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 | 4.7 |
完全沉淀的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 | 6.7 |
 有较强还原性。
有较强还原性。(1)机械破碎的目的是
(2)还原酸浸的主要反应中
 和
和 的物质的量之比为
的物质的量之比为(3)沉铝操作中,加入
 溶液调节溶液
溶液调节溶液 ,根据题中所给数据,分析滤渣1的主要成分
,根据题中所给数据,分析滤渣1的主要成分(4)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的
 在4—5,加入
在4—5,加入 溶液。写出其中沉铁的离子方程式
溶液。写出其中沉铁的离子方程式 氧化成
氧化成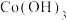 沉淀而增大钴的损失率;②
沉淀而增大钴的损失率;②(5)P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,下图为水相
 对不同离子萃取率的影响曲线,水相合适的
对不同离子萃取率的影响曲线,水相合适的 为
为
(6)该工艺中,
 废料生产得到
废料生产得到 的质量为
的质量为 ,则该工艺的产率为
,则该工艺的产率为
您最近一年使用:0次
2023-12-05更新
|
869次组卷
|
3卷引用:吉林省长春市东北师大附中2023-2024学年高三上学期第三次摸底考试化学科试卷
5 . 化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如
(1)化合物A存在顺反异构,写出A的结构简式______________ 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________ 。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是___________ (填字母) 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸(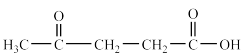 )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为_____________ 。
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
①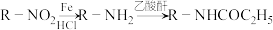
② 具有较强的还原性
具有较强的还原性
回答下列问题:
(5)B的结构简式为______________ ,F中含氧官能团的名称为______________ 。
(6)D→E转化需加入的试剂为___________ 。设计C→D步骤的目的是________________ 。
(7)M→N反应的化学方程式为______________ 。
(8)通过N、F合成P的反应属类型为_____________ ,合成过程中还需加入适量 可提高产率原因为
可提高产率原因为______________ 。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如: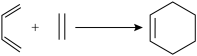
 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如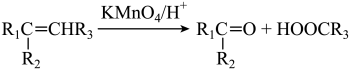 。
。
(1)化合物A存在顺反异构,写出A的结构简式
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是
a.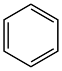 b.
b.  c.
c. d.
d.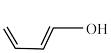
 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸( )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
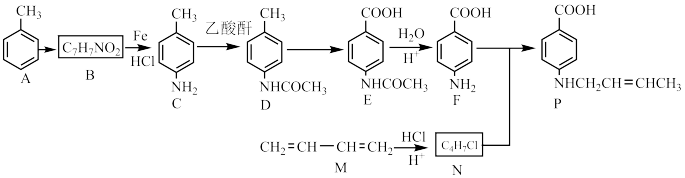
①
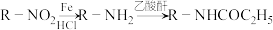
②
 具有较强的还原性
具有较强的还原性回答下列问题:
(5)B的结构简式为
(6)D→E转化需加入的试剂为
(7)M→N反应的化学方程式为
(8)通过N、F合成P的反应属类型为
 可提高产率原因为
可提高产率原因为
您最近一年使用:0次
6 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
615次组卷
|
2卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
解题方法
7 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 铁的氢氧化物溶于足量HI溶液中,滴加KSCN溶液 | 固体溶解,溶液未变红色 | 铁的氢氧化物一定为 Fe(OH)2 |
| B | 向硝酸钡溶液中通入SO2 | 产生白色沉淀 | 硝酸钡溶液与SO2反应生 成BaSO3白色沉淀 |
| C | 铜丝在酒精灯外焰灼烧,再将赤热 铜丝插入酒精灯内焰 | 铜丝由红色变黑色, 再变红色 | 乙醇具有还原性 |
| D | 浓度均为 0.lmol·L-1 的 CuCl2,FeCl3 混合溶液中滴加0.lmol∙L-1NaOH溶液 | 先生成红褐色沉淀 | 氧化性:Fe3+>Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-09更新
|
1141次组卷
|
4卷引用:吉林省吉林市第一中学2021-2022学年高三下学期第一次月考理科综合化学试题
名校
解题方法
8 . 高铁酸钾(K2FeO4)易溶于水,受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种制法的主要步骤如图1所示(方框内为主产物)。
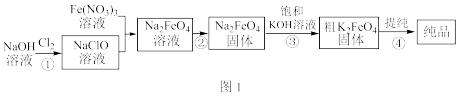
回答下列问题:
(1)NaClO溶液与Fe(NO3)3溶液反应的离子方程式是______ 。
(2)已知K2FeO4在水溶液中易水解:4 + 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、
+ 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、____ (填“高温”或“低温”)烘干的方法,则洗涤剂最好选用___ (填“酸性”“碱性”或“中性”)溶液和______ (填“水”或“有机溶剂”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图2为不同的反应温度下,Fe(NO3)3质量浓度对K2FeO4生成率的影响;
图3为一定温度下,最佳Fe(NO3)3质量浓度时,NaClO的质量浓度对K2FeO4生成率的影响。

工业生产中最佳反应温度为____ °C,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比___ 。
(4)用高铁酸钾处理污水,能去污、杀菌、消毒,且高铁酸钾自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现有两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30 mgK2FeO4,相同温度下最终去除效果如表。
已知化学需氧量(COD)是在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧的毫克数,以mg·L-1表示。该指标也作为污水中有机物相对含量的综合指标之一。含甲苯的1 L污水,当甲苯去除率为73.24%时,理论上需高铁酸钾_____ mg。[已知M(K2FeO4)=198 g/ mol]。理论上需要的m(K2FeO4)大于实际用量,说明K2FeO4去除有机污水的原理除了氧化作用外,另一个原因可能是_______ 。
(5)工业上通过电解浓NaOH溶液制备K2FeO4,其工作原理如图4所示,阳极的电极反应式为_________ ,其中可循环使用的物质是_________________ 。
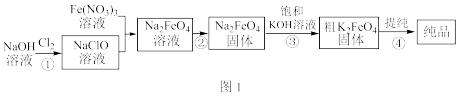
回答下列问题:
(1)NaClO溶液与Fe(NO3)3溶液反应的离子方程式是
(2)已知K2FeO4在水溶液中易水解:4
 + 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、
+ 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图2为不同的反应温度下,Fe(NO3)3质量浓度对K2FeO4生成率的影响;
图3为一定温度下,最佳Fe(NO3)3质量浓度时,NaClO的质量浓度对K2FeO4生成率的影响。

工业生产中最佳反应温度为
(4)用高铁酸钾处理污水,能去污、杀菌、消毒,且高铁酸钾自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现有两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30 mgK2FeO4,相同温度下最终去除效果如表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1 124 | 1 966 |
处理后COD/( mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73. 24 |
已知化学需氧量(COD)是在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧的毫克数,以mg·L-1表示。该指标也作为污水中有机物相对含量的综合指标之一。含甲苯的1 L污水,当甲苯去除率为73.24%时,理论上需高铁酸钾
(5)工业上通过电解浓NaOH溶液制备K2FeO4,其工作原理如图4所示,阳极的电极反应式为
您最近一年使用:0次
9 . 某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
(1)怎样配制FeCl3溶液? ________________________________________________________ 。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________ ,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________ 。
(3)实验I中负极的电极反应式为______________________________________________________ 。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3- Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②_____________________________________________ 。
(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________ 。
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________ 有关(写出两条)。
【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
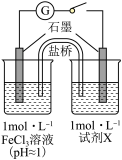 | I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入
② 该同学又设计实验探究另一电极的产物,其实验方案为
(3)实验I中负极的电极反应式为
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
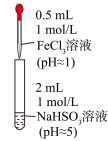 | III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
① Fe3++3HSO3-
 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:
【实验反思】
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和
您最近一年使用:0次
2020-03-28更新
|
374次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2022-2023学年高二下学期7月期末考试化学试题
10 . 实验室为探究铁与足量浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是
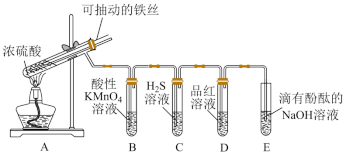
| A.常温下,可以用铁制容器盛装浓硫酸 |
| B.B中溶液紫色褪去,C中生成淡黄色沉淀,均体现了SO2的还原性 |
| C.D中品红溶液褪色,体现了SO2的漂白性 |
| D.E中溶液红色变浅,体现了SO2酸性氧化物的性质 |
您最近一年使用:0次



