名校
解题方法
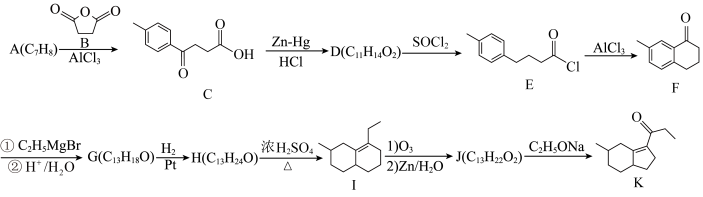
1 . 化合物K常用作医药中间体、材料中间体,其合成路线如图所示。
(1)检验苯中含有A的化学试剂为______ 。
(2)C→D的反应类型为______ ;G的结构简式为______ 。
(3)H→I的化学方程式为______ 。
(4)D的同分异构体中,仅含有-OOCCH3,-CH3和苯环结构的有______ 种(不考虑立体异构)。
(5)根据上述信息,写出合成路线中M和N结构简式:M______ N______ 。
(1)检验苯中含有A的化学试剂为
(2)C→D的反应类型为
(3)H→I的化学方程式为
(4)D的同分异构体中,仅含有-OOCCH3,-CH3和苯环结构的有
(5)根据上述信息,写出合成路线中M和N结构简式:M
您最近一年使用:0次
名校
解题方法
2 . 自分子识别兴起以来,冠醚、杯酚烃等的合成引起了研究者的广泛关注。硫代杯[4]芳烃已被应用于许多方面,如监测和分离一些阴阳离子等。
I.向500mL三颈烧瓶(加热、搅拌、夹持等装置省略)中加入60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚。
II.在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。
III.停止加热并冷却至100℃以下后,加入40mL6mol/L的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。
IV.将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。
回答下列问题:
(1)仪器A的名称是______ ,其作用是______ 。
(2)对叔丁基邻苯二酚(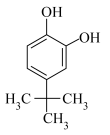 )的沸点
)的沸点______ 2—叔丁基对苯二酚( )(填“低于”、“高于”或“等于”),原因是
)(填“低于”、“高于”或“等于”),原因是______ 。
(3)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是______ 。
(4)实验过程中会产生一种有毒气体,尾气吸收装置中应用______ (填试剂名称)。
(5)本实验的产率为______ (计算结果精确到0.1%)。
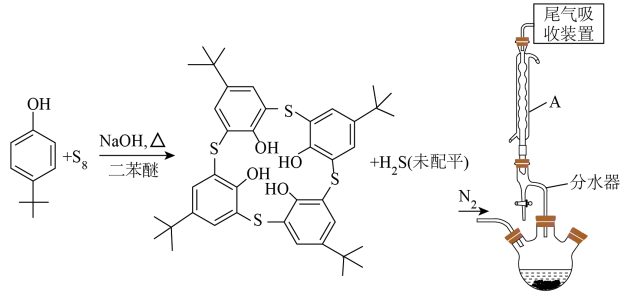
I.向500mL三颈烧瓶(加热、搅拌、夹持等装置省略)中加入60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚。
II.在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。
III.停止加热并冷却至100℃以下后,加入40mL6mol/L的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。
IV.将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。
回答下列问题:
(1)仪器A的名称是
(2)对叔丁基邻苯二酚(
 )的沸点
)的沸点 )(填“低于”、“高于”或“等于”),原因是
)(填“低于”、“高于”或“等于”),原因是(3)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是
(4)实验过程中会产生一种有毒气体,尾气吸收装置中应用
(5)本实验的产率为
您最近一年使用:0次
名校
3 .  还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
Ⅰ:

Ⅱ: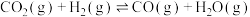

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(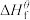 )
)


______ 
(2)有利于提高CO平衡产率的条件是______(填标号)。
(3)反应Ⅰ的正、逆反应速率方程为: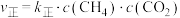 、
、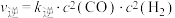 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式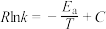 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能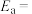
______  ,升高温度
,升高温度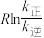 的值
的值______ (填“增大”“减小”或“不变”)。 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为______ ,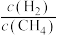 的值
的值______ (填“增大”“减小”或“不变”)。
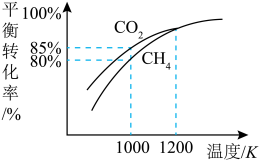
(5)在101kPa时,工业上按投料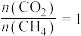 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是______ ;计算1000 K时反应Ⅱ的压强平衡常数
______ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
 还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:
还原CO2是实现“双碱”经济的有效途径之一,涉及反应如下:Ⅰ:


Ⅱ:
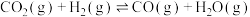

回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
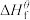 )
)


物质 |
|
|
|
|
|
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
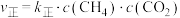 、
、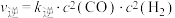 ,
, 、
、 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式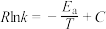 (
( 为活化能:T为温度:R、c为常数),实验测得
为活化能:T为温度:R、c为常数),实验测得 的实验数据如图所示,则正反应的活化能
的实验数据如图所示,则正反应的活化能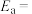
 ,升高温度
,升高温度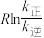 的值
的值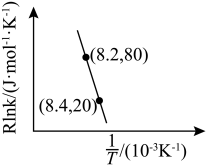
 而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为
而产生积碳,从而导致催化剂活性降低。若向容器中通入过量水蒸气可以清除积碳.反应的化学方程式为 的值
的值(5)在101kPa时,工业上按投料
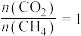 加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应,
加入刚性密闭容器中,只发生Ⅰ、Ⅱ两个反应, 和
和 的平衡转化率与温度的关系如图所示.温度高于1200 K时,
的平衡转化率与温度的关系如图所示.温度高于1200 K时, 和
和 的平衡转化率趋于相等的原因可能是
的平衡转化率趋于相等的原因可能是
您最近一年使用:0次
2024-06-02更新
|
223次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期三模化学试题
名校
解题方法
4 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:___________ ;向混合溶液中通入热空气的反应的离子方程式是___________ ;可循环利用的物质是___________ (填化学式)。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:___________ 。(氨水用“NH3·H2O”表示)
②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是___________ 。
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标
①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程___________ 。
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的___________ (填字母)。
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
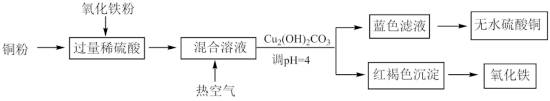
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水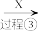 达标
达标①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
您最近一年使用:0次
2024-05-03更新
|
195次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期5月期中考试化学试题
解题方法
5 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将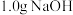 溶于
溶于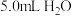 中,添加
中,添加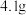 丁香酚,在
丁香酚,在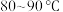 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在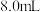 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在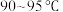 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
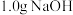 溶于
溶于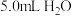 中,添加
中,添加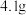 丁香酚,在
丁香酚,在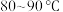 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在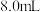 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
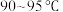 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
解题方法
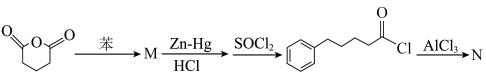
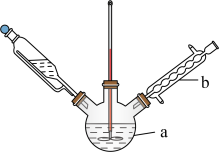
6 . 氢能作为清洁能源是最佳碳中和能源载体,为应对气候变化全球掀起了氢能发展热潮,制备氢气有多种途径。
I.甲醇产生氢气的反应为:
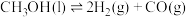
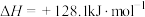
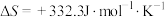
(1) 时,该反应能否自发进行
时,该反应能否自发进行___________ (填“能”或“否”)。
II.乙酸制氢过程发生如下反应:
反应1: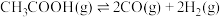
反应2: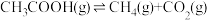
(2)已知反应: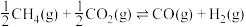

___________  ;
;
②恒温恒容下发生上述反应,下列说法正确的是___________ 。
A.混合气体密度不变时,反应达到平衡 B.充入 ,可提高
,可提高 的平衡转化率
的平衡转化率
C.加入催化剂,可提高 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变
(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,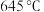 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是___________ (答出一点即可)。 ,乙酸体积分数为
,乙酸体积分数为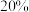 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的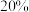 ,则反应2的平衡常数
,则反应2的平衡常数 为
为___________ (用平衡分压代替平衡浓度计算)。
III.热分解也可制氢,其原理为: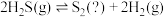 。
。
(5)不同温度和压强下, 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为___________ (填“气态”或“非气态”),
___________ 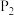 (填“>”或“<”)。
(填“>”或“<”)。
I.甲醇产生氢气的反应为:
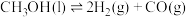
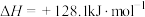
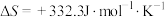
(1)
 时,该反应能否自发进行
时,该反应能否自发进行II.乙酸制氢过程发生如下反应:
反应1:
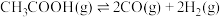
反应2:
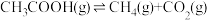
(2)已知反应:
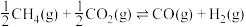


 ;
;②恒温恒容下发生上述反应,下列说法正确的是
A.混合气体密度不变时,反应达到平衡 B.充入
 ,可提高
,可提高 的平衡转化率
的平衡转化率C.加入催化剂,可提高
 的平衡产率 D.充入
的平衡产率 D.充入 ,平衡常数保持不变
,平衡常数保持不变(3)在容积相同的密闭容器中,加入等量乙酸蒸气(只发生反应1和反应2),在相同反应时间测得温度与气体产率的关系如图所示,
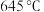 之前,氢气产率低于甲烷的可能原因是
之前,氢气产率低于甲烷的可能原因是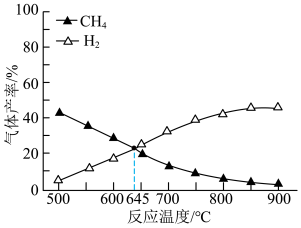
 ,乙酸体积分数为
,乙酸体积分数为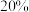 ,反应1消耗的乙酸占投入量的
,反应1消耗的乙酸占投入量的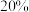 ,则反应2的平衡常数
,则反应2的平衡常数 为
为III.热分解也可制氢,其原理为:
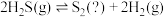 。
。(5)不同温度和压强下,
 的平衡转化率变化如下图,生成物
的平衡转化率变化如下图,生成物 的状态为
的状态为
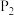 (填“>”或“<”)。
(填“>”或“<”)。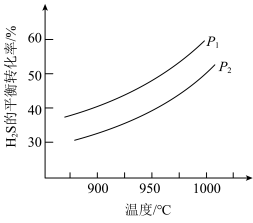
您最近一年使用:0次
名校
7 . D为芳香族化合物,有机物M可由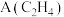 按如图路线合成:
按如图路线合成:
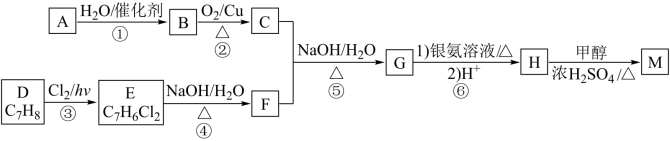
已知:
i.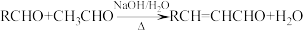
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是_________ ,F中含有的官能团名称是__________________ 。
(2)③的反应类型是__________________ 。
(3)H的结构简式是___________________________ 。
(4)反应④的化学方程式是____________________________________ 。
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链, 的L可与
的L可与 的
的 反应,L共有
反应,L共有_________ 种(不考虑立体异构):其中核磁共振氢谱为六组峰,峰面积比为 的结构简式是
的结构简式是__________________ (任写一种)。
(6)参照上述合成路线,设计以C为原料制备高吸水性树脂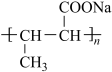 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)____________________________________ 。
 按如图路线合成:
按如图路线合成:
已知:
i.
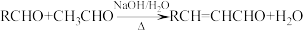
ii.同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。
iii.C、F均能发生银镜反应。
回答下列问题:
(1)A的名称是
(2)③的反应类型是
(3)H的结构简式是
(4)反应④的化学方程式是
(5)L是M的同分异构体,分子中除含有1个苯环外无其他环状结构,且苯环上只有一个侧链,
 的L可与
的L可与 的
的 反应,L共有
反应,L共有 的结构简式是
的结构简式是(6)参照上述合成路线,设计以C为原料制备高吸水性树脂
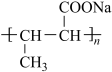 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
名校
8 . 为检测某品牌银耳中添加剂亚硫酸盐的含量,取 银耳样品和
银耳样品和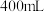 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了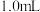 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是
 银耳样品和
银耳样品和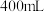 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了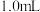 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是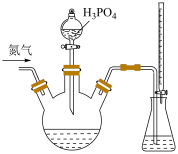
A.选择的三颈瓶规格为 |
| B.滴定终点溶液变为蓝色,读数时应双手上下持滴定管 |
| C.“不通氮气”或者“先加磷酸再通氮气”,这两种做法都会使测定结果偏高 |
D.银耳样品中亚硫酸盐的百分含量(以 质量计)为 质量计)为 |
您最近一年使用:0次
2024-02-06更新
|
355次组卷
|
5卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
9 . 环丙沙星是喹诺酮类抗菌药物,具有广谱抗菌活性,杀菌效果好,某研究小组按下列路线合成环丙沙星(H)。
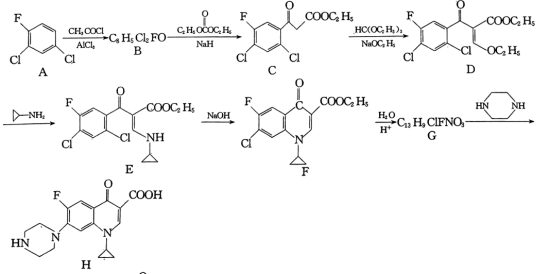
已知:RCOCH3

回答下列问题:
(1)B的结构简式是___________ 。
(2)C中含氧官能团名称是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)E→F的反应类型为___________ 。
(5)A的芳香族同分异构体有___________ 种(本身除外);写出符合下列要求的G的同分异构体的结构简式:___________ 。
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以 和
和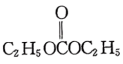 为原料合成
为原料合成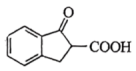 的路线图为:
的路线图为:
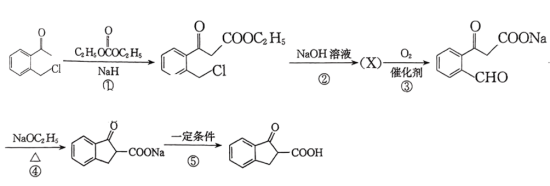
则X的结构简式为___________ ;反应⑤中的一定条件是指___________ 。

已知:RCOCH3


回答下列问题:
(1)B的结构简式是
(2)C中含氧官能团名称是
(3)写出D→E的化学方程式:
(4)E→F的反应类型为
(5)A的芳香族同分异构体有
①分子中含有2个苯环;
②lH-NMR谱表明:分子中共有5种不同化学环境的氢原子且数目之比为2:2:2:2:1;
③能与FeCl3溶液发生显色反应,且两种水解产物同样可以与FeCl3溶液发生显色反应。
(6)以
 和
和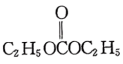 为原料合成
为原料合成 的路线图为:
的路线图为:
则X的结构简式为
您最近一年使用:0次
名校
10 .  (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。
(1)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
(2)25℃,亚磷酸溶液中的 、
、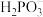 、
、 的物质的量分数
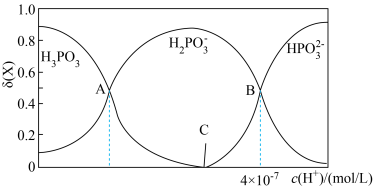
的物质的量分数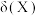 随
随 的变化如图所示。已知:
的变化如图所示。已知: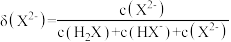 。
。
①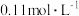 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为_______ ( 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。
②图像中C点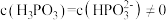 ,那C点对应的
,那C点对应的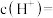
_______  。
。
③A、B、C三点水的电离程度由大到小的顺序为_______ 。
④浓度均为 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中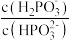 将
将_______ (填“增大”“不变”或“减小”)。
(3)亚磷酸可用电解 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
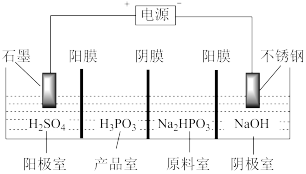
①阴极室的电极反应式为_______ 。
②产品室中发生反应生成产品的总的离子方程式为_______ 。
 (亚磷酸)主要用作制造塑料稳定剂的原料。
(亚磷酸)主要用作制造塑料稳定剂的原料。(1)已知
 。
。 属于
属于 属于
属于(2)25℃,亚磷酸溶液中的
 、
、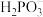 、
、 的物质的量分数
的物质的量分数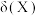 随
随 的变化如图所示。已知:
的变化如图所示。已知: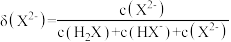 。
。
①
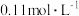 的
的 溶液的pH为2,
溶液的pH为2, 的电离平衡常数
的电离平衡常数 约为
约为 的后续电离和水的电离忽略不计)。
的后续电离和水的电离忽略不计)。②图像中C点
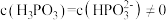 ,那C点对应的
,那C点对应的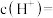
 。
。③A、B、C三点水的电离程度由大到小的顺序为
④浓度均为
 的
的 和
和 的溶液混合,加水稀释10倍后的溶液中
的溶液混合,加水稀释10倍后的溶液中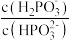 将
将(3)亚磷酸可用电解
 溶液来制得,装置如图所示:
溶液来制得,装置如图所示:
①阴极室的电极反应式为
②产品室中发生反应生成产品的总的离子方程式为
您最近一年使用:0次