名校
1 . 最近,Schmidt及其同事开发了一种由Pd配合物催化的简单、高效合成螺环己二烯酮的方法,具体反应如右图(部分反应条件和产物省略)。下列说法错误是
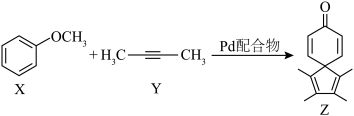
| A.X与对甲基苯酚互为同分异构体 |
| B.Z中σ键与π键的个数比为16:5 |
| C.Y与HBr加成最多得3种卤代烃(不考虑立体异构) |
| D.1molZ与足量氢气加成,最多消耗5mol氢气 |
您最近一年使用:0次
昨日更新
|
205次组卷
|
2卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
名校
2 . 西沙群岛软珊瑚中存在多种朵蕾烷二萜类海洋天然产物,结构简式如图所示,具有较强抗菌、抗肿瘤等生物活性。下列关于该二萜类化合物的说法正确的是
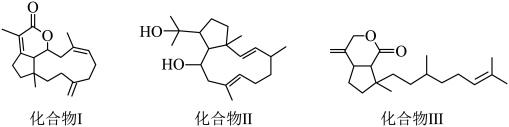
| A.化合物Ⅰ、Ⅱ、Ⅲ均属于芳香族化合物 |
B.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ最多消耗 的物质的量之比为3:2:2 的物质的量之比为3:2:2 |
| C.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ中含有手性碳原子的个数比为1:3:2 |
| D.化合物Ⅱ、Ⅲ均能发生加成反应、氧化反应、取代反应和消去反应 |
您最近一年使用:0次
名校
3 . A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料G和高分子材料H的流程如下:
(1)A的结构简式为___________ ,A→H的反应类型为___________ 。
(2)C中的官能团名称为___________ 。
(3) 的结构式如图所示,
的结构式如图所示, 在反应②中断裂的化学键是
在反应②中断裂的化学键是___________ (填序号)。___________ 。
(5)写出G的结构简式___________ 。
(6)有关上述物质的说法错误的是___________ 。
a.反应④的反应类型为加成反应
b.B可以与酸性重铬酸钾溶液反应生成D
c.C和E互为同分异构体
d.H可以使溴水褪色
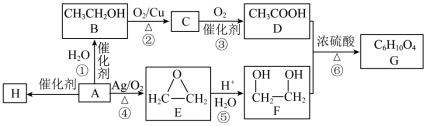
(1)A的结构简式为
(2)C中的官能团名称为
(3)
 的结构式如图所示,
的结构式如图所示, 在反应②中断裂的化学键是
在反应②中断裂的化学键是
(5)写出G的结构简式
(6)有关上述物质的说法错误的是
a.反应④的反应类型为加成反应
b.B可以与酸性重铬酸钾溶液反应生成D
c.C和E互为同分异构体
d.H可以使溴水褪色
您最近一年使用:0次
名校
解题方法
4 . 钪(Sc)是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪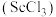 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下: 难溶于盐酸。
难溶于盐酸。
②常温下,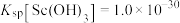 ,
, 。
。
回答下列问题:
(1)某次实验中需要使用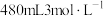 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为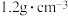 ,质量分数为
,质量分数为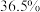 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为___________  。
。
(2)滤渣1的主要成分是___________ (填化学式)。“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)常温下,“调 ”时,溶液中
”时,溶液中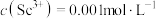 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是___________ (当溶液中某离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。
(4)“氧化”时反应的离子方程式为___________ 。
(5)实验室模拟流程中“灼烧”得到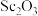 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为___________ ,“加热氯化”步骤中所加入焦炭过量,写出由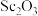 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:___________ 。
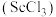 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下:
 难溶于盐酸。
难溶于盐酸。②常温下,
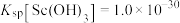 ,
, 。
。回答下列问题:
(1)某次实验中需要使用
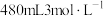 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为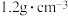 ,质量分数为
,质量分数为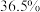 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为 。
。(2)滤渣1的主要成分是
(3)常温下,“调
 ”时,溶液中
”时,溶液中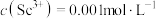 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是(4)“氧化”时反应的离子方程式为
(5)实验室模拟流程中“灼烧”得到
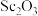 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为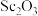 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 肉桂酸广泛应用于香精香料、食品添加剂、医药工业、美容和有机合成等方面。其合成原理及实验室制备方法如下:
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。
V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。
回答下列问题:
(1)仪器使用前必须干燥,原因是___________ 。
(2)加热回流装置中仪器a的名称是___________ ,不使用水冷冷凝管而用空气冷凝管是为了___________ 。
(3)整个实验过程中温度不宜超过180℃,原因是___________ 。
(4)水蒸气蒸馏装置中止水夹的主要作用是___________ 。
(5)步骤V中试剂b是___________ 。
(6)本实验肉桂酸的产率最接近___________ (填标号)。若产物不纯,则提纯产物的方法为___________ 。
A.50% B.60% C.70% D.80%
主反应:
温度较高时发生副反应: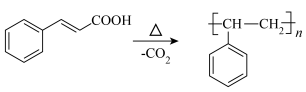
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL
 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。

| 名称 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解度:g/100mL | ||
| 水 | 醇 | 醚 | |||||
| 苯甲醛 | 106 | 1.04 | -26 | 178~179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 1.08 | -79 | 138~140 | 遇水生成乙酸 | 溶 | 不溶 |
| 肉桂 | 148 | 1.24 | 133~134 | 300 | 0.04 | 24 | 溶 |
(1)仪器使用前必须干燥,原因是
(2)加热回流装置中仪器a的名称是
(3)整个实验过程中温度不宜超过180℃,原因是
(4)水蒸气蒸馏装置中止水夹的主要作用是
(5)步骤V中试剂b是
(6)本实验肉桂酸的产率最接近
A.50% B.60% C.70% D.80%
您最近一年使用:0次
6 . 氮氧化物( 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。
(1)反应 分为三步基元反应完成。
分为三步基元反应完成。
第一步: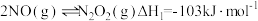 决速步骤)
决速步骤)
第二步: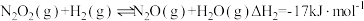
①活化能最高的是第___________ 步。
②为了提高总反应中NO的反应速率和转化率可采用的措施为___________ (写两条)。
(2)已知反应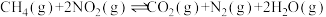 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入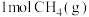 和
和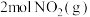 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
①用 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为___________ 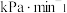 。
。
②该温度下的压强平衡常数
___________ kPa。
(3)NO催化分解ICl制取 和
和 的原理为:
的原理为:
反应I: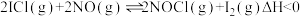 ;
;
反应Ⅱ: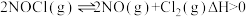 ;
; 。
。
反应的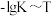 的关系如图所示。
的关系如图所示。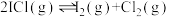 的
的
___________
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。 的电极反应式为
的电极反应式为___________ 。
②当电解电压为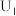 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。(1)反应
 分为三步基元反应完成。
分为三步基元反应完成。第一步:
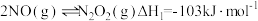 决速步骤)
决速步骤)第二步:
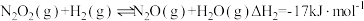
①活化能最高的是第
②为了提高总反应中NO的反应速率和转化率可采用的措施为
(2)已知反应
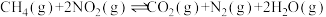 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入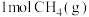 和
和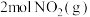 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
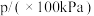 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为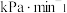 。
。②该温度下的压强平衡常数

(3)NO催化分解ICl制取
 和
和 的原理为:
的原理为:反应I:
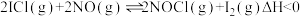 ;
;
反应Ⅱ:
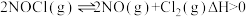 ;
; 。
。反应的
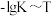 的关系如图所示。
的关系如图所示。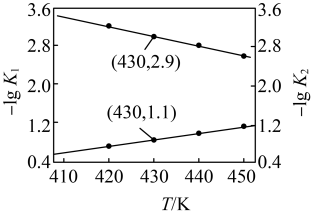
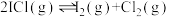 的
的
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为
 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
 的电极反应式为
的电极反应式为②当电解电压为
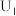 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . 按要求回答下列问题:
对甲氧基苯丙酰胺(相对分子质量为179)为难溶于冷水的白色晶体,且是一种医药中间体,可以由苯甲醚通过两步反应合成,合成路线如图1所示。
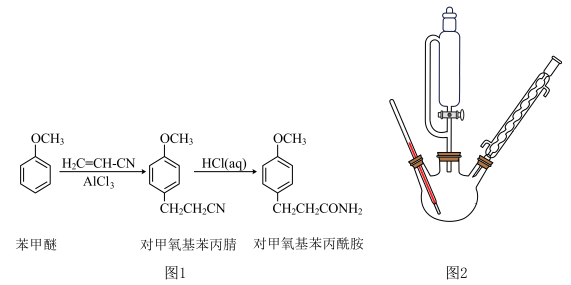
步骤一:用如图2所示装置合成对甲氧基苯丙腈
在500 mL三颈烧瓶中,加入108 g(1 mol)苯甲醚,室温下缓慢加入70 g(约0.52 mol)粉末状三氯化铝,加入过程中温度不超过25℃,加完后降温至5℃,然后逐滴加入130 g(约2.45 mol)丙烯腈(沸点77℃),滴加结束后再升温至90~95℃,反应2 h。将反应液倒入500 g冰水中,搅匀,静置分层,分出油相。减压蒸馏,收集2.67 kPa下150~160℃的馏分,得到对甲氧基苯丙腈。
步骤二:合成对甲氧基苯丙酰胺
将步骤一中合成的对甲氧基苯丙腈加入500 mL三颈烧瓶中,加入300 mL浓盐酸,再经过一系列操作后得到对甲氧基苯丙酰胺133.7 g。
(1)苯甲醚生成对甲氧基苯丙腈的反应类型为________________ 。
(2)对甲氧基苯丙腈的合成过程中宜采用的加热方式为________________ ,采取减压蒸馏收集对甲氧基苯丙腈的优点是________________________ 。
(3)图2中合成对甲氧基苯丙腈的装置有一缺陷,请提出改进方法并说明理由:________ 。
(4)用恒压滴液漏斗加丙烯腈的优点有________________ 、________________ (写出两条)。
(5)下列操作为合成对甲氧基苯丙酰胺的过程中加浓盐酸后的一系列操作,其合理顺序为__________ 。
①加入活性炭回流0.5 h ②趁热过滤 ③抽滤 ④升温至40~50℃,搅拌1 h ⑤将滤液慢慢倒入1000 g冷水中,析出晶体 ⑥洗涤、烘干
(6)下列关于实验操作的说法错误的是__________ 。
B.在对甲氧基苯丙酰胺的合成过程中,析出的晶体可以用冷水洗涤
C.减压过滤不宜用于过滤颗粒太小的沉淀,因为颗粒太小的沉淀在快速过滤时易透过滤纸
(7)本实验中对甲氧基苯丙酰胺的产率为________________________ %(保留两位小数)。
对甲氧基苯丙酰胺(相对分子质量为179)为难溶于冷水的白色晶体,且是一种医药中间体,可以由苯甲醚通过两步反应合成,合成路线如图1所示。
步骤一:用如图2所示装置合成对甲氧基苯丙腈
在500 mL三颈烧瓶中,加入108 g(1 mol)苯甲醚,室温下缓慢加入70 g(约0.52 mol)粉末状三氯化铝,加入过程中温度不超过25℃,加完后降温至5℃,然后逐滴加入130 g(约2.45 mol)丙烯腈(沸点77℃),滴加结束后再升温至90~95℃,反应2 h。将反应液倒入500 g冰水中,搅匀,静置分层,分出油相。减压蒸馏,收集2.67 kPa下150~160℃的馏分,得到对甲氧基苯丙腈。
步骤二:合成对甲氧基苯丙酰胺
将步骤一中合成的对甲氧基苯丙腈加入500 mL三颈烧瓶中,加入300 mL浓盐酸,再经过一系列操作后得到对甲氧基苯丙酰胺133.7 g。
(1)苯甲醚生成对甲氧基苯丙腈的反应类型为
(2)对甲氧基苯丙腈的合成过程中宜采用的加热方式为
(3)图2中合成对甲氧基苯丙腈的装置有一缺陷,请提出改进方法并说明理由:
(4)用恒压滴液漏斗加丙烯腈的优点有
(5)下列操作为合成对甲氧基苯丙酰胺的过程中加浓盐酸后的一系列操作,其合理顺序为
①加入活性炭回流0.5 h ②趁热过滤 ③抽滤 ④升温至40~50℃,搅拌1 h ⑤将滤液慢慢倒入1000 g冷水中,析出晶体 ⑥洗涤、烘干
(6)下列关于实验操作的说法错误的是
B.在对甲氧基苯丙酰胺的合成过程中,析出的晶体可以用冷水洗涤
C.减压过滤不宜用于过滤颗粒太小的沉淀,因为颗粒太小的沉淀在快速过滤时易透过滤纸
(7)本实验中对甲氧基苯丙酰胺的产率为
您最近一年使用:0次
名校
解题方法
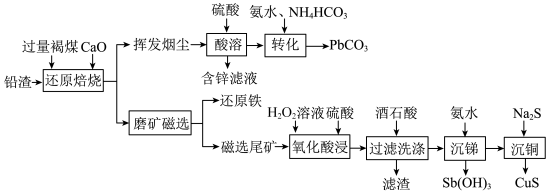
8 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下:________________ 。
(2)挥发烟尘中的主要氧化物为PbO—ZnO2。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为__________ (填选项)。
A.核磁共振氢谱 B.X射线衍射 C.质谱法
②“转化”过程中,发生反应的化学方程式为________________ 。
(3)“氧化酸浸”过程中,若将物质的量为3mol的Cu—Sb合金(其中Cu与Sb物质的量之比为1∶2)氧化,至少需要H2O2的物质的量为________ mol。
(4)“过滤洗涤”过程中,加入酒石酸(表示为C4H6O6)发生如下配位反应:
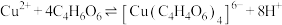 、
、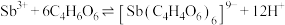
①上述两个配合物中,提供空轨道的元素为____________ (填元素符号)。
②滤渣的主要成分是_____________________ 。
③“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为______________________ 。
(2)挥发烟尘中的主要氧化物为PbO—ZnO2。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为
A.核磁共振氢谱 B.X射线衍射 C.质谱法
②“转化”过程中,发生反应的化学方程式为
(3)“氧化酸浸”过程中,若将物质的量为3mol的Cu—Sb合金(其中Cu与Sb物质的量之比为1∶2)氧化,至少需要H2O2的物质的量为
(4)“过滤洗涤”过程中,加入酒石酸(表示为C4H6O6)发生如下配位反应:
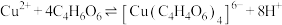 、
、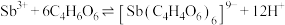
①上述两个配合物中,提供空轨道的元素为
②滤渣的主要成分是
③“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
您最近一年使用:0次
名校
9 . 标准状况下,将SO2和Cl2组成的混合气体amol通入200mL Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是| A.0.06 | B.0.07 | C.0.08 | D.0.09 |
您最近一年使用:0次
名校
解题方法
10 . 铟(In)是制造半导体、电光源等的重要原料。从铜冶炼过程中产生的铟砷烟灰(主要含有 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: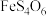 为强电解质;
为强电解质;
②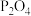 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为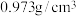 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;
③ 。
。
回答下列问题:
(1)滤渣的主要成分除 外还有
外还有___________ 、___________ (填化学式);“氧化酸浸”过程中, 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:___________ 。
(2)“还原铁”时反应的离子方程式为___________ 。
(3)“萃取除铁”时,用 的
的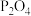 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是___________ (用平衡移动原理解释);反萃取时萃余液应从分液漏斗的___________ (填“下口放出”或“上口倒出”)。
(4)“萃取”过程中也可用酸(用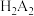 表示)作萃取剂,使
表示)作萃取剂,使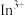 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率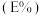 的关系符合公式:
的关系符合公式: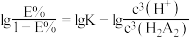 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
___________ (已知 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)整个工艺流程中,可循环利用的物质是___________ 。
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫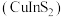 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的___________ (填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。
 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: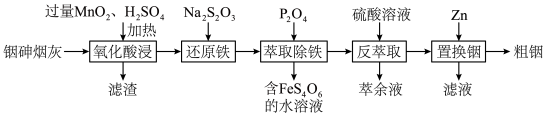
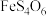 为强电解质;
为强电解质;②
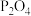 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为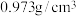 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;③
 。
。回答下列问题:
(1)滤渣的主要成分除
 外还有
外还有 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:(2)“还原铁”时反应的离子方程式为
(3)“萃取除铁”时,用
 的
的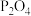 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(4)“萃取”过程中也可用酸(用
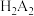 表示)作萃取剂,使
表示)作萃取剂,使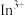 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率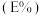 的关系符合公式:
的关系符合公式: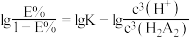 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)整个工艺流程中,可循环利用的物质是
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫
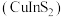 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的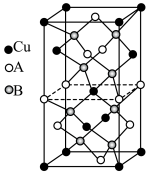
您最近一年使用:0次



