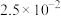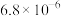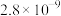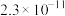1 . 铜、硫及其化合物在工业中用途广泛。请回答下列问题:
(1)基态铜原子的核外电子排布式为___________ 。
(2)硫酰氟 常温常压下为无色气体,固态
常温常压下为无色气体,固态 的晶体类型为
的晶体类型为___________ ,其F-S-F键角___________ (填“>”或“<”)硫酰氯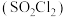 中的
中的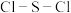 键角。
键角。
(3)硫酸四氨合铜晶体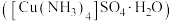 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备 的流程如下:
的流程如下:
①写出过程 发生反应的离子方程式
发生反应的离子方程式___________ 。
②过程c加入 乙醇的作用是
乙醇的作用是___________ 。
③根据 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序___________ 。
(4)硫化铜的立方晶胞结构如图所示,已知 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长=___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)硫酰氟
 常温常压下为无色气体,固态
常温常压下为无色气体,固态 的晶体类型为
的晶体类型为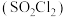 中的
中的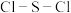 键角。
键角。(3)硫酸四氨合铜晶体
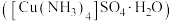 常用作杀虫剂、媒染剂。实验室制备
常用作杀虫剂、媒染剂。实验室制备 的流程如下:
的流程如下: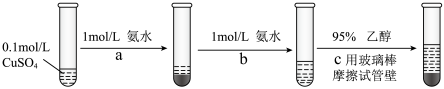
①写出过程
 发生反应的离子方程式
发生反应的离子方程式②过程c加入
 乙醇的作用是
乙醇的作用是③根据
 的现象,写出
的现象,写出 与
与 结合由弱到强的顺序
结合由弱到强的顺序(4)硫化铜的立方晶胞结构如图所示,已知
 与
与 的核间距最小为
的核间距最小为 ,则该晶胞的棱长=
,则该晶胞的棱长= (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
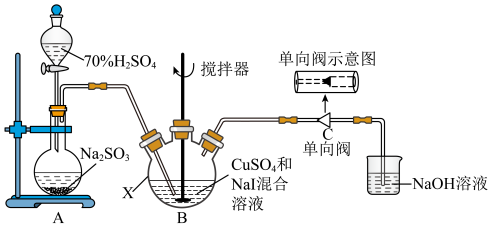
2 . 碘化亚铜(CuI)可用作有机合成催化剂,是一种白色粉末,不溶于水,在空气中相对稳定。实验室制备碘化亚铜的装置如图(部分夹持及加热装置已略去):
I.取50.0g 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
Ⅱ.打开分液漏斗,将A中产生的 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;
Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是___________ 。仪器X的名称是___________ 。
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为___________ 。
(3)步骤Ⅱ通入 的主要目的是
的主要目的是___________ 。写出通入 所发生的离子反应方程式
所发生的离子反应方程式___________ 。
(4)下图中能起到与单向阀C相同作用的是___________ (填字母)。(下图容器中未标注的液体均为氢氧化钠溶液) 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为___________ %,据此推算CuI的产率接近于___________ (填字母)。
I.取50.0g
 、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
、80.0gNaI于仪器X中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;Ⅱ.打开分液漏斗,将A中产生的
 通向B中的黄色沉淀,充分反应后得到白色沉淀;
通向B中的黄色沉淀,充分反应后得到白色沉淀;Ⅲ.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
Ⅳ.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前,必需进行的操作是
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为
(3)步骤Ⅱ通入
 的主要目的是
的主要目的是 所发生的离子反应方程式
所发生的离子反应方程式(4)下图中能起到与单向阀C相同作用的是

 浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为
浓度在一定范围内的关系如图。取0.1mgCuI粗产品,经预处理,将其中Cu元素全部转化为 并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
并定容至1L。取样1mL测得荧光强度比值为10.7,则产品中CuI的纯度为
您最近一年使用:0次
3 . 25℃时,向一定浓度的 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是 中x表示
中x表示 、
、 、
、 ;
;
② 。
。
 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中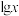 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是
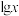 中x表示
中x表示 、
、 、
、 ;
;②
 。
。A.曲线III表示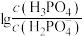 随pOH的变化关系 随pOH的变化关系 |
B.M点时,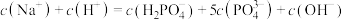 |
C.当溶液 时, 时, |
D. 的平衡常数为 的平衡常数为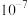 |
您最近一年使用:0次
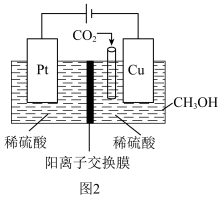
4 . CO2的转化和利用是实现碳中和的有效途径,其中CO2转化为CH3OH被认为是最可能利用的路径,该路径涉及反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
请回答下列问题:
(1)若利用反应I计算反应II的反应热△H2,还需要知道一个化学反应的△H,写出该反应的化学方程式_______ 。
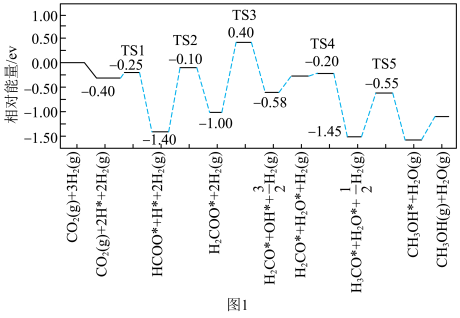
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图1(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ 。
(3)在恒温恒压(260℃,1.8MPa)下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
已知:
i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii.CH3OH的选择性=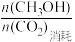 ×100%
×100%
①在普通反应器(A)中,下列能作为反应I和反应II均达到平衡状态的判断判据是_______ (填字母)。
A.气体压强不再变化
B.气体的密度不再改变
C.v正(CO2)=3v逆(H2)
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是_______ ;在反应器(B)中,CO2的平衡转化率明显高于反应器(A),可能的原因是______ 。
③若反应器(A)中初始时n(CO2)=1mol,反应I从开始到平衡态的平均反应速率v(CH3OH)=_______ mol•s-1;反应II的化学平衡常数Kp(II)=_______ (列出化简后的计算式即可)。
(4)近年来,有研究人员用CO2通过电催化生成CH3OH,实现CO2的回收利用,其工作原理如图2所示,请写出Cu电极上的电极反应:_______ 。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.01kJ•mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0请回答下列问题:
(1)若利用反应I计算反应II的反应热△H2,还需要知道一个化学反应的△H,写出该反应的化学方程式
(2)在催化剂条件下,反应I的反应机理和相对能量变化如图1(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
(3)在恒温恒压(260℃,1.8MPa)下,CO2和H2按体积比1:3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如表。
| 反应器 | CO2平衡转化率 | 甲醇的选择性 | 达到平衡时间/s |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | >25.0% | 100.0% | 8.0 |
i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii.CH3OH的选择性=
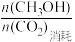 ×100%
×100%①在普通反应器(A)中,下列能作为反应I和反应II均达到平衡状态的判断判据是
A.气体压强不再变化
B.气体的密度不再改变
C.v正(CO2)=3v逆(H2)
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③若反应器(A)中初始时n(CO2)=1mol,反应I从开始到平衡态的平均反应速率v(CH3OH)=
(4)近年来,有研究人员用CO2通过电催化生成CH3OH,实现CO2的回收利用,其工作原理如图2所示,请写出Cu电极上的电极反应:
您最近一年使用:0次
2024-06-06更新
|
117次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
名校
解题方法
5 . 钴酸锂( )常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量
)常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备
等)为原料制备 并获得金属Mg副产品的一种工艺流程如图所示:
并获得金属Mg副产品的一种工艺流程如图所示:
① 的溶解度随温度升高而降低。
的溶解度随温度升高而降低。
②常温下,几种难溶物质的溶度积数据如下表所示。
回答下列问题:
(1)某小组同学利用右图装置进行“除杂1”相关操作,装置图中有一处不符合操作规范,该不规范之处是指_________________ 。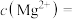
____________  。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要
。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要_________________ 。
(3)“洗涤” 固体时最好选用
固体时最好选用__________ (填“热水”或“冷水”),检验 否洗涤干净的操作是
否洗涤干净的操作是_____________________ 。
(4)高温下,“合成”反应的化学方程式为_____________________ 。
(5) 固体“溶解”后经过“一系列操作”,可以得到
固体“溶解”后经过“一系列操作”,可以得到 晶体,则“一系列操作”为
晶体,则“一系列操作”为___________________ 。
(6)“脱水”时加入 能抑制
能抑制 的水解,原因是
的水解,原因是_________________ 。
 )常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量
)常用作锂离子电池的正极材料。以某卤水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备
等)为原料制备 并获得金属Mg副产品的一种工艺流程如图所示:
并获得金属Mg副产品的一种工艺流程如图所示:
①
 的溶解度随温度升高而降低。
的溶解度随温度升高而降低。②常温下,几种难溶物质的溶度积数据如下表所示。
物质 |
|
|
|
|
|
室温下 |
|
|
|
|
|
(1)某小组同学利用右图装置进行“除杂1”相关操作,装置图中有一处不符合操作规范,该不规范之处是指
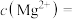
 。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要
。若“蒸发浓缩”步骤在实验室中进行,使用的硅酸盐仪器除了酒精灯之外,还需要(3)“洗涤”
 固体时最好选用
固体时最好选用 否洗涤干净的操作是
否洗涤干净的操作是(4)高温下,“合成”反应的化学方程式为
(5)
 固体“溶解”后经过“一系列操作”,可以得到
固体“溶解”后经过“一系列操作”,可以得到 晶体,则“一系列操作”为
晶体,则“一系列操作”为(6)“脱水”时加入
 能抑制
能抑制 的水解,原因是
的水解,原因是
您最近一年使用:0次
2024-06-06更新
|
44次组卷
|
2卷引用:2024届陕西省铜川市王益中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
6 . 四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
① 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;
② 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。
回答下列问题:
(1)装置A中仪器a的名称是___________ ,用浓盐酸与 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为____________ (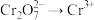 )。
)。
(2)装置的连接顺序为___________ 。
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为_______ (填编号);装置C中冷凝管的作用是____________ ,冷水从_________ 口通入。 、
、 ,此时装置F的作用为
,此时装置F的作用为_________________ 。
(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:_________ 。
(6)装置C中反应结束后,先过滤除去固体_________ (填名称),再经过_________ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
①
 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;②
 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。回答下列问题:
(1)装置A中仪器a的名称是
 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为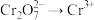 )。
)。(2)装置的连接顺序为
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为

 、
、 ,此时装置F的作用为
,此时装置F的作用为(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:
(6)装置C中反应结束后,先过滤除去固体
 。
。
您最近一年使用:0次
2024-06-06更新
|
72次组卷
|
2卷引用:2024届陕西省铜川市王益中学高三下学期模拟预测理综试题-高中化学
名校
7 . 有机物E是一种广谱抗癌药,一种合成路线如下:
(1)A中所含官能团的名称是_____ 。
(2)B→C中 的作用是
的作用是_____ 。D→E的反应类型是_____ 。
(3)1moli与足量溴水反应,最多消耗_____ 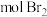 。
。
(4)写出A→B的化学方程式:_____ 。
(5)在A的芳香族同分异构体中,苯环上直接连—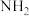 且能发生银镜反应的物质有
且能发生银镜反应的物质有_____ 种(不考虑立体异构),其中核磁共振氢谱上有四组峰且峰面积比为1:2:2:2的结构简式为_____ 。
(6)设计以苯酚和1,3-丁二烯为原料合成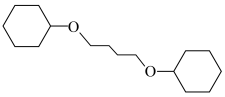 的路线
的路线_____ (其他试剂任选)。
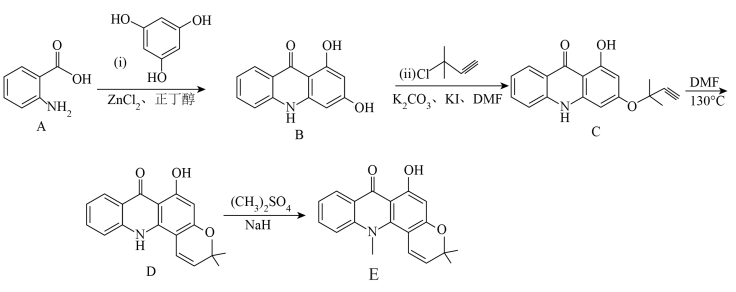
(1)A中所含官能团的名称是
(2)B→C中
 的作用是
的作用是(3)1moli与足量溴水反应,最多消耗
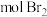 。
。(4)写出A→B的化学方程式:
(5)在A的芳香族同分异构体中,苯环上直接连—
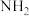 且能发生银镜反应的物质有
且能发生银镜反应的物质有(6)设计以苯酚和1,3-丁二烯为原料合成
 的路线
的路线
您最近一年使用:0次
2024-06-04更新
|
147次组卷
|
2卷引用:2024届陕西省安康市高新中学高三下学期5月模拟预测理综试题-高中化学
8 . 氨和氨水能与多种金属离子形成配合物,且在生产和生活中都发挥着重要作用。回答下列问题:
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为___________ 。 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。酸性条件下,
显土黄色。酸性条件下, 和
和 可与
可与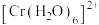 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:
I.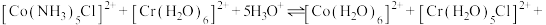
___________ ;
II.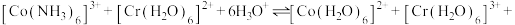
___________ 。
(3)某温度下,对(2)中的反应进行了研究。速率方程为 ,
,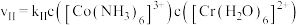 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与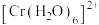 反应得到下图中曲线I和曲线II;分别用不同浓度的
反应得到下图中曲线I和曲线II;分别用不同浓度的 与
与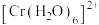 反应得到图中曲线II和曲线II′。
反应得到图中曲线II和曲线II′。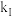
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”);曲线Ⅱ
”);曲线Ⅱ 内,
内, 的平均生成速率为
的平均生成速率为___________ 。
②下列说法中正确的有___________ 。(填选项字母)。
A.平衡后加入 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的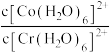 均减小
均减小
B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应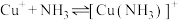 ,
,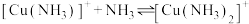 。平衡体系中
。平衡体系中 、
、 、
、 、
、 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。___________ 。{填“ ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。
② 的溶度积
的溶度积
___________ 。
③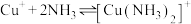 的平衡常数
的平衡常数
___________ 。
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为

 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。酸性条件下,
显土黄色。酸性条件下, 和
和 可与
可与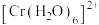 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:I.
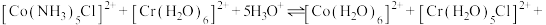
II.
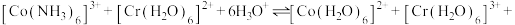
(3)某温度下,对(2)中的反应进行了研究。速率方程为
 ,
,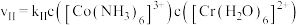 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与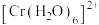 反应得到下图中曲线I和曲线II;分别用不同浓度的
反应得到下图中曲线I和曲线II;分别用不同浓度的 与
与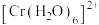 反应得到图中曲线II和曲线II′。
反应得到图中曲线II和曲线II′。 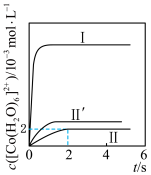
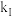
 (填“
(填“ ”“
”“ ”或“
”或“ ”);曲线Ⅱ
”);曲线Ⅱ 内,
内, 的平均生成速率为
的平均生成速率为②下列说法中正确的有
A.平衡后加入
 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的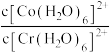 均减小
均减小B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解
 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应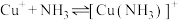 ,
,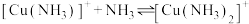 。平衡体系中
。平衡体系中 、
、 、
、 、
、 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。
 ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。②
 的溶度积
的溶度积
③
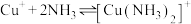 的平衡常数
的平衡常数
您最近一年使用:0次
名校
解题方法
9 . 秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料,直到近年来人们才研究出来其成分为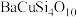 ,
,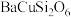 。试回答下列问题:
。试回答下列问题:
(1)“中国蓝”、“中国紫”中均具有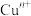 离子,
离子,
______ ,基态时该阳离子的价电子排布式为______ ,“中国蓝”的发色中心是以 为中心的配位化合物,形成该配位键,
为中心的配位化合物,形成该配位键, 提供
提供______ 。
(2)合成“中国蓝”、“中国紫”的原料有 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是
)。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是______ 。
(3)在5500年前,古代埃及人就已经知道如何合成蓝色颜料——“埃及蓝”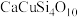 ,其合成原料中用
,其合成原料中用 代替了
代替了 ,其他和“中国蓝”一致。
,其他和“中国蓝”一致。 中键角为
中键角为______ 。从原料分解的角度判断,“埃及蓝”的合成温度比“中国蓝”更低,这是因为 比
比 更易形成。根据所学,试解释:
更易形成。根据所学,试解释:______ 。
(4) 和
和 同主族,但
同主族,但 与
与 的熔沸点差异很大,这是因为
的熔沸点差异很大,这是因为______ 。
(5)现代工业利用铜氨溶液溶解纤维制造人造丝。金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色铜氨溶液,写出离子方程式:______ 。
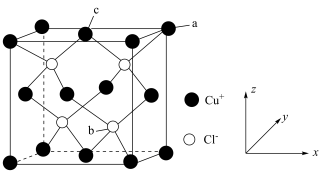
(6)氯化亚铜的晶胞结构如图所示。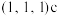 点坐标为
点坐标为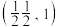 ,则b点的坐标为
,则b点的坐标为______ 。
②设 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为 ,则该晶体的密度
,则该晶体的密度
______  (列出计算式即可)。
(列出计算式即可)。
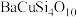 ,
,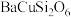 。试回答下列问题:
。试回答下列问题:(1)“中国蓝”、“中国紫”中均具有
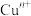 离子,
离子,
 为中心的配位化合物,形成该配位键,
为中心的配位化合物,形成该配位键, 提供
提供(2)合成“中国蓝”、“中国紫”的原料有
 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是
)。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是(3)在5500年前,古代埃及人就已经知道如何合成蓝色颜料——“埃及蓝”
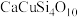 ,其合成原料中用
,其合成原料中用 代替了
代替了 ,其他和“中国蓝”一致。
,其他和“中国蓝”一致。 中键角为
中键角为 比
比 更易形成。根据所学,试解释:
更易形成。根据所学,试解释:(4)
 和
和 同主族,但
同主族,但 与
与 的熔沸点差异很大,这是因为
的熔沸点差异很大,这是因为(5)现代工业利用铜氨溶液溶解纤维制造人造丝。金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色铜氨溶液,写出离子方程式:
(6)氯化亚铜的晶胞结构如图所示。
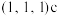 点坐标为
点坐标为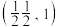 ,则b点的坐标为
,则b点的坐标为②设
 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为 ,则该晶体的密度
,则该晶体的密度
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
10 . 美国宇航局科学家确认火星大气中存在甲烷气体,可能来自火星火山活动或者生命活动,这一发现将为寻找火星生命带来希望。某课外活动小组利用如图所示装置探究烃类物质的性质,根据题意,回答下列问题:
Ⅰ.烷烃可以发生取代反应。向下图的A制取氯气,并向B中通入一定量的甲烷气体,于C处用强光照射硬质玻璃管。______ 。
(2)B有三种功能:①控制气流速度;②混匀混合气体;③______ 。
(3)写出装置C中 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式____________ 。
(4)装置D的石棉浸有足量 溶液,装置E中盛有
溶液,装置E中盛有 溶液,均用于除去尾气中的
溶液,均用于除去尾气中的 、
、 等,其中E中倒置球形干燥管的作用是
等,其中E中倒置球形干燥管的作用是______ 。
(5)E中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为______(选填编号)。
(6)有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法______ (填“正确”或“不正确”),理由是______ 。
(7)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为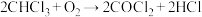 。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是______ 。
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
Ⅱ.丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。
(8)丙烯能够使溴的四氯化碳溶液褪色,该反应的化学方程式为____________ 。
(9)聚丙烯(PP)可制成薄膜、包装材料等,丙烯在催化剂条件下合成聚丙烯的化学方程式是____________ 。
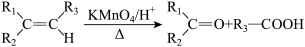
(10)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的反应关系:______ 。
Ⅰ.烷烃可以发生取代反应。向下图的A制取氯气,并向B中通入一定量的甲烷气体,于C处用强光照射硬质玻璃管。
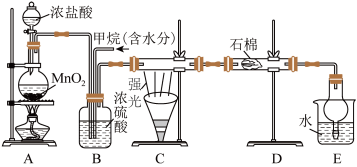
(2)B有三种功能:①控制气流速度;②混匀混合气体;③
(3)写出装置C中
 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(4)装置D的石棉浸有足量
 溶液,装置E中盛有
溶液,装置E中盛有 溶液,均用于除去尾气中的
溶液,均用于除去尾气中的 、
、 等,其中E中倒置球形干燥管的作用是
等,其中E中倒置球形干燥管的作用是(5)E中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为______(选填编号)。
| A.结晶法 | B.蒸馏法 | C.萃取分液法 | D.水洗分液法 |
(6)有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法
(7)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为
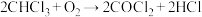 。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
。为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
Ⅱ.丙烯是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。
(8)丙烯能够使溴的四氯化碳溶液褪色,该反应的化学方程式为
(9)聚丙烯(PP)可制成薄膜、包装材料等,丙烯在催化剂条件下合成聚丙烯的化学方程式是
(10)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的反应关系:
您最近一年使用:0次