真题
1 . 将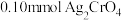 配制成
配制成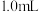 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
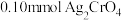 配制成
配制成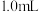 悬浊液,向其中滴加
悬浊液,向其中滴加 的
的 溶液。
溶液。 (M代表
(M代表 、
、 或
或 )随加入
)随加入 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
A.交点a处: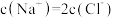 |
B.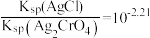 |
C.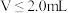 时, 时,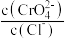 不变 不变 |
D.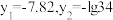 |
您最近一年使用:0次
2 . 钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。
已知:①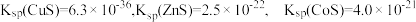 。
。
②以氢氧化物形式沉淀时,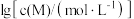 和溶液
和溶液 的关系如图所示。
的关系如图所示。
(1)“酸浸”前,需将废渣磨碎,其目的是_____ 。
(2)“酸浸”步骤中, 发生反应的化学方程式是
发生反应的化学方程式是_____ 。
(3)假设“沉铜”后得到的滤液中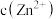 和
和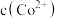 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中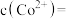
_____  ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离_____ (填“能”或“不能”)。
(4)“沉锰”步骤中,生成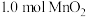 ,产生
,产生 的物质的量为
的物质的量为_____ 。
(5)“沉淀”步骤中,用 调
调 ,分离出的滤渣是
,分离出的滤渣是_____ 。
(6)“沉钴”步骤中,控制溶液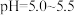 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_____ 。
 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
 ,其他金属离子不沉淀,即认为完全分离。
,其他金属离子不沉淀,即认为完全分离。已知:①
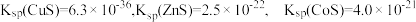 。
。②以氢氧化物形式沉淀时,
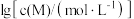 和溶液
和溶液 的关系如图所示。
的关系如图所示。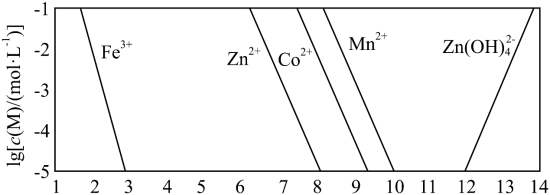
(1)“酸浸”前,需将废渣磨碎,其目的是
(2)“酸浸”步骤中,
 发生反应的化学方程式是
发生反应的化学方程式是(3)假设“沉铜”后得到的滤液中
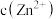 和
和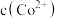 均为
均为 ,向其中加入
,向其中加入 至
至 沉淀完全,此时溶液中
沉淀完全,此时溶液中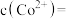
 ,据此判断能否实现
,据此判断能否实现 和
和 的完全分离
的完全分离(4)“沉锰”步骤中,生成
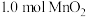 ,产生
,产生 的物质的量为
的物质的量为(5)“沉淀”步骤中,用
 调
调 ,分离出的滤渣是
,分离出的滤渣是(6)“沉钴”步骤中,控制溶液
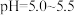 ,加入适量的
,加入适量的 氧化
氧化 ,其反应的离子方程式为
,其反应的离子方程式为(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是
您最近一年使用:0次
2025高三上·全国·专题练习
3 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
解题方法
4 . 介孔Cu2-xSe纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%CuFeS2、32%Cu2S,其余为CaS和SiO2)为原料开发的一种合成介孔Cu2-xSe的路线如图所示:_____ 。此时铁盐_____ (填“作氧化剂”“作还原剂”或“既不是氧化剂,也不是还原剂”)。
(2)将“浸渣”溶于CS2,再过滤、蒸馏,可从“浸渣”中分离出_____ (填化学式)。
(3)实验室“萃取”时,用到的主要仪器是_____ 。若萃取剂为苯,“萃取”后得到的“水相”位于_____ (填“上层”或“下层”)。
(4)利用如图装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是_____ 。_____ 。_____ kg。
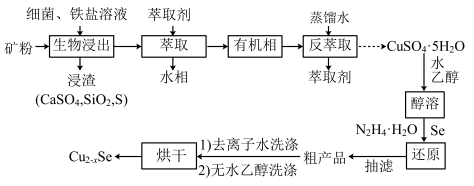
(2)将“浸渣”溶于CS2,再过滤、蒸馏,可从“浸渣”中分离出
(3)实验室“萃取”时,用到的主要仪器是
(4)利用如图装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是
您最近一年使用:0次
解题方法
5 . 铬是最坚硬的金属,金刚石是自然界中最硬的物质。一种由铬铁矿(含 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。 ,
, 等。
等。
②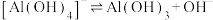
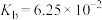 。
。
③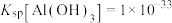
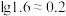 。
。
回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是__________________ 。
(2)焙烧时生成 的化学方程式是
的化学方程式是__________________ 。
(3)已知0.1 mol/L 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(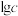 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。______ 。(已知: 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)
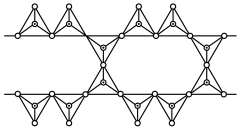
(4)工业上冶炼Cr的方法是______ 。基态Cr原子的价层电子排布图为____________ 。从原子结构及性质的角度分析金属Cr硬度很大的原因:________________________ 。
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为 ,则晶体硅的密度为
,则晶体硅的密度为______ g/cm (列出计算表达式)。
(列出计算表达式)。____________ 。
 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。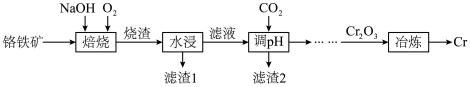
 ,
, 等。
等。②
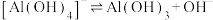
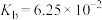 。
。③
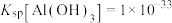
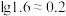 。
。回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是
(2)焙烧时生成
 的化学方程式是
的化学方程式是(3)已知0.1 mol/L
 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(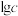 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。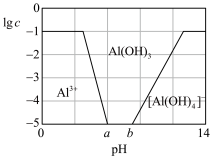
 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)(4)工业上冶炼Cr的方法是
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为
 ,则晶体硅的密度为
,则晶体硅的密度为 (列出计算表达式)。
(列出计算表达式)。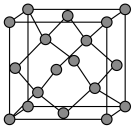
您最近一年使用:0次
2024-06-07更新
|
48次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
名校
解题方法
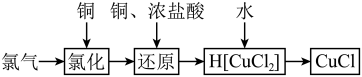
6 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
 的装置如图所示:
的装置如图所示: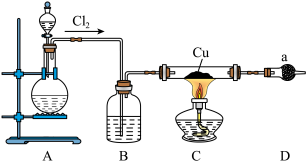
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
2024-06-06更新
|
63次组卷
|
2卷引用:2024届湘豫名校高三下学期考前保温卷理综试题-高中化学
2024高三·全国·专题练习
7 . 下列有关物质结构和性质的说法错误的是
| A.酚醛树脂中含有酯基 |
| B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 |
| C.酰胺在酸或碱存在并加热的条件下可发生水解反应 |
| D.冰的堆积方式为非密堆积,其原因为水分子间存在氢键 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
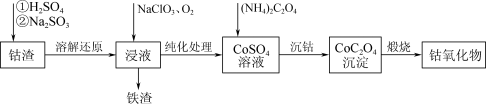
8 . Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如下:
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为_______ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是_______ 。
(3)检验CoC2O4固体是否洗净的实验操作是_______ 。
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数_______ (写出计算过程)。
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,_______ 。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是
(3)检验CoC2O4固体是否洗净的实验操作是
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗FeSO4标准溶液体积/mL | 18.32 | 18.02 | 17.98 |
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
您最近一年使用:0次
2024高三·全国·专题练习
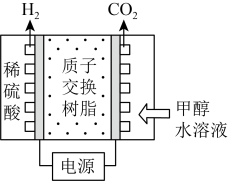
9 . 工业上利用甲醇和水蒸气可制备氢气。
Ⅰ.电解法制氢:甲醇电解可制得H2,其原理如图所示。___________ 。
Ⅱ.催化重整法制氢
(2)已知
反应1:CH3OH(g) CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1
CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1
反应2:CO(g)+H2O(g) CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1
反应3:CH3OH(g)+H2O(g) CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1
CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1
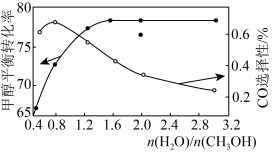
以CuOZnOAl2O3为催化剂进行甲醇重整制氢时,固定其他条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图所示。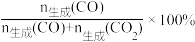 ]
]
①当水、甲醇比大于0.8时,CO选择性下降的原因是___________ 。
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是___________ 。
(3)铜基催化剂(Cu/CeO2)能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①甲醇中混有少量的甲硫醇(CH3SH),重整制氢时加入ZnO可有效避免铜基催化剂失活,其原理用化学方程式表示为___________ 。
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原。结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是___________ 。
(4)在PtPd合金表面上甲醇与水蒸气重整反应的机理如图所示(“*”表示此微粒吸附在催化剂表面,M为反应过程中的中间产物)。___________ 。
Ⅰ.电解法制氢:甲醇电解可制得H2,其原理如图所示。
Ⅱ.催化重整法制氢
(2)已知
反应1:CH3OH(g)
 CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1
CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1反应2:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1反应3:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1
CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1以CuOZnOAl2O3为催化剂进行甲醇重整制氢时,固定其他条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图所示。
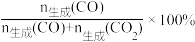 ]
]①当水、甲醇比大于0.8时,CO选择性下降的原因是
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是
(3)铜基催化剂(Cu/CeO2)能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①甲醇中混有少量的甲硫醇(CH3SH),重整制氢时加入ZnO可有效避免铜基催化剂失活,其原理用化学方程式表示为
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原。结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是
(4)在PtPd合金表面上甲醇与水蒸气重整反应的机理如图所示(“*”表示此微粒吸附在催化剂表面,M为反应过程中的中间产物)。
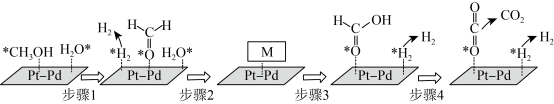
您最近一年使用:0次
2024高三·全国·专题练习
10 . 化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:
(1)A→B的反应类型是_______ ,B中sp2、sp3杂化的碳原子个数比为_______ 。
(2)E中的含氧官能团为_______ (填名称)。
(3)C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D.写出C的结构简式:_______ 。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:_______ (不考虑立体异构)。
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5)写出以甲苯和乙醇为原料制备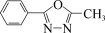 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

(1)A→B的反应类型是
(2)E中的含氧官能团为
(3)C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D.写出C的结构简式:
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5)写出以甲苯和乙醇为原料制备
 的合成路线流程图
的合成路线流程图
您最近一年使用:0次



