名校
1 . 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(大球代表Fe,小球代表Mg)。则下列说法不正确的是
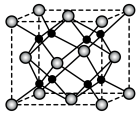
| A.铁镁合金的化学式为Mg2Fe |
| B.晶体中存在的化学键类型为金属键 |
| C.晶体中每个Fe周围紧邻的Mg有8个 |
D.该晶胞的质量是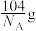 (NA表示阿伏加德罗常数的值) (NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
名校
解题方法
2 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①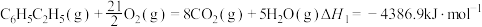
②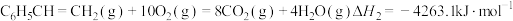
③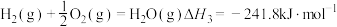
计算反应④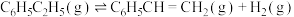 的
的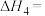
_______  ;
;
(2)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤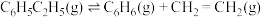
⑥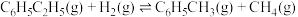
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成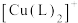 ,其反应平衡常数为K;
,其反应平衡常数为K;
② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
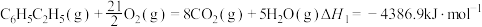
②
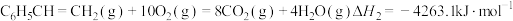
③
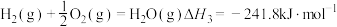
计算反应④
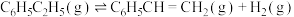 的
的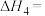
 ;
;(2)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
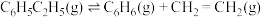
⑥
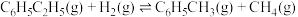
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是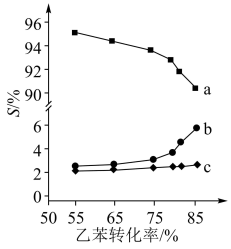
 的描述错误的是_______;
的描述错误的是_______;A. 不能改变反应热效应 不能改变反应热效应 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。
,实现苯乙烯可控聚合。引发剂的活性与C-X键能有关,键能越小,则引发剂活性越高。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成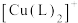 ,其反应平衡常数为K;
,其反应平衡常数为K;②
 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
名校
3 . 温室气体 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
Ⅰ. 工业上利用 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为
反应①: CH4(g)+ CO2(g) 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 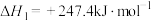
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g) CO(g) + H2O (g)
CO(g) + H2O (g) 
反应③:2 CO(g) CO2 (g) + C (s)
CO2 (g) + C (s) 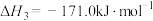
反应④:CH4(g) 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
_______ 。
(2)500℃时, 比较小,此时发生的副反应以
比较小,此时发生的副反应以_______ (选填②、③、④中一种)为主。升高温度,产物中 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是_______ 。
Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:_______ 。
(4)N点对应温度下,该反应的KP =_______ (MPa)2 (保留两位有效数字)
Ⅲ.用光电化学法将 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: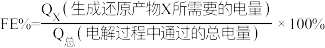 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为_______ 。
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为_______ 。
 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。Ⅰ. 工业上利用
 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为反应①: CH4(g)+ CO2(g)
 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 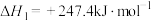
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g)
 CO(g) + H2O (g)
CO(g) + H2O (g) 
反应③:2 CO(g)
 CO2 (g) + C (s)
CO2 (g) + C (s) 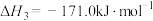
反应④:CH4(g)
 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将
 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示: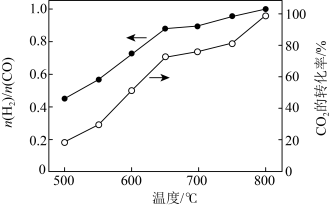

(2)500℃时,
 比较小,此时发生的副反应以
比较小,此时发生的副反应以 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示: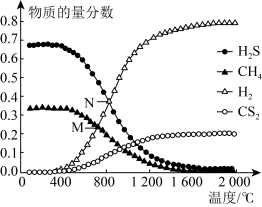
(4)N点对应温度下,该反应的KP =
Ⅲ.用光电化学法将
 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: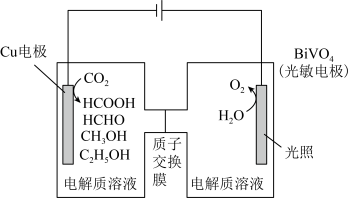
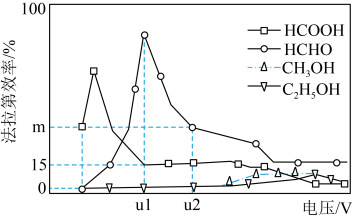
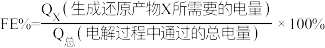 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为
您最近一年使用:0次
名校
解题方法
4 . 铬是人体内微量元素之一,是重要的血糖调节剂。
(1)铬在元素周期表中的位置为___________ ,其基态原子核外电子占据的原子轨道数为___________ 。
(2)已知 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。
①该配合物中提供孤电子对形成配位键的原子是___________ 。
②配体中中心原子的杂化方式为___________ (填字母)。
a. b.
b. c.sp d.
c.sp d.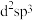
③该物质中, 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是___________ 。
(3)钛铬合金是一种高温结构材料,第二电离能
___________ (填“ ”或“
”或“ ”)
”)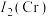 ,原因是
,原因是___________ 。
(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为 ,则B点分数坐标为
,则B点分数坐标为___________ ,已知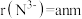 ,
,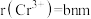 ,则AB间距离为
,则AB间距离为___________ nm。
(1)铬在元素周期表中的位置为
(2)已知
 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。①该配合物中提供孤电子对形成配位键的原子是
②配体中中心原子的杂化方式为
a.
 b.
b. c.sp d.
c.sp d.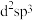
③该物质中,
 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是(3)钛铬合金是一种高温结构材料,第二电离能

 ”或“
”或“ ”)
”)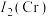 ,原因是
,原因是(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为
 ,则B点分数坐标为
,则B点分数坐标为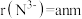 ,
,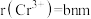 ,则AB间距离为
,则AB间距离为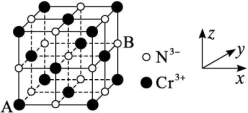
您最近一年使用:0次
解题方法
5 . 过氧乙酸( )是无色透明液体,常用于速效漂白和消毒,氧化性比
)是无色透明液体,常用于速效漂白和消毒,氧化性比 强,与酸性
强,与酸性 相近。某课外实验小组同学用
相近。某课外实验小组同学用 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
 。
。Ⅰ.过氧化氢的浓缩:
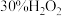 溶液浓缩至75%(
溶液浓缩至75%( 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):
沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):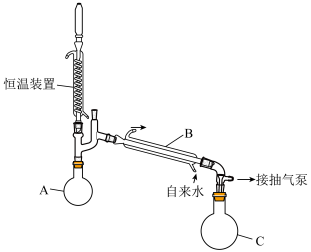
 溶液主要在
溶液主要在(2)该实验过程操作的正确顺序是
_______→_______→_______→_______→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加
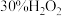 溶液;
溶液;⑤在滴液漏斗中装入
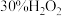 溶液;
溶液;⑥检查装置气密性。
Ⅱ.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加
 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。
溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。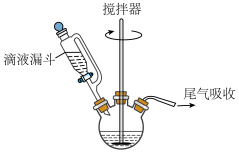
(4)实验中,利用搅拌器充分搅拌的作用是
(5)乙酸酐与
 反应的尾气可以用
反应的尾气可以用Ⅲ.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。

 溶液恰好除尽
溶液恰好除尽 的实验现象是
的实验现象是②第3步中过氧乙酸可被
 还原为乙酸,其离子方程式为
还原为乙酸,其离子方程式为③若实验中所取样品体积为
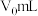 ,第3步中加入
,第3步中加入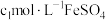 溶液
溶液 ,第4步滴定中消耗
,第4步滴定中消耗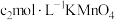 溶液
溶液 ,则过氧乙酸含量为
,则过氧乙酸含量为 。
。
您最近一年使用:0次
名校
解题方法
6 . 克里唑替尼(化合物N)是一种可用于治疗小细胞性肺癌,灭杀肺部肿瘤的药物。N的一种合成路线如下(部分试剂和条件略去)。
(1)A的化学名称是___________ 。
(2)N中含氧官能团的名称是___________ 。
(3)B生成C的反应类型为___________ 。
(4)由C生成E的化学方程式为___________ 。
(5)已知:J+K L+CH3OI,则K的结构简式为
L+CH3OI,则K的结构简式为___________ 。
(6)F分子中手性碳的数目为___________ 。
(7)P是G的同系物,相对分子质量比G小14。P的同分异构体中,满足下列条件的有___________ 种,其中任意一种的结构简式为___________ 。
③核磁共振氢谱显示有3组峰,且峰面积之比为2∶1∶1

(1)A的化学名称是
(2)N中含氧官能团的名称是
(3)B生成C的反应类型为
(4)由C生成E的化学方程式为
(5)已知:J+K
 L+CH3OI,则K的结构简式为
L+CH3OI,则K的结构简式为(6)F分子中手性碳的数目为
(7)P是G的同系物,相对分子质量比G小14。P的同分异构体中,满足下列条件的有
①含有结构单元:
③核磁共振氢谱显示有3组峰,且峰面积之比为2∶1∶1
您最近一年使用:0次
名校
解题方法
7 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(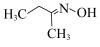 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
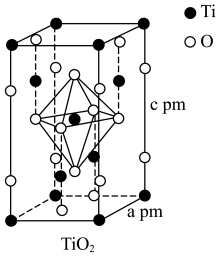
您最近一年使用:0次
名校
8 . 常温下,分别取未知浓度的 和
和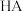 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液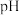 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

 和
和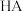 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液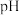 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
A. 为弱碱, 为弱碱,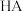 为强酸 为强酸 |
| B.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
C.若升高温度,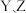 点对应溶液的 点对应溶液的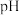 均不变 均不变 |
D.水的电离程度: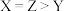 |
您最近一年使用:0次
2024-04-08更新
|
47次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:
I.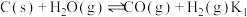
Ⅱ.
Ⅲ.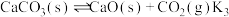
Ⅳ.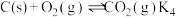
①该工艺制 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
___________ (用 等的代数式表示)。
等的代数式表示)。
②绝热条件下,将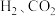 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________ 。
A. 与
与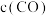 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.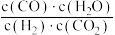 不变
不变
(2) 的速率方程为
的速率方程为 ,
,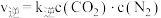 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,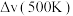
___________ (填“>”、“<”或“=”) 。
。
(3)一定条件下, 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:
ⅰ.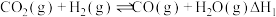
ⅱ.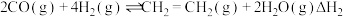
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
 的平衡转化率为
的平衡转化率为___________ ,反应ⅰ的平衡常数
___________ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)利用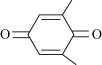 (Q)与
(Q)与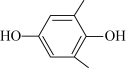 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
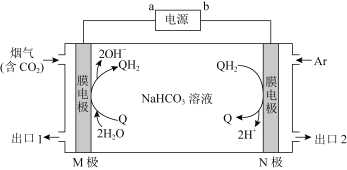
①(填“a”或“b”)___________ 为电源负极。
② 从出口
从出口___________ (填“1”或“2”)排出, 在
在 极上发生的反应为
极上发生的反应为___________ 。
(1)以生物材质(以
 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:I.
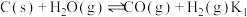
Ⅱ.

Ⅲ.
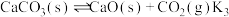
Ⅳ.
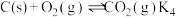
①该工艺制
 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
 等的代数式表示)。
等的代数式表示)。②绝热条件下,将
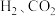 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是A.
 与
与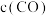 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变C.容器内气体压强不变 D.
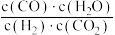 不变
不变(2)
 的速率方程为
的速率方程为 ,
,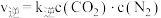 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率
 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,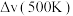
 。
。(3)一定条件下,
 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:ⅰ.
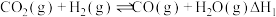
ⅱ.
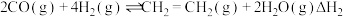
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:| 组分 |  |  |  |
| 物质的量分数(%) | 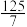 | 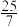 | 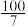 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)利用
 (Q)与
(Q)与 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
①(填“a”或“b”)
②
 从出口
从出口 在
在 极上发生的反应为
极上发生的反应为
您最近一年使用:0次
名校
解题方法
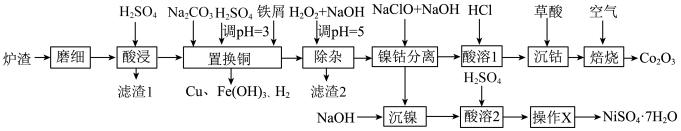
10 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: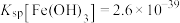 ,
, 。
。
(1)“磨细”过程的目的是_______ 。
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为_______ 。
(3)“滤渣2”主要成分为_______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“酸溶1”过程用 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性_______ 。
(6)“焙烧”过程发生反应的化学方程式为_______ 。
(7)已知当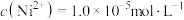 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为_______ 。
(8)“操作X”为_______ 。
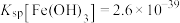 ,
, 。
。(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
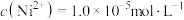 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为(8)“操作X”为
您最近一年使用:0次
2024-02-20更新
|
488次组卷
|
2卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题



