名校
1 . 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(大球代表Fe,小球代表Mg)。则下列说法不正确的是
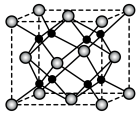
| A.铁镁合金的化学式为Mg2Fe |
| B.晶体中存在的化学键类型为金属键 |
| C.晶体中每个Fe周围紧邻的Mg有8个 |
D.该晶胞的质量是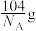 (NA表示阿伏加德罗常数的值) (NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
名校
2 . T ℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是
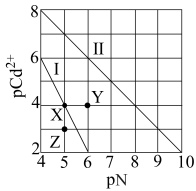
| A.曲线Ⅰ是CdCO3的沉淀溶解平衡曲线 |
B.T ℃,在CdCO3(s)+2OH-(aq) Cd(OH)2(s)+CO Cd(OH)2(s)+CO (aq)平衡体系中,平衡常数K=102 (aq)平衡体系中,平衡常数K=102 |
| C.Y点对应的Cd(OH)2溶液是过饱和溶液 |
| D.加热可使溶液由X点变到Z点 |
您最近一年使用:0次
名校
3 . 锌在生产生活中应用广泛,同时,锌也是人体必需的微量元素之一,起着极其重要的作用。
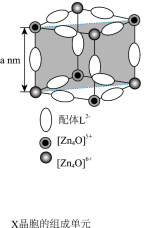
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。_______ 。
②L2-所含元素中,第一电离能从小到大的顺序为_______ ;每个L2-中采取sp2杂化的C原子数目为_______ 个。
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入_______ 。(假设X晶胞形状不变)。
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。_______ g•cm-3(列出化简的计算式)。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因:_______ 。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构_______ 。
(1)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。

②L2-所含元素中,第一电离能从小到大的顺序为
③X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
A.-Cl B.-OH C.-NH2 D.-CH3
④X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(2)复兴号高铁车体材质用到Zn、Co等元素,已知r(Co2+) =65 pm,r(Zn2+) =74 pm,推测ZnCO3比CoCO3的分解温度
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构
您最近一年使用:0次
名校
解题方法
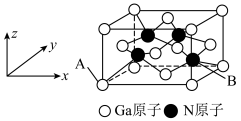
4 . 金属镓被称为“电子工业脊梁”,GaN凭借其出色的功率性能、频率性能以及散热性能,不仅应用于5G技术中,也让高功率、更快速充电由渴望变为现实。
【方法一】工业上利用粉煤灰(主要成分为 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: mol/L时,可认为已除尽。
mol/L时,可认为已除尽。
(1)“焙烧”的主要目的是_______ 。
(2)“滤渣1”主要成分为_______ 。
(3)“二次酸化”中Na[Ga(OH4)]与过量 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“电解”可得金属Ga,写出阴极电极反应式_______ 。
(5)常温下,反应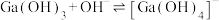 的平衡常数K的值为
的平衡常数K的值为_______ 。
【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成 无机聚合凝胶
无机聚合凝胶
失水缩聚: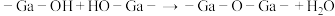
失醇缩聚:_______  (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)
(7)步骤二:高温氨化(原理: )
)
已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再_______ (补充实验操作),得到纯净的GaN粉末。
【方法一】工业上利用粉煤灰(主要成分为
 、
、 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下: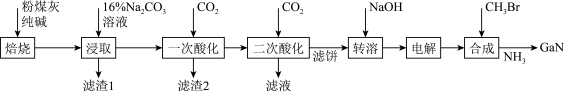
 mol/L时,可认为已除尽。
mol/L时,可认为已除尽。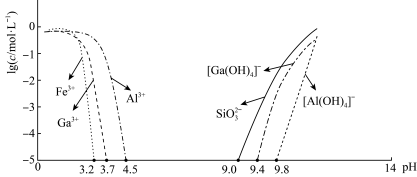
(1)“焙烧”的主要目的是
(2)“滤渣1”主要成分为
(3)“二次酸化”中Na[Ga(OH4)]与过量
 发生反应的离子方程式为
发生反应的离子方程式为(4)“电解”可得金属Ga,写出阴极电极反应式
(5)常温下,反应
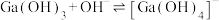 的平衡常数K的值为
的平衡常数K的值为【方法二】溶胶凝胶法
(6)步骤一:溶胶—凝胶过程包括水解和缩聚两个过程
①水解过程
②缩聚过程:在之后较长时间的成胶过程中,通过失水和失醇缩聚形成
 无机聚合凝胶
无机聚合凝胶失水缩聚:
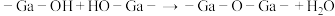
失醇缩聚:
 (在下划线将失醇缩聚方程补充完整)
(在下划线将失醇缩聚方程补充完整)(7)步骤二:高温氨化(原理:
 )
)已知:GaN在空气中加热到800℃时开始氧化,生成氧化镓。
该实验操作为:将
 无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
无机聚合凝胶置于管式炉中,先通20min氮气后停止通入,改通入氨气,并加热至850~950℃充分反应20min,再
您最近一年使用:0次
名校
解题方法
5 . 中成药连花清瘟胶囊可用于流感的防治,其成分之一绿原酸的结构简式如下:
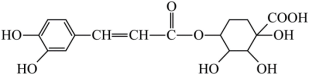
| A.苯环上的一氯代物有三种 | B.1 mol该物质最多可与4 mol氢气发生加成反应 |
| C.分子中所有碳原子可能共平面 | D.该分子含有手性碳原子 |
您最近一年使用:0次
名校
解题方法
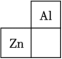
6 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
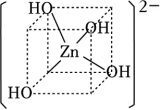
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
名校
解题方法
7 . 以“全氢电池”为电源直接电解氯化钠溶液制备 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是
 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是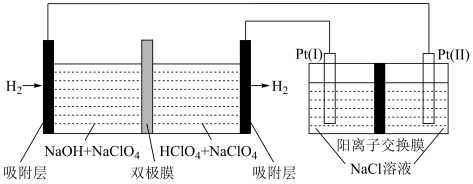
A.“全氢电池”的总反应为 |
B.“全氢电池”的双极膜中产生的 向右移动, 向右移动, 向左移动 向左移动 |
C.阳极区发生的电极反应为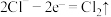 |
D.理论上负极消耗1mol  ,电解池阳极区减少1mol阳离子(忽略HClO的电离) ,电解池阳极区减少1mol阳离子(忽略HClO的电离) |
您最近一年使用:0次
2024-05-29更新
|
347次组卷
|
2卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
8 . 铬是人体内微量元素之一,是重要的血糖调节剂。
(1)铬在元素周期表中的位置为___________ ,其基态原子核外电子占据的原子轨道数为___________ 。
(2)已知 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。
①该配合物中提供孤电子对形成配位键的原子是___________ 。
②配体中中心原子的杂化方式为___________ (填字母)。
a. b.
b. c.sp d.
c.sp d.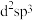
③该物质中, 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是___________ 。
(3)钛铬合金是一种高温结构材料,第二电离能
___________ (填“ ”或“
”或“ ”)
”)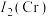 ,原因是
,原因是___________ 。
(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为 ,则B点分数坐标为
,则B点分数坐标为___________ ,已知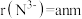 ,
,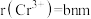 ,则AB间距离为
,则AB间距离为___________ nm。
(1)铬在元素周期表中的位置为
(2)已知
 半径小,正电场较强,容易与
半径小,正电场较强,容易与 、
、 、
、 等分子或离子形成多种配合物,
等分子或离子形成多种配合物, 是其中的一种。
是其中的一种。①该配合物中提供孤电子对形成配位键的原子是
②配体中中心原子的杂化方式为
a.
 b.
b. c.sp d.
c.sp d.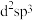
③该物质中,
 的键角比独立存在的气态氨气分子中键角略大,其原因是
的键角比独立存在的气态氨气分子中键角略大,其原因是(3)钛铬合金是一种高温结构材料,第二电离能

 ”或“
”或“ ”)
”)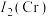 ,原因是
,原因是(4)铬的一种氮化物晶体立方晶胞结构如图所示,A点分数坐标为
 ,则B点分数坐标为
,则B点分数坐标为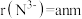 ,
,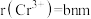 ,则AB间距离为
,则AB间距离为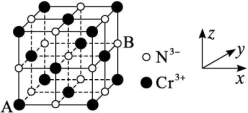
您最近一年使用:0次
解题方法
9 . 一种以磷铁渣(主要含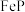 ,以及少量
,以及少量 、
、 等杂质)、
等杂质)、 为原料制备磷酸锰
为原料制备磷酸锰 的实验过程如下:
的实验过程如下:
(1)溶解。将一定量的磷铁渣加入如图所示装置的三颈烧瓶中,维持温度60℃,边搅拌边向三颈烧瓶中加入一定量的硫酸和 溶液,反应后有
溶液,反应后有 、
、 和
和 生成。反应后过滤。
生成。反应后过滤。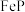 反应的离子方程式:
反应的离子方程式:___________ 。
②实验中当观察到某种现象时可不再加入 溶液,该现象是:
溶液,该现象是:___________ 。
③ 难溶于水,反应
难溶于水,反应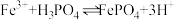 的平衡常数为
的平衡常数为___________ 。[已知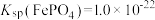 ,
, 的电离平衡常数
的电离平衡常数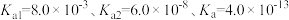 ]。
]。
④实验中需不断补充稀硫酸控制溶液的 。
。 过大会降低
过大会降低 的浸出率和消耗过多的
的浸出率和消耗过多的 ,原因是
,原因是___________ 。
(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的 。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用
。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用 表示)萃取溶液中
表示)萃取溶液中 时发生如下反应:
时发生如下反应: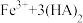 (有机层)
(有机层)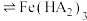 (有机层)
(有机层) ,反萃取回收萃取剂的方法是
,反萃取回收萃取剂的方法是___________ 。
(3)制 。由萃取后所得水层中
。由萃取后所得水层中 、
、 制纯净
制纯净 固体的实验方案,请补充完整:取萃取后所得水层溶液
固体的实验方案,请补充完整:取萃取后所得水层溶液 [其中
[其中 ],向其中滴加
],向其中滴加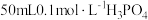 ,再滴加
,再滴加 溶液,至溶液
溶液,至溶液
___________ ,过滤,洗涤沉淀至最后一次洗涤滤液中加入盐酸和 溶液
溶液___________ ,后干燥沉淀,得 固体。(已知溶液的
固体。(已知溶液的 对所得沉淀中锰磷比
对所得沉淀中锰磷比 和
和 的沉淀率影响如图所示。)
的沉淀率影响如图所示。)
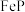 ,以及少量
,以及少量 、
、 等杂质)、
等杂质)、 为原料制备磷酸锰
为原料制备磷酸锰 的实验过程如下:
的实验过程如下:(1)溶解。将一定量的磷铁渣加入如图所示装置的三颈烧瓶中,维持温度60℃,边搅拌边向三颈烧瓶中加入一定量的硫酸和
 溶液,反应后有
溶液,反应后有 、
、 和
和 生成。反应后过滤。
生成。反应后过滤。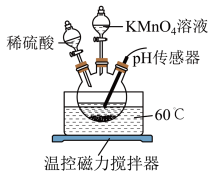
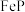 反应的离子方程式:
反应的离子方程式:②实验中当观察到某种现象时可不再加入
 溶液,该现象是:
溶液,该现象是:③
 难溶于水,反应
难溶于水,反应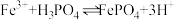 的平衡常数为
的平衡常数为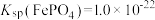 ,
, 的电离平衡常数
的电离平衡常数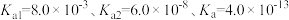 ]。
]。④实验中需不断补充稀硫酸控制溶液的
 。
。 过大会降低
过大会降低 的浸出率和消耗过多的
的浸出率和消耗过多的 ,原因是
,原因是(2)除铁。向所得滤液中加入萃取剂(由磷酸酯和煤油混合而成,磷酸酯易溶于煤油,难溶于水)萃取溶液中的
 。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用
。萃取结束后取有机层,经过反萃取操作,可回收萃取剂重复使用。已知萃取剂中磷酸酯(用 表示)萃取溶液中
表示)萃取溶液中 时发生如下反应:
时发生如下反应: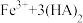 (有机层)
(有机层)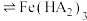 (有机层)
(有机层) ,反萃取回收萃取剂的方法是
,反萃取回收萃取剂的方法是(3)制
 。由萃取后所得水层中
。由萃取后所得水层中 、
、 制纯净
制纯净 固体的实验方案,请补充完整:取萃取后所得水层溶液
固体的实验方案,请补充完整:取萃取后所得水层溶液 [其中
[其中 ],向其中滴加
],向其中滴加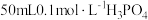 ,再滴加
,再滴加 溶液,至溶液
溶液,至溶液
 溶液
溶液 固体。(已知溶液的
固体。(已知溶液的 对所得沉淀中锰磷比
对所得沉淀中锰磷比 和
和 的沉淀率影响如图所示。)
的沉淀率影响如图所示。)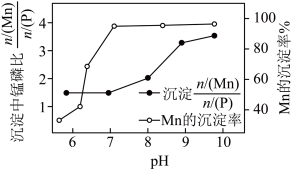
您最近一年使用:0次
名校
解题方法
10 . 按照要求回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2) 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数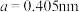 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为______ ,铁原子半径为______ ,列式表示铁晶胞的空间利用率____ 。(不必计算出结果)
(3) 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图:________ 。
②在 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为_______ ; 配位数为
配位数为_______ 。
③每个 晶胞中平均有
晶胞中平均有_____ 个 原子。
原子。
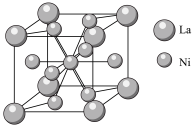
④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为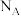 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为______ 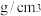 。
。 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为____  。
。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 单质为体心立方晶体,其晶胞参数
单质为体心立方晶体,其晶胞参数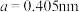 ,晶胞中铁原子的配位数为
,晶胞中铁原子的配位数为(3)
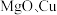 和干冰的晶胞示意图如图:
和干冰的晶胞示意图如图: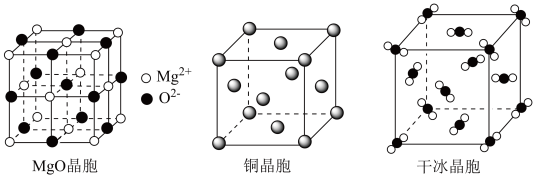
②在
 晶体中,与
晶体中,与 相邻且最近的
相邻且最近的 个数为
个数为 配位数为
配位数为③每个
 晶胞中平均有
晶胞中平均有 原子。
原子。④金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,若阿伏加德罗常数为
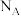 晶胞边长为
晶胞边长为 ,晶胞的密度为
,晶胞的密度为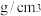 。
。
 晶胞中,
晶胞中, 原子半径为
原子半径为 原子半径为
原子半径为 ,阿伏加德罗常数用
,阿伏加德罗常数用 表示,
表示, 的密度可表示为
的密度可表示为 。
。
您最近一年使用:0次



