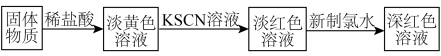
1 . 以硫酸厂矿渣(含 、
、 、
、 等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示: 化学性质极不活泼,不溶于水也不溶于酸或碱。ii.
化学性质极不活泼,不溶于水也不溶于酸或碱。ii.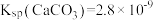 ;
;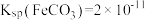 。回答下列问题:
。回答下列问题:
(1)为了提高“酸浸”的效率可以采用的措施有(写出其中一种)_______ 。
(2)“滤渣”中主要成分为(填化学式)_______ 。
(3)①“沉铁”过程中有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_______ 。
②“沉铁”过程中往往有副产物 生成,分析原因是
生成,分析原因是_______ 。
③若用 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液
产生,当反应完成时,溶液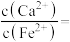
_______ 。
(4)利用制备的铁黄进行如图实验:_______ 。
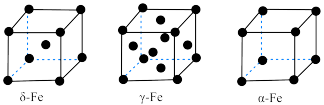
(5)铁有 、
、 、
、 三种晶型,各晶胞结构下图,则
三种晶型,各晶胞结构下图,则 、
、 两种晶胞中铁原子的配位数之比为
两种晶胞中铁原子的配位数之比为_______  -Fe的晶胞边长为
-Fe的晶胞边长为 ,则
,则 原子半径为
原子半径为_______  。
。
 、
、 、
、 等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示: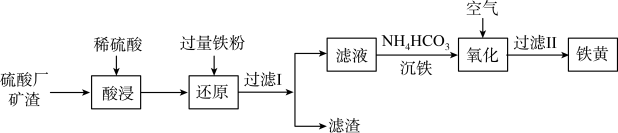
 化学性质极不活泼,不溶于水也不溶于酸或碱。ii.
化学性质极不活泼,不溶于水也不溶于酸或碱。ii.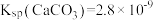 ;
;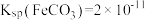 。回答下列问题:
。回答下列问题:(1)为了提高“酸浸”的效率可以采用的措施有(写出其中一种)
(2)“滤渣”中主要成分为(填化学式)
(3)①“沉铁”过程中有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为②“沉铁”过程中往往有副产物
 生成,分析原因是
生成,分析原因是③若用
 “沉铁”,则无副产物
“沉铁”,则无副产物 产生,当反应完成时,溶液
产生,当反应完成时,溶液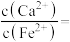
(4)利用制备的铁黄进行如图实验:
(5)铁有
 、
、 、
、 三种晶型,各晶胞结构下图,则
三种晶型,各晶胞结构下图,则 、
、 两种晶胞中铁原子的配位数之比为
两种晶胞中铁原子的配位数之比为 -Fe的晶胞边长为
-Fe的晶胞边长为 ,则
,则 原子半径为
原子半径为 。
。
您最近一年使用:0次
2 . 化合物K常用作医药中间体、材料中间体,其合成路线如图所示。 。
。
(1)检验苯中含有A的化学试剂为_______ ,C中官能团的名称为_______ 。
(2)H→I的反应类型为_______ ,G的结构简式为_______ ,其碳原子的杂化方式为_______ 。
(3)J→K的化学方程式为_______ 。
(4)D的同分异构体中,仅含有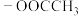 、
、 和苯环结构的有
和苯环结构的有____ 种(不考虑立体异构)。
(5)根据上述信息,写出以苯和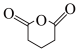 为主要原料制备
为主要原料制备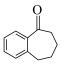 的合成路线:
的合成路线:_____ 。

 。
。②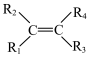
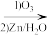
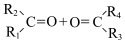 。
。
(1)检验苯中含有A的化学试剂为
(2)H→I的反应类型为
(3)J→K的化学方程式为
(4)D的同分异构体中,仅含有
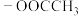 、
、 和苯环结构的有
和苯环结构的有(5)根据上述信息,写出以苯和
 为主要原料制备
为主要原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
解题方法
3 . 工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。 的原理为
的原理为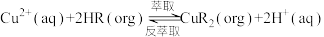 (org为有机相)。
(org为有机相)。
回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是_______ (答出一条即可),已知浸出渣中含有单质S,写出“酸浸”时 与
与 反应的离子方程式:
反应的离子方程式:______________ 。
(2)“萃取”后的溶液中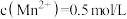 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度 时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
_______ [已知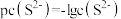 ,该溶液中
,该溶液中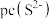 和pH的关系为
和pH的关系为 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(3)写出“碳化沉锰”过程中发生反应的离子方程式:_______ 。
(4)试剂X为_______ (填化学式);“系列操作”包括_______ 、过滤、洗涤和干燥。
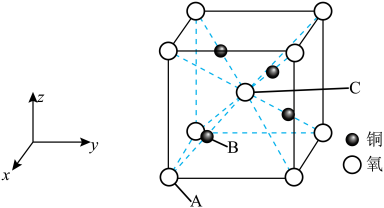
(5)铜的一种氧化物晶胞如图所示,晶胞参数为a pm, 为阿伏加德罗常数的值。A、B的原子坐标分别为
为阿伏加德罗常数的值。A、B的原子坐标分别为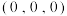 、
、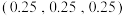 ,则C的原子坐标为
,则C的原子坐标为_______ ,该晶体密度为_______  。
。
 ,还含有少量
,还含有少量 等)和辉铜矿(主要成分为
等)和辉铜矿(主要成分为 ,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。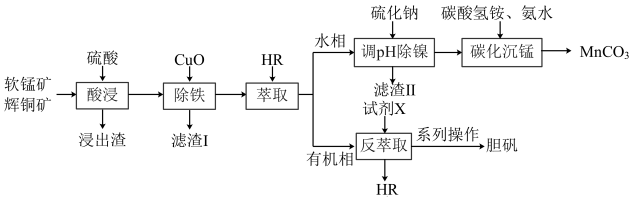
 的原理为
的原理为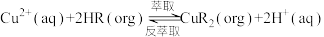 (org为有机相)。
(org为有机相)。回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是
 与
与 反应的离子方程式:
反应的离子方程式:(2)“萃取”后的溶液中
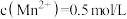 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度 时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
时,可认为已除尽,已知“调pH除镍”时应控制溶液pH的最小值是1.8,最大值是5.8,则
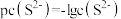 ,该溶液中
,该溶液中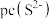 和pH的关系为
和pH的关系为 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(3)写出“碳化沉锰”过程中发生反应的离子方程式:
(4)试剂X为
(5)铜的一种氧化物晶胞如图所示,晶胞参数为a pm,
 为阿伏加德罗常数的值。A、B的原子坐标分别为
为阿伏加德罗常数的值。A、B的原子坐标分别为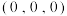 、
、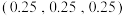 ,则C的原子坐标为
,则C的原子坐标为 。
。
您最近一年使用:0次
解题方法
4 . 硫酸四氨合铜晶体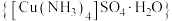 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
实验(一)制备 ,装置如图所示。
,装置如图所示。___________ 。该反应中浓硫酸表现出的性质有___________ 。
(2)持续反应一段时间后C装置中的现象为___________ 。
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。
①不能向A装置的混合物中加入水,其原因是___________ 。
② 的作用是
的作用是___________ 。
实验(二)制备硫酸四氨合铜晶体。
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是___________ (写出离子方程式)。
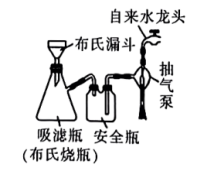
(5)相对普通过滤,利用图2装置分离晶体,其突出优点有___________ (答一条即可)。
实验(三)测定硫酸四氨合铜晶体纯度。
取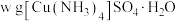 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成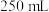 溶液,准确量取
溶液,准确量取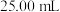 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用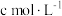
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液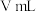 。相关反应:
。相关反应: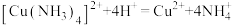 ,
, ,
,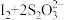
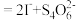 。
。
(6)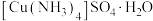 产品的纯度为
产品的纯度为___________ 。若①摇动锥形瓶时间过长,空气进入较多;②滴加稀硫酸过多,则上述两种情况可能会导致测得结果___________ (填字母)。(已知: 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)
A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
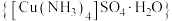 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。实验(一)制备
 ,装置如图所示。
,装置如图所示。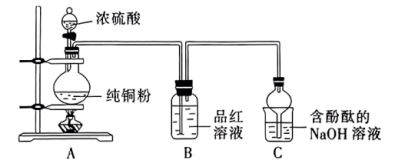
(2)持续反应一段时间后C装置中的现象为
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的
 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。①不能向A装置的混合物中加入水,其原因是
②
 的作用是
的作用是实验(二)制备硫酸四氨合铜晶体。
| 步骤 | 实验操作及主要现象 |
 | 取一定量 晶体溶于蒸馏水得到 晶体溶于蒸馏水得到 溶液 溶液 |
 | 向步骤 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 |
 | 向步骤 所得溶液中滴加 所得溶液中滴加 的乙醇,静置析出深蓝色晶体,用下图装置过滤 的乙醇,静置析出深蓝色晶体,用下图装置过滤 |
 | 取步骤 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 左右小心烘干,得到 左右小心烘干,得到 |
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是(5)相对普通过滤,利用图2装置分离晶体,其突出优点有
实验(三)测定硫酸四氨合铜晶体纯度。
取
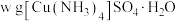 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成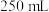 溶液,准确量取
溶液,准确量取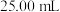 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用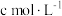
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液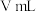 。相关反应:
。相关反应: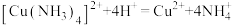 ,
, ,
,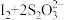
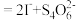 。
。(6)
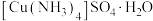 产品的纯度为
产品的纯度为 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
您最近一年使用:0次
5 . 下列有关物质除杂所选试剂或方法错误的是
| 选项 | 物质(杂质) | 除杂试剂或方法 |
| A | Na2CO3(NaHCO3) | 直接加热 |
| B | FeCl2溶液(FeCl3) | 通入适量的SO2 |
| C | Cl2(HCl) | 饱和食盐水、浓硫酸,洗气 |
| D | CO2(NO2) | 通过冰盐浴液化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 .  催化重整
催化重整 的反应:
的反应:
Ⅰ.

主要副反应:
Ⅱ.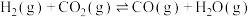

Ⅲ.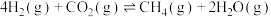

在恒容反应器中按体积分数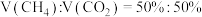 充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。
充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。
(1)
___________ (用含 、
、 的代数式表达),
的代数式表达),
___________ 0(填“>”“=”或“<”)。
(2)300~580℃时, 的体积分数不断增大,是由于
的体积分数不断增大,是由于___________ 。
(3)氯钯酸钙(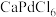 )固体加热时部分分解为
)固体加热时部分分解为 、Pd、
、Pd、 ,500K时平衡常数
,500K时平衡常数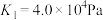 。500K温度下,在一硬质玻璃烧瓶中加入过量
。500K温度下,在一硬质玻璃烧瓶中加入过量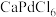 ,抽真空后,用针管向玻璃烧瓶通入溴蒸气。溴蒸气初始压强为20.0kPa,500K平衡时,测得烧瓶中压强为30.2kPa,则
,抽真空后,用针管向玻璃烧瓶通入溴蒸气。溴蒸气初始压强为20.0kPa,500K平衡时,测得烧瓶中压强为30.2kPa,则
___________ Pa,反应2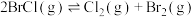 的平衡常数
的平衡常数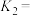
___________ 。
(4)利用重整废气中的 、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。
、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。___________ 。
②若某废气中含有的 和CO的体积比为1∶1,废气中
和CO的体积比为1∶1,废气中 和CO的体积分数共为8.96%。假设A中处理了标准状况下10
和CO的体积分数共为8.96%。假设A中处理了标准状况下10 的废气,其中
的废气,其中 和CO全部转化成
和CO全部转化成 ,理论上可制得
,理论上可制得
___________ kg。
 催化重整
催化重整 的反应:
的反应:Ⅰ.


主要副反应:
Ⅱ.
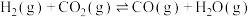

Ⅲ.
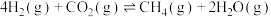

在恒容反应器中按体积分数
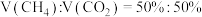 充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。
充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。
(1)

 、
、 的代数式表达),
的代数式表达),
(2)300~580℃时,
 的体积分数不断增大,是由于
的体积分数不断增大,是由于(3)氯钯酸钙(
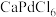 )固体加热时部分分解为
)固体加热时部分分解为 、Pd、
、Pd、 ,500K时平衡常数
,500K时平衡常数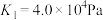 。500K温度下,在一硬质玻璃烧瓶中加入过量
。500K温度下,在一硬质玻璃烧瓶中加入过量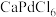 ,抽真空后,用针管向玻璃烧瓶通入溴蒸气。溴蒸气初始压强为20.0kPa,500K平衡时,测得烧瓶中压强为30.2kPa,则
,抽真空后,用针管向玻璃烧瓶通入溴蒸气。溴蒸气初始压强为20.0kPa,500K平衡时,测得烧瓶中压强为30.2kPa,则
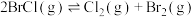 的平衡常数
的平衡常数
(4)利用重整废气中的
 、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。
、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知B中的装置使用了阳离子交换膜。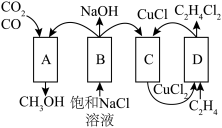
②若某废气中含有的
 和CO的体积比为1∶1,废气中
和CO的体积比为1∶1,废气中 和CO的体积分数共为8.96%。假设A中处理了标准状况下10
和CO的体积分数共为8.96%。假设A中处理了标准状况下10 的废气,其中
的废气,其中 和CO全部转化成
和CO全部转化成 ,理论上可制得
,理论上可制得
您最近一年使用:0次
名校
解题方法
7 . 氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)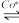 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
第一步:Co*(s)+N2O(g) CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
第二步:___________ (填写第二步反应的热化学方程式)。
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g) N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是___________ (填序号)。
a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,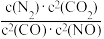 的值不再改变
的值不再改变
(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:___________ (填“Cat-1”或“Cat-2”)。
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是___________ 。
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g) N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。
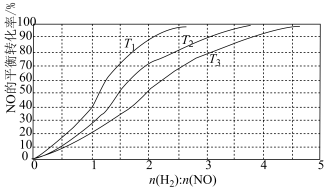
为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:___________ ﹔判断理由是___________ 。
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为___________ mol·L-1·min-1,该反应的平衡常数Kp=___________ (写出计算表达式)。
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)
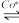 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。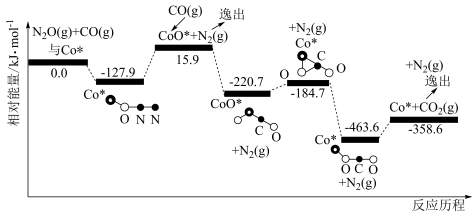
第一步:Co*(s)+N2O(g)
 CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;第二步:
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g)
 N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,
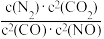 的值不再改变
的值不再改变(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
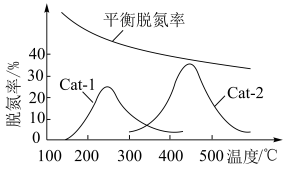
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g)
 N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为
您最近一年使用:0次
8 . 常温下,向20 mL浓度均为0.1 mol⋅L 盐酸和醋酸(
盐酸和醋酸(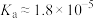 )的混合溶液中滴加0.1 mol⋅L
)的混合溶液中滴加0.1 mol⋅L 的氨水(
的氨水(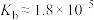 ),测得混合溶液的电阻率(电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列叙述正确的是
),测得混合溶液的电阻率(电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列叙述正确的是
 盐酸和醋酸(
盐酸和醋酸(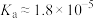 )的混合溶液中滴加0.1 mol⋅L
)的混合溶液中滴加0.1 mol⋅L 的氨水(
的氨水(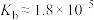 ),测得混合溶液的电阻率(电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列叙述正确的是
),测得混合溶液的电阻率(电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列叙述正确的是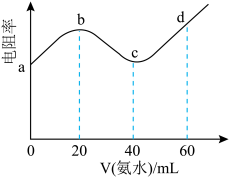
A.a→c过程中,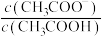 逐渐增大 逐渐增大 |
| B.c→d过程中,水的电离程度一直增大 |
C.c点溶液中,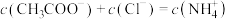 |
D.d点时,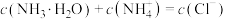 |
您最近一年使用:0次
9 . 工业合成氨是人类科学技术上的一项重大突破,是化学对社会发展的巨大贡献之一。在催化剂作用下发生
 ,回答下列问题:
,回答下列问题:
(1)依据键能信息,
__________  。
。
(2)其他条件不变,下列能加快反应速率,并提高 的平衡转化率的是__________(填字母)。
的平衡转化率的是__________(填字母)。
(3)恒温恒容条件下,下列能说明该反应已达到平衡状态的是____(填字母)
(4)在恒容密闭容器中,初始时氮气和氢气的体积比是1:3,300℃、500℃条件下平衡时氨的体积分数随压强( )的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度(
)的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度( )的变化示意图如下。
)的变化示意图如下。__________ (填“a”“b”“c”或“d”)。
②M、N、Q三点对应的平衡常数分别为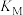 、
、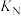 、
、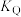 ,三平衡常数的大小关系为
,三平衡常数的大小关系为_________ 。
(5)400℃、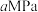 条件下,初始时氮气和氢气的体积比是
条件下,初始时氮气和氢气的体积比是 ,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
__________  。
。
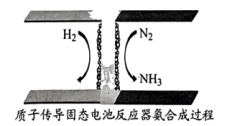
(6)利用质子传导固态电池合成氨示意图如下,生成氨气的电极反应式为____________________ 。 用于制氨水和铵盐。常温下,将浓度均为
用于制氨水和铵盐。常温下,将浓度均为 氨水和
氨水和 溶液等体积混合,混合溶液显
溶液等体积混合,混合溶液显__________ (填“酸性”“碱性”或“中性”),混合溶液
__________ 。已知:常温下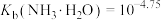

 ,回答下列问题:
,回答下列问题:化学键 |
|
|
|
键能(kJ/mol) | 946 | 436 | 391 |

 。
。(2)其他条件不变,下列能加快反应速率,并提高
 的平衡转化率的是__________(填字母)。
的平衡转化率的是__________(填字母)。A.固定体系体积,加大 投料量 投料量 | B.升高反应体系的温度 |
| C.降低平衡体系的压强 | D.改用效果更好的催化剂 |
| A.气体的密度保持不变 | B. 、 、 、 、 的物质的量之比为 的物质的量之比为 |
| C.气体的平均摩尔质量保持不变 | D.消耗 ,同时消耗 ,同时消耗 |
 )的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度(
)的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度( )的变化示意图如下。
)的变化示意图如下。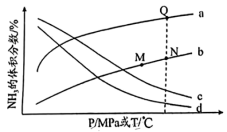
②M、N、Q三点对应的平衡常数分别为
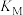 、
、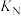 、
、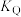 ,三平衡常数的大小关系为
,三平衡常数的大小关系为(5)400℃、
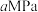 条件下,初始时氮气和氢气的体积比是
条件下,初始时氮气和氢气的体积比是 ,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
 。
。(6)利用质子传导固态电池合成氨示意图如下,生成氨气的电极反应式为
 用于制氨水和铵盐。常温下,将浓度均为
用于制氨水和铵盐。常温下,将浓度均为 氨水和
氨水和 溶液等体积混合,混合溶液显
溶液等体积混合,混合溶液显
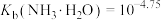
您最近一年使用:0次
10 . 某温度下,饱和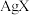 和
和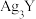 溶液,
溶液,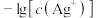 与
与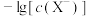 、
、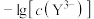 的关系如图所示,
的关系如图所示, 为两线段的交点。下列说法错误的是
为两线段的交点。下列说法错误的是
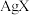 和
和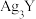 溶液,
溶液,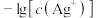 与
与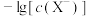 、
、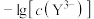 的关系如图所示,
的关系如图所示, 为两线段的交点。下列说法错误的是
为两线段的交点。下列说法错误的是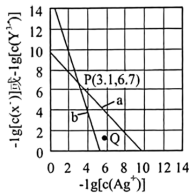
A.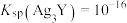 |
| B.图中a代表AgX溶液 |
C.Q点所对应AgX生成沉淀,而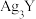 不生成沉淀 不生成沉淀 |
D.向NaX、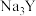 均为 均为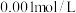 混合溶液中滴加 混合溶液中滴加 溶液,先产生 溶液,先产生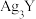 沉淀 沉淀 |
您最近一年使用:0次






