氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)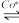 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
第一步:Co*(s)+N2O(g) CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
第二步:___________ (填写第二步反应的热化学方程式)。
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g) N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是___________ (填序号)。
a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,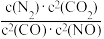 的值不再改变
的值不再改变
(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:___________ (填“Cat-1”或“Cat-2”)。
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是___________ 。
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g) N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。
为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:___________ ﹔判断理由是___________ 。
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为___________ mol·L-1·min-1,该反应的平衡常数Kp=___________ (写出计算表达式)。
(1)一氧化二氮是一种强大的温室气体,可用CO(g)在Co*的催化作用下还原N2O(g)以除去污染,反应的化学方程式为CO(g)+N2O(g)
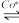 CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。
CO2(g)+N2(g),其反应历程和能量变化如图所示(逸出后物质认为状态未发生变化,在图中略去)。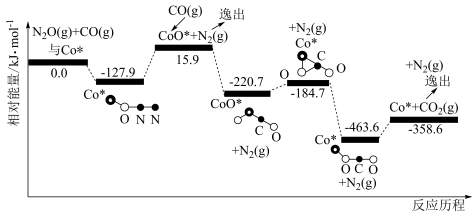
第一步:Co*(s)+N2O(g)
 CoO*(s)+N2(g) ΔH=+15.9kJ/mol;
CoO*(s)+N2(g) ΔH=+15.9kJ/mol;第二步:
(2)汽车尾气中的NO可以和CO在催化转换器中发生反应,以减少尾气污染。某温度时,向2L恒容密闭体系中通入2molCO和1molNO气体,发生反应2CO(g)+2NO(g)
 N2(g)+2CO2(g),下列能说明反应达到平衡状态的是
N2(g)+2CO2(g),下列能说明反应达到平衡状态的是a.2v正(NO)=v逆(N2)
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,
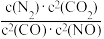 的值不再改变
的值不再改变(3)某研究小组探究温度和催化剂对CO、NO转化率的影响。将CO和NO按物质的量之比1∶1以一定的流速分别通过两种催化剂(Cat-1和Cat-2)进行反应,相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
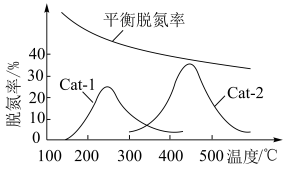
②催化剂在Cat-2条件下,450℃后,脱氮率随温度升高而下降的原因是
(4)用H2也可还原NO气体,其反应为2H2(g)+2NO(g)
 N2(g)+2H2O(g) ΔH=-752kJ/mol。
N2(g)+2H2O(g) ΔH=-752kJ/mol。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
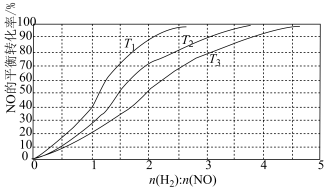
②T1温度下,充入H2、NO分别为3mol、3mol,容器内的压强为wPa,反应进行到6min时达平衡,0~6min内N2的平均反应速率为
更新时间:2024/05/16 19:01:59
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】“碳中和”有利于全球气候改善, 的资源化利用成为研究重点。
的资源化利用成为研究重点。
(1)二氧化碳加氢合成二甲醚的反应包括三个相互关联的反应过程:
i.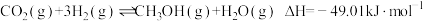
ii.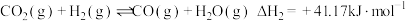
iii.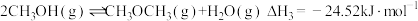
①写出 和
和 生成
生成 的热化学方程式为
的热化学方程式为___________ 。
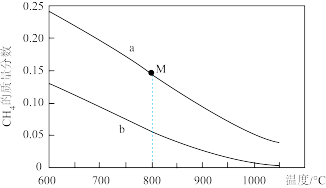
②在压强3.0MPa,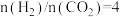 ,不同温度下
,不同温度下 的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的 的物质的量占消耗
的物质的量占消耗 总的物质的量的百分比),
总的物质的量的百分比),
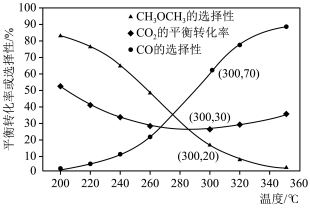
当温度超过290℃, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。根据图中数据计算300℃时, 的平衡产率为
的平衡产率为___________ 。
(2) 重整制
重整制 的过程为:
的过程为: 。发生的副反应为(1)中ii在刚性密闭容器中,进料比
。发生的副反应为(1)中ii在刚性密闭容器中,进料比 分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
①曲线a的进料比为___________ 。
②有利于提高 平衡转化率的措施是
平衡转化率的措施是___________ 。(写出两条)。
③M点 的平衡转化率为85%,
的平衡转化率为85%, 的平衡转化率为88%,则副反应的压强平衡常数
的平衡转化率为88%,则副反应的压强平衡常数
___________ (保留2位有效数字)。(已知:分压=总压×该组分的物质的量分数)
 的资源化利用成为研究重点。
的资源化利用成为研究重点。(1)二氧化碳加氢合成二甲醚的反应包括三个相互关联的反应过程:
i.
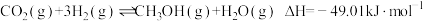
ii.
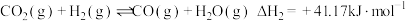
iii.
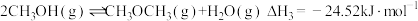
①写出
 和
和 生成
生成 的热化学方程式为
的热化学方程式为②在压强3.0MPa,
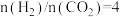 ,不同温度下
,不同温度下 的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的 的物质的量占消耗
的物质的量占消耗 总的物质的量的百分比),
总的物质的量的百分比),
当温度超过290℃,
 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是 的平衡产率为
的平衡产率为(2)
 重整制
重整制 的过程为:
的过程为: 。发生的副反应为(1)中ii在刚性密闭容器中,进料比
。发生的副反应为(1)中ii在刚性密闭容器中,进料比 分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
分别等于1.0、2.0,且起始时压强相同。平衡时甲烷的质量分数与温度的关系如图所示:
①曲线a的进料比为
②有利于提高
 平衡转化率的措施是
平衡转化率的措施是③M点
 的平衡转化率为85%,
的平衡转化率为85%, 的平衡转化率为88%,则副反应的压强平衡常数
的平衡转化率为88%,则副反应的压强平衡常数
您最近一年使用:0次
【推荐2】能源、材料、环保、健康等是当今社会重要的研究主题,化学与这些主题密切相关,在其研究与应用中发挥着重要作用。甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=_______ 。
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
(3)对于反应I,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法正确的是_______。

(4)若在2L密闭容器中充入3 mol H2和1 mol CO2发生反应I,250℃时反应的平衡常数K=____ (列出计算式)。
(5)甲醇燃料电池的工作原理如图所示,则Y电极为_______ (填“正极”或“负极”), X电极的电极反应式为_______ 。换膜若使用该电池完成铁制品镀银,当铁制品质量增加64.8g时,理论上消耗甲醇的质量为_______ g。

反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1。 |
| D.混合气体的压强不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率。 |
(5)甲醇燃料电池的工作原理如图所示,则Y电极为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为_______ ,若从B点到D点,可采用的措施是_______ (填序号)。

a.加入少量盐酸
b.加入少量碳酸钠
c.加入少量氢氧化钠
d.降低温度
(2)饮用水中的 主要来自于
主要来自于 。已知在微生物的作用下,
。已知在微生物的作用下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

1 mol 全部被氧化成
全部被氧化成 的热化学方程式为
的热化学方程式为_______ 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
 +6Fe+17H2O+2H+=2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为
+6Fe+17H2O+2H+=2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为___ ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为____ 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的 和
和 ,其中一种方法是:在废水中加入镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++
,其中一种方法是:在废水中加入镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++ +
+ =MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是
=MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是_____ 。
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为

a.加入少量盐酸
b.加入少量碳酸钠
c.加入少量氢氧化钠
d.降低温度
(2)饮用水中的
 主要来自于
主要来自于 。已知在微生物的作用下,
。已知在微生物的作用下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
1 mol
 全部被氧化成
全部被氧化成 的热化学方程式为
的热化学方程式为(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
 +6Fe+17H2O+2H+=2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为
+6Fe+17H2O+2H+=2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的
 和
和 ,其中一种方法是:在废水中加入镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++
,其中一种方法是:在废水中加入镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++ +
+ =MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是
=MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】含碳化合物的合成与转化具有重要的研究价值和现实意义。由合成气(主要成分为 ,
, 和
和 )制甲醇,涉及的原理为:
)制甲醇,涉及的原理为:
①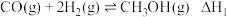
②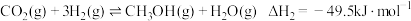
③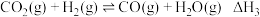
(1)反应①的
___________  ,该反应自发进行的条件为
,该反应自发进行的条件为___________ 。(填“高温”或“低温”)
(2)在 的恒压反应器中,按照
的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和
和 的选择性[
的选择性[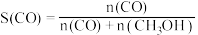 ,
, ]及
]及 的平衡转化率随温度的变化如图a所示。
的平衡转化率随温度的变化如图a所示。
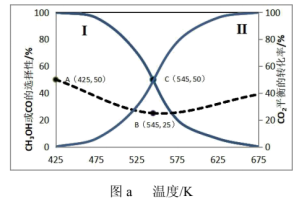
①曲线Ⅰ代表___________ 的选择性随温度变化曲线。
②反应③在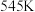 时的平衡常数
时的平衡常数
___________ 。(用分数表示)
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度变化如图所示:
的平衡产率随温度变化如图所示:

已知: 的平衡产率
的平衡产率
①其中纵坐标表示 的平衡产率的是图
的平衡产率的是图___________ (填“b”或“c”),该图中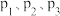 由大到小的顺序是
由大到小的顺序是___________ 。
②图c中, 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
 ,
, 和
和 )制甲醇,涉及的原理为:
)制甲醇,涉及的原理为:①
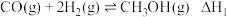
②
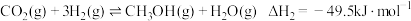
③
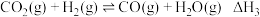
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |

 ,该反应自发进行的条件为
,该反应自发进行的条件为(2)在
 的恒压反应器中,按照
的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和
和 的选择性[
的选择性[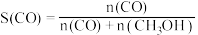 ,
, ]及
]及 的平衡转化率随温度的变化如图a所示。
的平衡转化率随温度的变化如图a所示。
①曲线Ⅰ代表
②反应③在
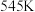 时的平衡常数
时的平衡常数
(3)不同压强下,按照
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度变化如图所示:
的平衡产率随温度变化如图所示:
已知:
 的平衡产率
的平衡产率
①其中纵坐标表示
 的平衡产率的是图
的平衡产率的是图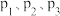 由大到小的顺序是
由大到小的顺序是②图c中,
 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】2020年9月我国明确提出2030年实现“碳达练”与2060年实现“碳中和”的目标,倡导绿色、环保、低碳的生活方式。二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:
Ⅰ.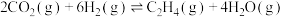

Ⅱ.

回答下列问题:
(1)反应Ⅰ能自发进行,则
___________ 0(填“<”“>”或“=”):该反应自发进行的条件是___________ (填“高温”或“低温”)。
(2)在密闭容器中通入1
 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。___________ (填标号)。
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率
②图1中点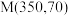 ,此时乙烯的选择性为
,此时乙烯的选择性为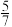 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
___________ (结果用分数表示)。
(3)利用电解法也可以实现 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:___________ 。
(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
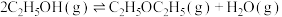
 。
。
实验测得: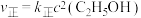 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用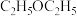 表示的平均反应速率为
表示的平均反应速率为___________  ,当温度变为
,当温度变为 时,
时,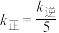 ,则
,则
___________  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(5)温度为T℃时、在恒容密闭容器中发生反应 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比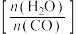 的变化曲线如图所示:
的变化曲线如图所示:
 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为___________ (填“正向”或“逆向”)。
 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:Ⅰ.
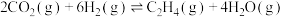

Ⅱ.


回答下列问题:
(1)反应Ⅰ能自发进行,则

(2)在密闭容器中通入1

 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。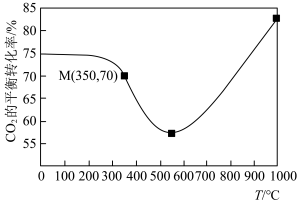
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将
 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率②图1中点
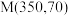 ,此时乙烯的选择性为
,此时乙烯的选择性为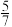 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
(3)利用电解法也可以实现
 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
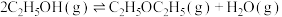
 。
。实验测得:
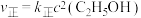 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用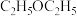 表示的平均反应速率为
表示的平均反应速率为 ,当温度变为
,当温度变为 时,
时,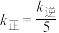 ,则
,则
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(5)温度为T℃时、在恒容密闭容器中发生反应
 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比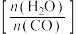 的变化曲线如图所示:
的变化曲线如图所示: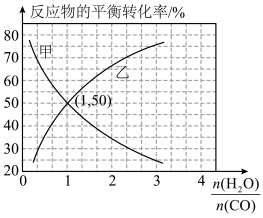

 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】化学在生产生活中有很多应用,按要求回答下列问题
(1)硫化氢( )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的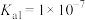 ,
,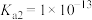 ,
, )
)
① 和
和 的VSEPR模型分别为
的VSEPR模型分别为___________ 、___________ 。
②室温下,若在 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的pH是
气体,此时溶液中的pH是___________ 。
(2)通过电化学循环法可将 转化为
转化为 和
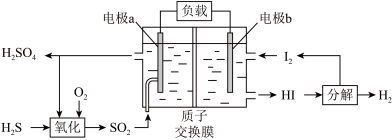
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: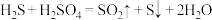 、
、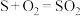
___________ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为___________ 。
(3)合成氨是人工固氮最重要的途径。
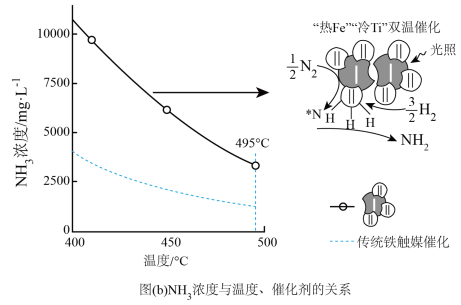
①传统铁触媒催化会面临两难问题:高温可增大反应速率,但 的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为
的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为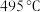 时,
时, (Ⅰ)的温度为
(Ⅰ)的温度为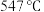 ,而Ti-H(Ⅱ)的温度为
,而Ti-H(Ⅱ)的温度为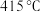 ,可解决该问题。
,可解决该问题。___________ (填序号)。
A.ⅰ为氮氮三键的断裂过程,ⅰ、ⅱ、ⅲ在高温区发生
B.ⅳ为 原子由Fe区域向Ti-H区域的传递过程
原子由Fe区域向Ti-H区域的传递过程
C.“热 ”高于体系温度,
”高于体系温度, 在表面断裂,有利于提高合成氨反应速率
在表面断裂,有利于提高合成氨反应速率
D.“冷Ti”低于体系温度,氨气在其表面生成,有利于提高氨的平衡产率
②以 和
和 为原料通过电化学方法也能实现合成氨,反应装置如图所示
为原料通过电化学方法也能实现合成氨,反应装置如图所示___________ 。同温同压下,相同时间内,若进口I的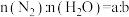 ,出口I处气体体积为进口I处的y倍,则
,出口I处气体体积为进口I处的y倍,则 的转化率为
的转化率为___________ (用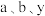 表示)。
表示)。
(4)P与 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾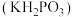 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数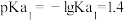 ;
;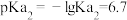 ;
; 。以
。以 和
和 为原料制备
为原料制备 和
和 的装置如图。
的装置如图。 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是___________ (填“正”或“酸式”)盐。
②常温下 溶液
溶液
___________ 7(填“>”、“<”或“=”)。
③膜2为___________ (填“阴”或“阳”)离子交换膜, 电极上发生的电极反应式为:
电极上发生的电极反应式为:___________ 。
(1)硫化氢(
 )、二氧化硫(
)、二氧化硫( )是有害气体,可用多种方法进行脱除。(已知25℃时,
)是有害气体,可用多种方法进行脱除。(已知25℃时, 的
的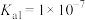 ,
,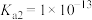 ,
, )
)①
 和
和 的VSEPR模型分别为
的VSEPR模型分别为②室温下,若在
 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,此时溶液中的pH是
气体,此时溶液中的pH是(2)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: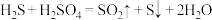 、
、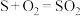
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(3)合成氨是人工固氮最重要的途径。
①传统铁触媒催化会面临两难问题:高温可增大反应速率,但
 的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为
的平衡产率较低。我国科研人员研制了Ti-H(Ⅱ)-Fe(Ⅰ)双温催化剂,通过光辐射产生温差,如体系温度为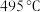 时,
时, (Ⅰ)的温度为
(Ⅰ)的温度为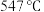 ,而Ti-H(Ⅱ)的温度为
,而Ti-H(Ⅱ)的温度为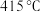 ,可解决该问题。
,可解决该问题。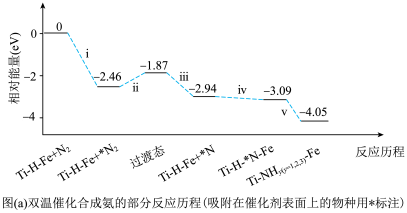
A.ⅰ为氮氮三键的断裂过程,ⅰ、ⅱ、ⅲ在高温区发生
B.ⅳ为
 原子由Fe区域向Ti-H区域的传递过程
原子由Fe区域向Ti-H区域的传递过程C.“热
 ”高于体系温度,
”高于体系温度, 在表面断裂,有利于提高合成氨反应速率
在表面断裂,有利于提高合成氨反应速率D.“冷Ti”低于体系温度,氨气在其表面生成,有利于提高氨的平衡产率
②以
 和
和 为原料通过电化学方法也能实现合成氨,反应装置如图所示
为原料通过电化学方法也能实现合成氨,反应装置如图所示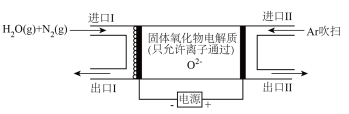
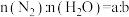 ,出口I处气体体积为进口I处的y倍,则
,出口I处气体体积为进口I处的y倍,则 的转化率为
的转化率为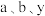 表示)。
表示)。(4)P与
 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾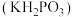 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数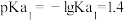 ;
;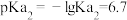 ;
; 。以
。以 和
和 为原料制备
为原料制备 和
和 的装置如图。
的装置如图。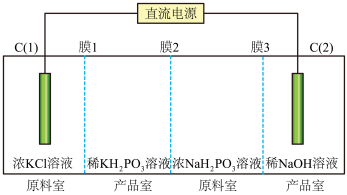
 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是②常温下
 溶液
溶液
③膜2为
 电极上发生的电极反应式为:
电极上发生的电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】工业合成氨与制备硝酸一般可连续生产,流程如下:
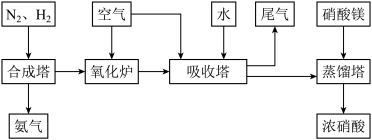
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___ 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___ 。
(2)合成塔中发生反应为:N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___ 573K(填“>”、“<”或“=”)。
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___ 。

(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___ 。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___ 。

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2
 4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
(4)吸收塔中反应为:3NO2+H2O
 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
您最近一年使用:0次
【推荐2】近年来,碳中和、碳达峰成为热点。以 、
、 为原料生产甲醇是一种有效利用二氧化碳的途径。
为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.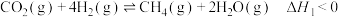
II.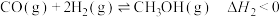
III.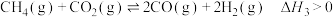
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)若某反应的平衡常数表达式为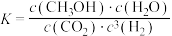 ,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:
,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: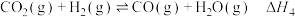 。在一定条件下,在合成塔中充入一定量
。在一定条件下,在合成塔中充入一定量 和
和 。不同压强时,
。不同压强时, 的平衡转化率如图a所示。当气体总压强恒定为
的平衡转化率如图a所示。当气体总压强恒定为 时,平衡时各物质的物质的量分数如图b所示。
时,平衡时各物质的物质的量分数如图b所示。
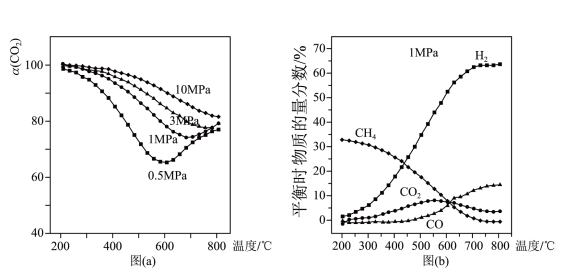
①图a中,相同温度下,压强越大, 的平衡转化率越大,其原因是
的平衡转化率越大,其原因是___________ 。
②由图b可知,
___________ 0(填“ ”、“
”、“ ”或“
”或“ ”);
”); 的物质的量分数随温度升高而增大,原因是
的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为 ),往恒容密闭容器中充入
),往恒容密闭容器中充入
 和
和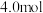
 ,发生反应I,初始压强为
,发生反应I,初始压强为 ,
, 达到平衡,压强为
达到平衡,压强为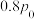 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。
途径二:涉及的反应有
I.
II.
III.
(5)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入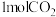 和
和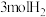 发生上述反应,达到平行时,容器中
发生上述反应,达到平行时,容器中 为
为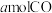 为
为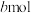 ,反应III的平衡常数为
,反应III的平衡常数为___________ 。(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
 、
、 为原料生产甲醇是一种有效利用二氧化碳的途径。
为原料生产甲醇是一种有效利用二氧化碳的途径。途径一:涉及的反应有
I.
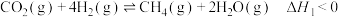
II.
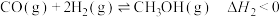
III.
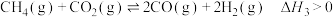
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
C.当反应达平衡状态时, |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
(2)若某反应的平衡常数表达式为
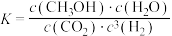 ,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:
,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:(3)工业中,对于反应I,通常同时存在副反应IV:
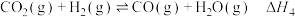 。在一定条件下,在合成塔中充入一定量
。在一定条件下,在合成塔中充入一定量 和
和 。不同压强时,
。不同压强时, 的平衡转化率如图a所示。当气体总压强恒定为
的平衡转化率如图a所示。当气体总压强恒定为 时,平衡时各物质的物质的量分数如图b所示。
时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,
 的平衡转化率越大,其原因是
的平衡转化率越大,其原因是②由图b可知,

 ”、“
”、“ ”或“
”或“ ”);
”); 的物质的量分数随温度升高而增大,原因是
的物质的量分数随温度升高而增大,原因是(4)在一定条件下(温度为
 ),往恒容密闭容器中充入
),往恒容密闭容器中充入
 和
和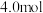
 ,发生反应I,初始压强为
,发生反应I,初始压强为 ,
, 达到平衡,压强为
达到平衡,压强为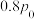 ,则
,则 的平衡转化率为
的平衡转化率为途径二:涉及的反应有
I.

II.

III.

(5)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入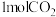 和
和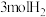 发生上述反应,达到平行时,容器中
发生上述反应,达到平行时,容器中 为
为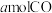 为
为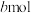 ,反应III的平衡常数为
,反应III的平衡常数为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐3】工业上先将金红石 (TiO2)转化为 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.
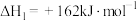

ii.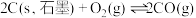
 K2
K2
iii.
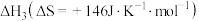

①
___________ 。
②反应iii自发进行的条件为___________ (填“低温”“高温”或“任意温度”)。
___________ (用含 的代数式表示)。
的代数式表示)。
(2)在 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应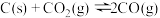 的平衡常数的值
的平衡常数的值
___________ (用含n、V的代数式表示)。
(3)用如图所示装置电解 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为___________ 交换膜(填“阳离子”或者“阴离子”),写出阴极室的电极反应式:___________ 。
 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.

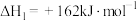

ii.
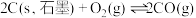
 K2
K2iii.

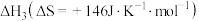

①

②反应iii自发进行的条件为

 的代数式表示)。
的代数式表示)。(2)在
 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。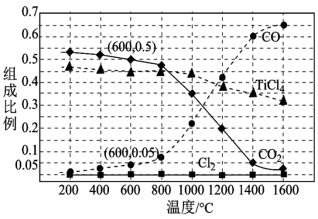
 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应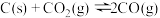 的平衡常数的值
的平衡常数的值
(3)用如图所示装置电解
 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为
您最近一年使用:0次



