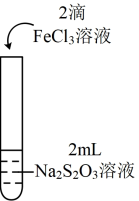
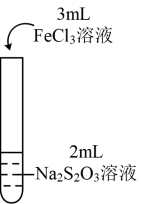
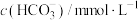1 . 甲醇(CH3OH)在化学工业、农业生产等领域有着广泛应用。回答下列问题:
(1)CH3OH的电子式为___________ 。
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的___________ 。已知相关物质的燃烧热数值如下表,则反应CO(g)+2H2(g) CH3OH(l)的∆H=
CH3OH(l)的∆H=___________ 。
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l) CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。
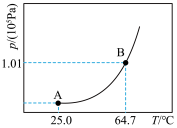
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是___________ 。
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到___________ (填字母)所示的现象。___________ kPa,馏分中甲醇的物质的量分数为___________ 。
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为___________ kW⋅h⋅kg-1(结果保留一位小数)。已知: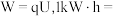 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的___________ 极相连,Al电极上发生的电极反应方程式为___________ 。
(1)CH3OH的电子式为
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的
 CH3OH(l)的∆H=
CH3OH(l)的∆H=| 物质 | CO(g) | H2(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -283.0 | -285.8 | -726.5 |
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l)
 CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到

| 物质 | CH3OH(l) | H2O(1) |
| p*(64.7℃)/kPa | 101.30 | 23.90 |
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为
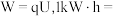 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的
您最近半年使用:0次
解题方法
2 . I.甲醇(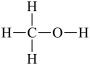 )是重要的化工原料,又可作为燃料。利用合成气(主要成分为
)是重要的化工原料,又可作为燃料。利用合成气(主要成分为 、
、 和
和 )在催化剂的作用下合成甲醇,涉及的反应有:
)在催化剂的作用下合成甲醇,涉及的反应有:
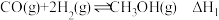
②

③
 与
与 反应生成
反应生成 和
和
已知反应①中的相关的化学键键能数据如下:(
 为
为 )
)| 化学键 |  |  |  |  |  |
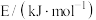 | 436 | 343 | 1076 | 465 | 413 |
(1)
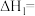
 。
。(2)反应③的热化学方程式为
 用含
用含 和
和 的式子表示)
的式子表示)Ⅱ.亚硝酰氯(
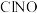 )是有机合成中的重要试剂,可通过反应:
)是有机合成中的重要试剂,可通过反应: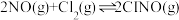 获得。
获得。(3)在恒温恒容的密闭容器中,氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
①
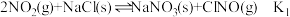
②

③

则
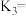
 、
、 的式子表示)。
的式子表示)。下列事实不能说明上述体系中反应③已达平衡状态的是
a.容器内气体的颜色不再变化 b.容器中气体的密度不再变化 c.
 不再发生变化
不再发生变化(4)300℃时,
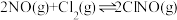 的正反应速率表达式为
的正反应速率表达式为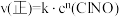 ,测得速率和浓度的关系如表所示:
,测得速率和浓度的关系如表所示:| 序号 | 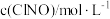 | 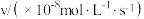 |
| ① | 0.30 | 0.36 |
| ② | 0.60 | 1.44 |
| ③ | 0.90 | 3.24 |
(5)对于反应③按投料比
 把
把 和
和 加入到压强恒为p的密闭容器中发生反应,平衡时
加入到压强恒为p的密闭容器中发生反应,平衡时 的转化率与温度T的关系如图所示:
的转化率与温度T的关系如图所示: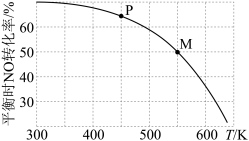
 的体积分数为
的体积分数为②M点的分压平衡常数

(6)一定条件下,在恒温恒容的密闭容器中按一定比例充入
 和
和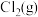 ,平衡时
,平衡时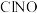 的体积分数随
的体积分数随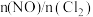 的变化图像如图所示,则A、B、C三状态中,
的变化图像如图所示,则A、B、C三状态中, 的转化率最大的是
的转化率最大的是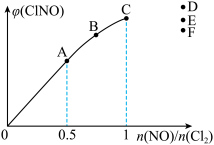
您最近半年使用:0次
解题方法
3 .  催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅰ:
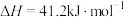
反应Ⅱ: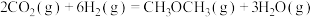
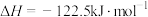
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示。(
的选择性随温度的变化如下图所示。( 的选择性
的选择性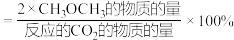 )
)
下列说法不正确 的是
 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:反应Ⅰ:

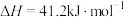
反应Ⅱ:
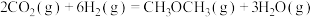
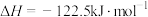
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示。(
的选择性随温度的变化如下图所示。( 的选择性
的选择性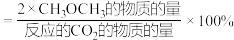 )
)下列说法
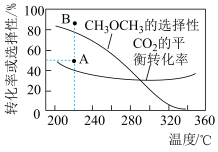
A.在240~320℃范围内,温度升高,平衡时 的物质的量先增大后减小 的物质的量先增大后减小 |
B.反应 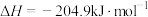 |
C.其他条件不变时,温度越高, 主要还原产物中碳元素的价态越高 主要还原产物中碳元素的价态越高 |
D.反应一段时间后,测得 的选择性为48%(图中A点),增大压强可能将 的选择性为48%(图中A点),增大压强可能将 的选择性提升到B点 的选择性提升到B点 |
您最近半年使用:0次
4 . 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.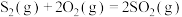

ⅱ.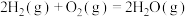

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.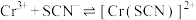
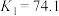
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、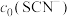 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、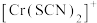 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随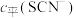 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。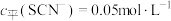 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
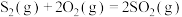

ⅱ.
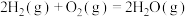

ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
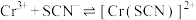
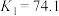
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数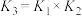 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、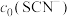 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、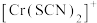 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随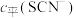 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。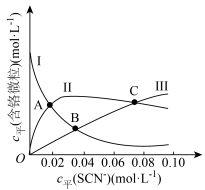
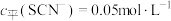 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近半年使用:0次
5 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢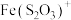 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应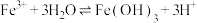
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢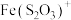 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应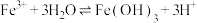
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近半年使用:0次
名校
解题方法
6 . 工业废气中的二氧化碳加氢制甲醇是“碳中和”的一个重要研究方向,在催化剂作用下,主要发生以下反应:
ⅰ.
 ;
;
ⅱ.
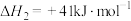 ;
;
ⅲ.
 。
。
(1)已知反应ⅲ正反应的活化能为 ,则其逆反应的活化能为
,则其逆反应的活化能为___________  (用含有
(用含有 的式子表示)。
的式子表示)。
(2)①一定温度下,向恒容密闭容器中通入物质的量之比为1:3的 与
与 ,发生以上3个反应,下列能说明反应达到平衡状态的是
,发生以上3个反应,下列能说明反应达到平衡状态的是___________ 。
A. B.平衡常数不再发生变化
B.平衡常数不再发生变化
C.气体密度不再改变 D.测得 的浓度保持不变
的浓度保持不变
②若起始压强为 ,反应经
,反应经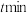 后达到平衡,此时体系压强为
后达到平衡,此时体系压强为 ,
, 的分压:
的分压: ,则
,则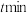 内反应的平均速率
内反应的平均速率
___________ 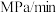 ,
, 的选择性为
的选择性为___________ %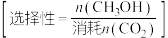 ,反应ⅰ的平衡常数
,反应ⅰ的平衡常数
___________ (保留两位有效数字)。
(3)在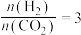 时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为
时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为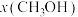 ,在
,在 ℃下的
℃下的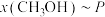 、在
、在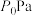 下的
下的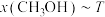 。如图所示。
。如图所示。___________ 。当 的平衡转化率为
的平衡转化率为 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
(4)为探究原料气中混入 气体对反应的影响。测得平衡时
气体对反应的影响。测得平衡时 的转化率
的转化率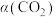 、
、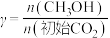 随原料气中
随原料气中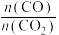 的变化如图所示。请解释
的变化如图所示。请解释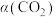 、
、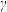 呈现该变化的趋势的原因:
呈现该变化的趋势的原因:___________ 。
ⅰ.

 ;
;ⅱ.

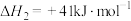 ;
;ⅲ.

 。
。(1)已知反应ⅲ正反应的活化能为
 ,则其逆反应的活化能为
,则其逆反应的活化能为 (用含有
(用含有 的式子表示)。
的式子表示)。(2)①一定温度下,向恒容密闭容器中通入物质的量之比为1:3的
 与
与 ,发生以上3个反应,下列能说明反应达到平衡状态的是
,发生以上3个反应,下列能说明反应达到平衡状态的是A.
 B.平衡常数不再发生变化
B.平衡常数不再发生变化C.气体密度不再改变 D.测得
 的浓度保持不变
的浓度保持不变②若起始压强为
 ,反应经
,反应经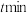 后达到平衡,此时体系压强为
后达到平衡,此时体系压强为 ,
, 的分压:
的分压: ,则
,则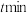 内反应的平均速率
内反应的平均速率
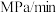 ,
, 的选择性为
的选择性为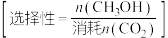 ,反应ⅰ的平衡常数
,反应ⅰ的平衡常数
(3)在
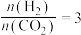 时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为
时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为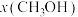 ,在
,在 ℃下的
℃下的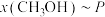 、在
、在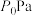 下的
下的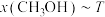 。如图所示。
。如图所示。
 的平衡转化率为
的平衡转化率为 时,反应条件可能为
时,反应条件可能为(4)为探究原料气中混入
 气体对反应的影响。测得平衡时
气体对反应的影响。测得平衡时 的转化率
的转化率 、
、 随原料气中
随原料气中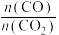 的变化如图所示。请解释
的变化如图所示。请解释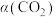 、
、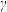 呈现该变化的趋势的原因:
呈现该变化的趋势的原因:
您最近半年使用:0次
名校
7 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(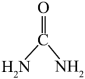 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近半年使用:0次
2024高三下·全国·专题练习
8 . 以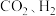 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
I.

II.
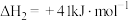
III.

回答下列问题:
(1)在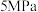 下,按照
下,按照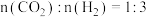 投料,假设只发生反应I和II,平衡时,
投料,假设只发生反应I和II,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: 的曲线为
的曲线为___________ (填“m”或“n”)。
②解释 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因___________ 。
③下列说法正确的是___________ (填字母)。
A.温度越高,越有利于工业生产
B.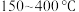 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
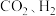 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:I.


II.

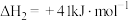
III.


回答下列问题:
(1)在
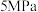 下,按照
下,按照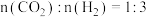 投料,假设只发生反应I和II,平衡时,
投料,假设只发生反应I和II,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
 的曲线为
的曲线为②解释
 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法正确的是
A.温度越高,越有利于工业生产

B.
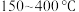 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
您最近半年使用:0次
解题方法
9 . 将CO、CO2转化为甲烷、甲醇、甲酸等有机物是实现“碳中和”重要途径。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=___________ kJ/mol。
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。___________ (填“升温”或“降温”)。
②图中表示H2转化率曲线是___________ (填标号)。
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(3)电解时,阴极生成HCOOH的电极反应式为___________ 。通过电解制备HCHO应选择电压为___________ V(填U1或U2)。
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为___________ 。
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=___________ 。(保留两位小数)
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的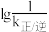 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则___________ 表示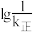 随温度变化的曲线,理由是
随温度变化的曲线,理由是___________ 。
Ⅰ.工业上利用H2与CO反应制甲烷,存在如下反应:
反应i:CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H1=-206.2kJ/mol
反应ii:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.2kJ/mol
反应iii:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H3
回答下列问题:
(1)∆H3=
(2)一定温度下,在固定容积的容器中通入H2、CO发生上述反应,平衡时CO和H2的转化率及CH4和CO2的产率随
 变化的情况如图所示,其中曲线b表示CO的转化率。
变化的情况如图所示,其中曲线b表示CO的转化率。
②图中表示H2转化率曲线是
Ⅱ.用光电化学法将CO2还原为有机物实现碳资源的再生利用。电解装置和其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如下图所示。

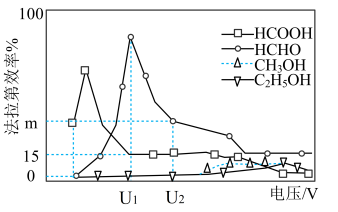
 n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(3)电解时,阴极生成HCOOH的电极反应式为
(4)当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2.则生成HCOOH的法拉第效率m为
Ⅲ.工业上用CO2和H2催化合成甲醇存在如下反应:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0
CH3OH(g)+H2O(g) ∆H<0副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H>0
(5)某温度下,在装有催化剂的密闭容器中投入1mol CO2和3mol H2,发生上述反应。达平衡时容器中CH3OH的物质的量为0.6mol,CO的物质的量为0.1mol。则此条件下副反应的平衡常数K=
(6)已知CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H<0,v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2)(k正、k逆分别为正、逆向反应速率常数)。该反应的
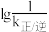 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则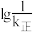 随温度变化的曲线,理由是
随温度变化的曲线,理由是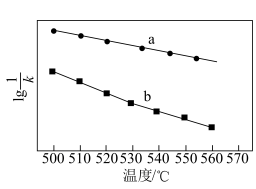
您最近半年使用:0次
10 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.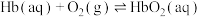
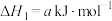
ⅱ.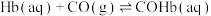
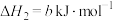
ⅱ.

ⅳ.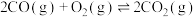

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
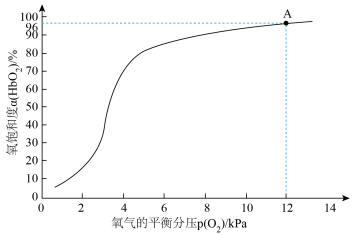
(3)36.5℃时,氧饱和度[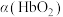 ,
,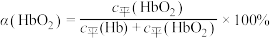 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数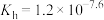 ,
,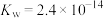 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
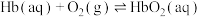
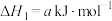
ⅱ.
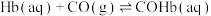
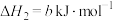
ⅱ.


ⅳ.
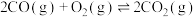

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若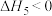 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中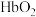 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
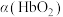 ,
,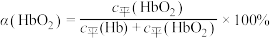 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数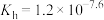 ,
,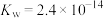 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
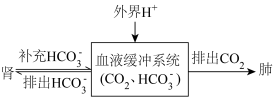
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近半年使用:0次