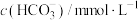解题方法
1 . 在一定条件下的密闭容器中发生反应: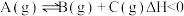 下列措施中,不能提高A的平衡转化率的是
下列措施中,不能提高A的平衡转化率的是
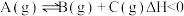 下列措施中,不能提高A的平衡转化率的是
下列措施中,不能提高A的平衡转化率的是| A.恒容条件下通入稀有气体 | B.及时分离出C |
| C.降低反应温度 | D.增大容器的体积 |
您最近半年使用:0次
名校
解题方法
2 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为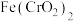 ,还含有
,还含有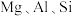 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾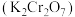 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时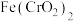 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
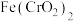 ,还含有
,还含有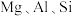 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾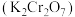 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
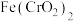 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近半年使用:0次
名校
3 . 甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。
已知, 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入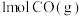 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。
(2)在 恒温密闭容器中充入
恒温密闭容器中充入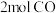 和
和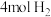 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,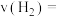
___________  。
。
(3)为了提高CO的转化率,可采取的措施是(写出两条):___________ 。
 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。已知,
 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入
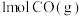 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。| A.混合气体的密度不再改变 | B.混合气体的平均相对分子质量不再改变 |
| C.两种反应物转化率的比值不再改变 | D.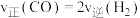 |
 恒温密闭容器中充入
恒温密闭容器中充入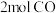 和
和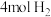 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,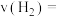
 。
。(3)为了提高CO的转化率,可采取的措施是(写出两条):
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
4 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。
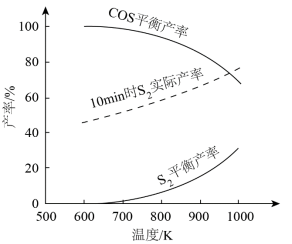
②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
您最近半年使用:0次
名校
解题方法
5 . 一定温度下,在容积为 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示:
2.根据图上信息,从反应开始到第一次达到平衡状态时, 的平均反应速率为
的平均反应速率为___________ 。
3.在 时,可能改变的条件是___________。
时,可能改变的条件是___________。
4.对于该反应,能否通过改变条件使 完全转化为
完全转化为 ?
?___________ (选填“能”或“不能”,原因是___________ 。
 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示: 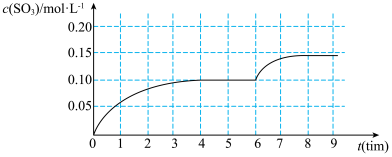
A. | B.压强不变 |
C. 浓度不再发生变化 浓度不再发生变化 | D.密度不变 |
 的平均反应速率为
的平均反应速率为3.在
 时,可能改变的条件是___________。
时,可能改变的条件是___________。| A.降低温度 | B.增加 浓度 浓度 | C.减小压强 | D.增加 浓度 浓度 |
 完全转化为
完全转化为 ?
?
您最近半年使用:0次
6 . 实验室模拟某含有机酸 工业废水的处理过程。
工业废水的处理过程。
 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:
(1) 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:

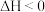
①基态 的价电子排布式为
的价电子排布式为___________ 。
②下列有关上述络合反应的说法中,正确的有___________ (填标号)。
A.反应达平衡时,溶液的颜色不再变化
B.增大 浓度,逆反应速率减小
浓度,逆反应速率减小
C. 过低不利于
过低不利于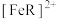 的生成
的生成
D.升高温度,该平衡正向移动
(2)紫外光催化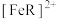 降解:
降解:
若有机酸为 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为:___________ 。
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:
(i)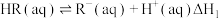
(ii)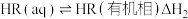
(iii)
(3)根据盖斯定律,反应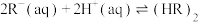 (有机相)的
(有机相)的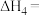
___________ 。
(4)水相的 以及体系温度
以及体系温度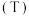 对
对 的平衡分配比
的平衡分配比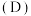 有影响。
有影响。
已知: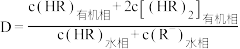 。
。
①常温下,配制体积相同、 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到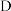 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析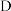 随
随 升高而降低的原因
升高而降低的原因___________ 。 溶液
溶液 时,
时,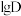 随
随 的变化曲线如图所示。
的变化曲线如图所示。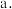 萃取宜在
萃取宜在___________ 温度下进行(填“较高”或“较低”)。
 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数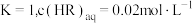 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中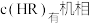
___________ 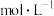 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数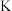
___________ (写出计算过程)。
 工业废水的处理过程。
工业废水的处理过程。 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:(1)
 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:
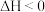
①基态
 的价电子排布式为
的价电子排布式为②下列有关上述络合反应的说法中,正确的有
A.反应达平衡时,溶液的颜色不再变化
B.增大
 浓度,逆反应速率减小
浓度,逆反应速率减小C.
 过低不利于
过低不利于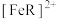 的生成
的生成 D.升高温度,该平衡正向移动
(2)紫外光催化
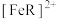 降解:
降解:若有机酸为
 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为: ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:(i)
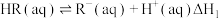
(ii)
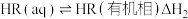
(iii)

(3)根据盖斯定律,反应
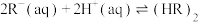 (有机相)的
(有机相)的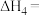
(4)水相的
 以及体系温度
以及体系温度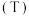 对
对 的平衡分配比
的平衡分配比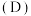 有影响。
有影响。已知:
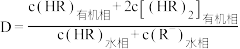 。
。①常温下,配制体积相同、
 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到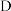 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析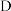 随
随 升高而降低的原因
升高而降低的原因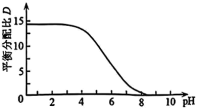
 溶液
溶液 时,
时,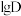 随
随 的变化曲线如图所示。
的变化曲线如图所示。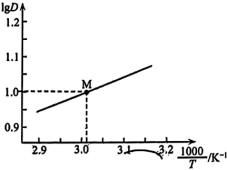
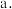 萃取宜在
萃取宜在 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数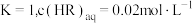 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中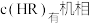
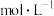 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数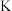
您最近半年使用:0次
7 . 某小组探秘人体血液中的运载氧平衡及酸碱平衡,回答下列问题:
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:
ⅰ.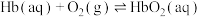
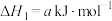
ⅱ.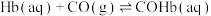
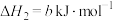
ⅱ.

ⅳ.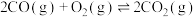

(1)
________ (用含a、b或c的代数式表示)。
(2) 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。
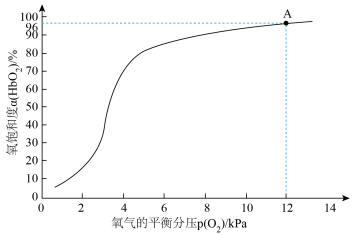
(3)36.5℃时,氧饱和度[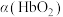 ,
,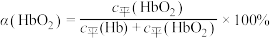 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
____________________ (写出计算过程;氧气的平衡浓度可用氧气的平衡分压代替)。
正常人体血液中主要含有 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
(4)37℃时 的水解常数
的水解常数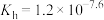 ,
,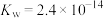 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式___________ ;请判断该同学血液的pH是否正常________ 。(填“是”或“否”)
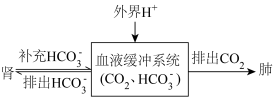
(5)人体酸碱平衡维持机制简要表达如下图: 会
会__________ (选填“增加”或“减少”)。
②对于重度代谢性酸中毒的病人应该采用什么治疗方法__________ 。(选填字母)
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5% 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
Ⅰ.人体运载氧平衡及CO中毒、解毒机制。
人体中的血红蛋白(Hb)能被CO结合而失去结合
 能力,吸入高压氧可以使血红蛋白恢复结合
能力,吸入高压氧可以使血红蛋白恢复结合 能力,原理如下:
能力,原理如下:ⅰ.
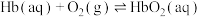
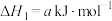
ⅱ.
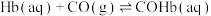
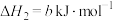
ⅱ.


ⅳ.
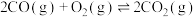

(1)

(2)
 也影响Hb结合
也影响Hb结合 的能力,反应如下:
的能力,反应如下:
 ,下列关于该反应的说法正确的是 。
,下列关于该反应的说法正确的是 。A.当 不变时,反应达到平衡 不变时,反应达到平衡 | B.若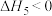 ,则该反应任意温度下能自发 ,则该反应任意温度下能自发 |
C.高氧条件下,血液中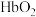 浓度增加 浓度增加 | D.人体代谢酸增加,该反应K值变大 |
(3)36.5℃时,氧饱和度[
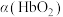 ,
,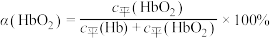 ]与氧气的平衡分压[
]与氧气的平衡分压[ ]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
]关系如下图所示,计算36.5℃时A点反应ⅰ的平衡常数
正常人体血液中主要含有
 和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:
和形成的缓冲溶液,能缓解外界的酸碱影响而保持pH基本不变。正常人体和代谢性酸中毒病人的血气分析结果见表:项目名称 | 结果浓度 | 参考范围 | |
正常人 | 代谢性酸中毒病人 | ||
| 40 | 50 | 35~45 |
| 24.2 | 19 | 23.3~24.8 |
血液酸碱度(pH) | 7.40 | 7.21 | 7.35~7.45 |
(4)37℃时
 的水解常数
的水解常数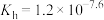 ,
,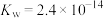 ,已知某同学血浆中
,已知某同学血浆中 ,写出人体血液中存在的水解平衡方程式
,写出人体血液中存在的水解平衡方程式(5)人体酸碱平衡维持机制简要表达如下图:
 会
会②对于重度代谢性酸中毒的病人应该采用什么治疗方法
A.口服0.9% KCl溶液 B.口服5%葡萄糖溶液
C.静脉注射5%
 溶液 D.静脉注射0.9% NaCl溶液
溶液 D.静脉注射0.9% NaCl溶液
您最近半年使用:0次
8 . 下列事实中,不能用化学平衡移动原理解释的是
A.棕色的 体系加压后,颜色先变深后逐渐变浅 体系加压后,颜色先变深后逐渐变浅 |
| B.在配制硫酸亚铁溶液时往往要加入少量铁粉 |
| C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
您最近半年使用:0次
名校
9 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
1. 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: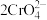 (黄色)
(黄色)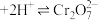 (橙色)
(橙色)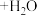 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显___________ 色。
2.室温下,初始浓度为1.0 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是___________ 。
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高
D.若达到A点的时间为5s,则0~5s内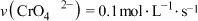
请根据图中A点数据,计算反应的平衡常数为___________ 。
某工厂采取还原沉淀法处理,该法的工艺流程为:
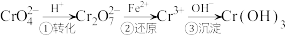
3. 的核外电子排布式是
的核外电子排布式是___________ 。
4.第②步反应的离子方程式为___________ 。
5.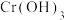 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: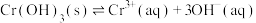 ,常温下,
,常温下,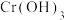 的溶度积
的溶度积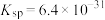 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至___________ 。(写出简单的计算过程)
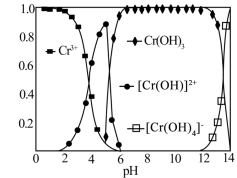
6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为___________ 。 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是___________ 。
 和
和 ,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。
,它们会对人类及生态系统产生很大的危害,需经化学方法处理后才能排放。1.
 和
和 在溶液中有如下的转化关系:
在溶液中有如下的转化关系: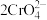 (黄色)
(黄色)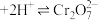 (橙色)
(橙色)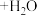 若平衡体系pH较低时,此时溶液显
若平衡体系pH较低时,此时溶液显2.室温下,初始浓度为1.0
 的
的 溶液中
溶液中 的平衡浓度随
的平衡浓度随 的变化如图所示,下列关于该反应的说法错误的是
的变化如图所示,下列关于该反应的说法错误的是
B.A点的平衡转化率为50%
C.若向A点溶液中加入少量
 固体,达到新平衡后,pH值升高,转化率升高
固体,达到新平衡后,pH值升高,转化率升高D.若达到A点的时间为5s,则0~5s内
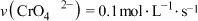
请根据图中A点数据,计算反应的平衡常数为
某工厂采取还原沉淀法处理,该法的工艺流程为:
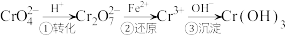
3.
 的核外电子排布式是
的核外电子排布式是4.第②步反应的离子方程式为
5.
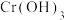 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: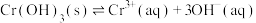 ,常温下,
,常温下,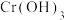 的溶度积
的溶度积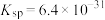 ,要使
,要使 降至
降至 时,溶液的pH应调至
时,溶液的pH应调至6.常温下,Cr(Ⅲ)(表示+3价的铬)在水溶液中的存在形态分布如图所示。当pH>12时,溶液中Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
 ,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
,试分析温度高于55℃时,Cr(Ⅵ)的去除率很低的原因是
您最近半年使用:0次
名校
解题方法
10 . 我国力争2030年前完成碳达峰,2060年前实现碳中和,含碳化合物的合成与转化具有重要意义。
(1) 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:
i.
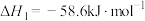
ii.
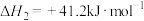
iii.CO和 也可合成甲醇,其热化学方程式为
也可合成甲醇,其热化学方程式为___________ 。
(2)若在绝热条件下,将 、
、 按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
(3)若在一定温度下,向2L恒容密闭容器中充入3mol 和5mol
和5mol 同时发生反应i和ii,达到平衡时
同时发生反应i和ii,达到平衡时 的总转化率为80%,体系压强减小了25%,则
的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为___________ ( 的选择性
的选择性 ),该温度下,反应i的化学平衡常数数值
),该温度下,反应i的化学平衡常数数值
___________ 。
(4)向容积可变的密闭容器中充入一定量的CO和 发生反应iii,在图中画出在压强
发生反应iii,在图中画出在压强 和
和 下(
下(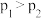 ),CO的平衡转化率随温度的变化图。
),CO的平衡转化率随温度的变化图。___________  转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中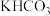 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则①阴极反应为电极
,则①阴极反应为电极___________ 。(填写a或b)(2)电极a上发生的电极反应式为___________ 。
(1)
 催化加氢可以合成甲醇,该过程主要发生下列反应:
催化加氢可以合成甲醇,该过程主要发生下列反应:i.

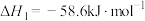
ii.

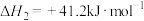
iii.CO和
 也可合成甲醇,其热化学方程式为
也可合成甲醇,其热化学方程式为(2)若在绝热条件下,将
 、
、 按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。
按体积比1∶2充入恒容密闭容器中只发生反应ii,下列能判断反应ii达到平衡状态的是___________。| A.容器内混合气体的密度不变 | B.容器内混合气体的压强不变 |
C.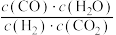 不变 不变 | D. |
(3)若在一定温度下,向2L恒容密闭容器中充入3mol
 和5mol
和5mol 同时发生反应i和ii,达到平衡时
同时发生反应i和ii,达到平衡时 的总转化率为80%,体系压强减小了25%,则
的总转化率为80%,体系压强减小了25%,则 的选择性为
的选择性为 的选择性
的选择性 ),该温度下,反应i的化学平衡常数数值
),该温度下,反应i的化学平衡常数数值
(4)向容积可变的密闭容器中充入一定量的CO和
 发生反应iii,在图中画出在压强
发生反应iii,在图中画出在压强 和
和 下(
下(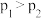 ),CO的平衡转化率随温度的变化图。
),CO的平衡转化率随温度的变化图。 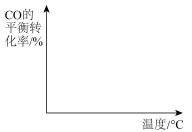
 转化为甲醇,原理如图所示。若右侧溶液中
转化为甲醇,原理如图所示。若右侧溶液中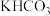 溶液浓度不变(忽略体积的变化)且溶液中不产生
溶液浓度不变(忽略体积的变化)且溶液中不产生 ,则①阴极反应为电极
,则①阴极反应为电极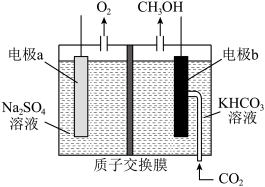
您最近半年使用:0次