1 . 含硫化合物在能源、材料及环境等工业领域均有广泛的应用。
Ⅰ.工业废气 分解可制取
分解可制取 。
。
(1)已知热化学方程式:
ⅰ.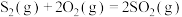

ⅱ.

ⅲ.

 热分解反应
热分解反应 的
的
___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)一定温度下,2mol 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为___________  ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
___________ 。
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:
ⅳ.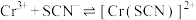
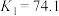
ⅴ.

(3)根据以上络合反应,下列说法正确的有___________(填字母)。
(4)常温下,某研究小组配制了起始浓度 、
、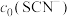 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、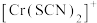 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随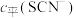 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。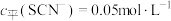 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为___________ ;A点时,溶液中 的平衡浓度为
的平衡浓度为___________ (列出计算式即可)。
②在某电镀工艺中, 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺________ (写出计算过程)。
Ⅰ.工业废气
 分解可制取
分解可制取 。
。(1)已知热化学方程式:
ⅰ.
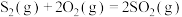

ⅱ.


ⅲ.


 热分解反应
热分解反应 的
的
 、
、 、
、 的式子表示)。
的式子表示)。(2)一定温度下,2mol
 在体积为VL的恒容密闭容器中发生上述分解反应,ts时
在体积为VL的恒容密闭容器中发生上述分解反应,ts时 的产率为40%,则0~ts内
的产率为40%,则0~ts内 的平均分解速率为
的平均分解速率为 ;
; 充分分解达到平衡时,容器中
充分分解达到平衡时,容器中 和
和 的分压相等,则该温度下的平衡常数
的分压相等,则该温度下的平衡常数
Ⅱ.KSCN可用于镀铬工业。常温下,用KSCN配制电镀液,溶液中
 与
与 发生第一、二步络合的反应如下:
发生第一、二步络合的反应如下:ⅳ.
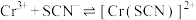
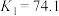
ⅴ.


(3)根据以上络合反应,下列说法正确的有___________(填字母)。
| A.加水稀释后,溶液中离子的总数减少 |
B.加入少量 固体,溶液中含铬微粒总数不变 固体,溶液中含铬微粒总数不变 |
C.反应 的平衡常数 的平衡常数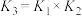 |
D.溶液中 减小, 减小, 与 与 浓度的比值减小 浓度的比值减小 |
(4)常温下,某研究小组配制了起始浓度
 、
、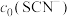 不同的系列溶液,测得平衡时
不同的系列溶液,测得平衡时 、
、 、
、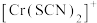 的浓度
的浓度 (含铬微粒)随
(含铬微粒)随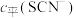 的变化曲线如图所示,平衡后其他含铬微粒
的变化曲线如图所示,平衡后其他含铬微粒 (3≤x≤6,图中未画出)总浓度为amol/L。
(3≤x≤6,图中未画出)总浓度为amol/L。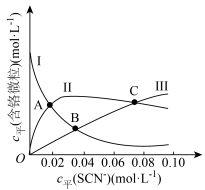
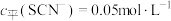 时,图中含铬微粒按浓度由大到小的顺序为
时,图中含铬微粒按浓度由大到小的顺序为 的平衡浓度为
的平衡浓度为②在某电镀工艺中,
 的浓度需要在
的浓度需要在 以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺
您最近一年使用:0次
2 . 实验室模拟某含有机酸 工业废水的处理过程。
工业废水的处理过程。
 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:
(1) 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:


①基态 的价电子排布式为
的价电子排布式为___________ 。
②下列有关上述络合反应的说法中,正确的有___________ (填标号)。
A.反应达平衡时,溶液的颜色不再变化
B.增大 浓度,逆反应速率减小
浓度,逆反应速率减小
C. 过低不利于
过低不利于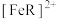 的生成
的生成
D.升高温度,该平衡正向移动
(2)紫外光催化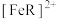 降解:
降解:
若有机酸为 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为:___________ 。
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:
(i)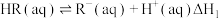
(ii)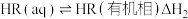
(iii)
(3)根据盖斯定律,反应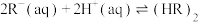 (有机相)的
(有机相)的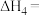
___________ 。
(4)水相的 以及体系温度
以及体系温度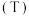 对
对 的平衡分配比
的平衡分配比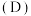 有影响。
有影响。
已知: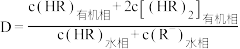 。
。
①常温下,配制体积相同、 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因___________ 。 溶液
溶液 时,
时,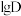 随
随 的变化曲线如图所示。
的变化曲线如图所示。 萃取宜在
萃取宜在___________ 温度下进行(填“较高”或“较低”)。
 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数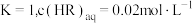 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中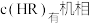
___________ 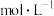 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
___________ (写出计算过程)。
 工业废水的处理过程。
工业废水的处理过程。 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:(1)
 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:

①基态
 的价电子排布式为
的价电子排布式为②下列有关上述络合反应的说法中,正确的有
A.反应达平衡时,溶液的颜色不再变化
B.增大
 浓度,逆反应速率减小
浓度,逆反应速率减小C.
 过低不利于
过低不利于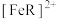 的生成
的生成 D.升高温度,该平衡正向移动
(2)紫外光催化
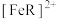 降解:
降解:若有机酸为
 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为: ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:(i)
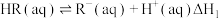
(ii)
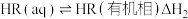
(iii)

(3)根据盖斯定律,反应
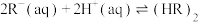 (有机相)的
(有机相)的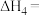
(4)水相的
 以及体系温度
以及体系温度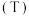 对
对 的平衡分配比
的平衡分配比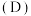 有影响。
有影响。已知:
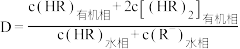 。
。①常温下,配制体积相同、
 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因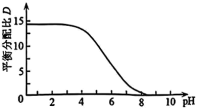
 溶液
溶液 时,
时,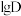 随
随 的变化曲线如图所示。
的变化曲线如图所示。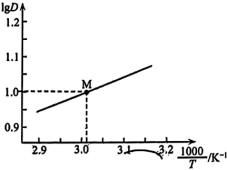
 萃取宜在
萃取宜在 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数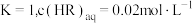 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中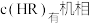
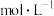 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
您最近一年使用:0次
3 . 乙烯、丙烯是石油产业的核心,工业上可利用甲醇制备乙烯、丙烯,所涉及的反应如下:
主反应: ;
;

副反应: 。
。
回答下列问题:
(1)已知相关化学键的键能数据如下:

_______  。
。
(2)下列关于反应 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。
(3)T℃时,在压强恒定的相同容器中填装催化剂,以恒定的流速通入 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。_______ 。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是_______ 。
(4)只研究温度对反应的影响,向压强恒定为 的密闭容器中通入
的密闭容器中通入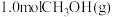 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为_______ 。
② 时,
时, 的平衡转化率为
的平衡转化率为_______ 。
③ 时,反应
时,反应 的平衡常数
的平衡常数
_______  (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)若反应ⅲ的速率方程为 ,其中
,其中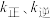 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数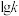 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数
_______ 。
主反应:
 ;
;
副反应:
 。
。回答下列问题:
(1)已知相关化学键的键能数据如下:
| 化学键 | C-H | C-O | C=O | O-H |
键能 | 413 | 351 | 615 | 463 |

 。
。(2)下列关于反应
 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。| A.主反应均为熵增反应 |
| B.乙烯和丙烯的体积分数相等,说明体系达到了平衡状态 |
| C.及时将水蒸气液化并分离,有利于提高甲醇的平衡转化率 |
| D.其他条件相同,反应i分别在恒容和恒压条件下进行,前者甲醇的平衡转化率更高 |
 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是
(4)只研究温度对反应的影响,向压强恒定为
 的密闭容器中通入
的密闭容器中通入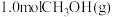 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。
 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为②
 时,
时, 的平衡转化率为
的平衡转化率为③
 时,反应
时,反应 的平衡常数
的平衡常数
 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。(5)若反应ⅲ的速率方程为
 ,其中
,其中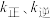 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数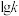 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数

您最近一年使用:0次
名校
解题方法
4 . 乙酰苯胺是一种无色有闪光的小叶状固体或白色晶性粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂。乙酰苯胺的一种制备原理为:
实验步骤:
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。
【步骤3】稍冷后,加入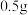 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。
【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称_____ 。
(2)【步骤1】加热可用_____ (填“水浴”或“油浴”)。
(3)制备过程中加入锌粉的作用为_____ 。
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在 左右的原因:
左右的原因:_____ 。
(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是_____ 。
(6)该实验最终得到纯品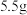 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为_____ (保留一位小数)。
(7)乙酰苯胺可以在 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:_____ 。
(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到_____ 现象时,反应基本结束。
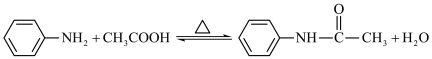
| 名称 | 相对分子质量 | 性状 | 密度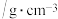 | 沸点/℃ | 溶解度 | 备注 |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚 | 易被氧化 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水,易溶于乙醇、乙醚 | |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
【步骤1】如图所示,在圆底烧瓶中加入无水苯胺
 、冰醋酸
、冰醋酸 、锌粉
、锌粉 ,安装仪器,加入沸石,调节加热温度,使温度计温度控制在
,安装仪器,加入沸石,调节加热温度,使温度计温度控制在 左右,反应约
左右,反应约 ,当反应基本完成时,停止加热。
,当反应基本完成时,停止加热。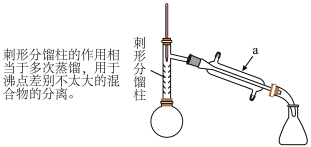
 水,搅拌加热至沸腾,使粗品完全溶解。
水,搅拌加热至沸腾,使粗品完全溶解。【步骤3】稍冷后,加入
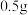 活性炭,并煮沸
活性炭,并煮沸 ,趁热抽滤除去活性炭。
,趁热抽滤除去活性炭。【步骤4】将滤液倒入烧杯中,自然冷却,析出晶体。抽滤、洗涤、干燥得产品,称其质量。
回答下列问题:
(1)仪器a的名称
(2)【步骤1】加热可用
(3)制备过程中加入锌粉的作用为
(4)从化学平衡的角度分析,使用刺形分馏柱并控制分馏柱上端的温度在
 左右的原因:
左右的原因:(5)乙酰苯胺粗品因含杂质而显色,【步骤3】中加入活性炭吸附有色杂质,加入活性炭需要待沸腾的溶液稍冷却后再加入,其目的是
(6)该实验最终得到纯品
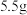 ,则乙酰苯胺的产率为
,则乙酰苯胺的产率为(7)乙酰苯胺可以在
 热溶液中发生水解,写出其反应方程式:
热溶液中发生水解,写出其反应方程式:(8)当制备少量乙酰苯胺时,常用图所示的微型仪器组装成实验装置制备。当观察到

您最近一年使用:0次
名校
5 . 向碘水、淀粉的混合液中加入 溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
 溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
溶液,蓝色褪去。为探究褪色原因,设计如下图所示的实验。
A.①中 氧化了 氧化了 | B.①后溶液pH可能明显变小 |
C.③的目的是除去过量的 溶液 溶液 | D.④可发生 |
您最近一年使用:0次
6 . 乙酸俗称醋酸,是一种重要的化工原料。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:_____ 。
②已知B为六配位离子,画出B的结构示意图_____ 。
③根据反应④,写出E生成CH3COOH的化学方程式_____ 。
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g) C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
Ⅱ.CH3COOH(g)+C2H5OH(g) CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
Ⅲ.CH3COOH(g)+H2(g) CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知: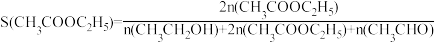
①CH3CHO(g)+H2(g) C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=_____ kJ·mol-1。
②图中表示乙酸的转化率随温度变化的曲线是_____ 。当温度低于340℃时,随着温度的升高,CH3COOC2H5选择性变大的原因是_____ 。_____ (任写一条)。
④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=_____ (保留2位小数)。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:

②已知B为六配位离子,画出B的结构示意图
③根据反应④,写出E生成CH3COOH的化学方程式
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g)
 C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1Ⅱ.CH3COOH(g)+C2H5OH(g)
 CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1Ⅲ.CH3COOH(g)+H2(g)
 CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知:
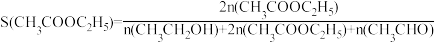
①CH3CHO(g)+H2(g)
 C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=②图中表示乙酸的转化率随温度变化的曲线是

④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=
您最近一年使用:0次
解题方法
7 . 25℃时,将含有I-的溶液逐滴加入到含有Hg2+的溶液中,发生一系列可逆反应生成HgI+、HgI2(s)、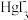 、
、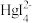 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、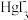 、
、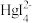 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
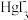 、
、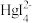 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、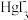 、
、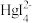 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是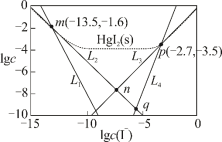
| A.Ksp(HgI2)的数量级为10-28 |
| B.n点的坐标为(-7.15,-7.95) |
C.反应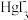 (aq) (aq) HgI2(s)+I-(aq)的平衡常数为K=10-0.8 HgI2(s)+I-(aq)的平衡常数为K=10-0.8 |
D.q点溶液中存在:c(H+)+2c(Hg2+)=c(OH-)+c(I-)+c(HgI )+c(HgI )+c(HgI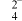 ) ) |
您最近一年使用:0次
解题方法
8 . 已知反应: .按起始投料比
.按起始投料比 加入反应物,测得
加入反应物,测得 的平衡转化率和催化剂催化效率受温度的影响如下图所示.下列说法不正确的是
的平衡转化率和催化剂催化效率受温度的影响如下图所示.下列说法不正确的是
 .按起始投料比
.按起始投料比 加入反应物,测得
加入反应物,测得 的平衡转化率和催化剂催化效率受温度的影响如下图所示.下列说法不正确的是
的平衡转化率和催化剂催化效率受温度的影响如下图所示.下列说法不正确的是
A. 时,b点反应向逆反应方向进行 时,b点反应向逆反应方向进行 |
| B.生成乙烯的速率c点一定大于a点 |
C. ,催化效率降低是由于温度升高引起的 ,催化效率降低是由于温度升高引起的 |
D.a点乙烯的体积分数约为 |
您最近一年使用:0次
解题方法
9 . 六水合硫酸镁铵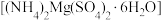 是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
实验室制备步骤如下:
Ⅰ.称取 于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
Ⅱ.称取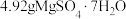 于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
Ⅲ.将步骤Ⅰ所得的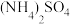 溶液倒入步骤Ⅱ的
溶液倒入步骤Ⅱ的 溶液中,搅拌混合充分,冰水浴20min,析出晶体。
溶液中,搅拌混合充分,冰水浴20min,析出晶体。
Ⅳ.减压过滤。用无水乙醇洗涤产品1~2次,抽干后,将晶体转移到蒸发皿里,置于40℃水浴锅中约30min,即可得 晶体。
晶体。
Ⅴ.所得晶体称重为mg。
回答下列问题:
(1)称取固体应采用___________ (填“托盘天平”或“电子天平”)。
(2)步骤Ⅰ所得溶液pH___________ 7(填“>”“<”或“=”),原因是___________ 。
(3)步骤Ⅲ的化学方程式是___________ ,下列关于该反应的说法正确的是___________ (填标号)。
A.发生氧化还原反应
B.物质之间溶解度差异导致反应发生
C.冰水浴有助于晶体充分析出
(4)步骤Ⅱ与步骤Ⅳ中都有“置于40℃水浴锅中”,其目的分别是___________ 。
(5)步骤Ⅳ中用无水乙醇洗涤产品的优点是___________ 。
(6)减压过滤也叫抽滤,可加快过滤速度。如图为减压过滤装置,实验过程中操作顺序是___________ ⑤⑥(填序号)。
①打开抽气泵开关,倒入固液混合物 ②修剪滤纸,使其略小于布氏漏斗,让滤纸与漏斗紧密贴合 ③安装仪器,检查是否漏气 ④开始抽滤 ⑤断开吸滤瓶接管 ⑥关抽气泵。___________ (用含m的代数式表示)。
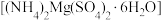 是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。
是一种常见复盐,白色晶体,微溶于冷水,难溶于乙醇。实验室制备步骤如下:
Ⅰ.称取
 于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。
于100mL烧杯中,加入10mL蒸馏水,搅拌溶解。Ⅱ.称取
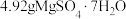 于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。
于100mL烧杯中,加入10mL蒸馏水,置于40℃水浴锅中。Ⅲ.将步骤Ⅰ所得的
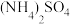 溶液倒入步骤Ⅱ的
溶液倒入步骤Ⅱ的 溶液中,搅拌混合充分,冰水浴20min,析出晶体。
溶液中,搅拌混合充分,冰水浴20min,析出晶体。Ⅳ.减压过滤。用无水乙醇洗涤产品1~2次,抽干后,将晶体转移到蒸发皿里,置于40℃水浴锅中约30min,即可得
 晶体。
晶体。Ⅴ.所得晶体称重为mg。
回答下列问题:
(1)称取固体应采用
(2)步骤Ⅰ所得溶液pH
(3)步骤Ⅲ的化学方程式是
A.发生氧化还原反应
B.物质之间溶解度差异导致反应发生
C.冰水浴有助于晶体充分析出
(4)步骤Ⅱ与步骤Ⅳ中都有“置于40℃水浴锅中”,其目的分别是
(5)步骤Ⅳ中用无水乙醇洗涤产品的优点是
(6)减压过滤也叫抽滤,可加快过滤速度。如图为减压过滤装置,实验过程中操作顺序是
①打开抽气泵开关,倒入固液混合物 ②修剪滤纸,使其略小于布氏漏斗,让滤纸与漏斗紧密贴合 ③安装仪器,检查是否漏气 ④开始抽滤 ⑤断开吸滤瓶接管 ⑥关抽气泵。

您最近一年使用:0次
解题方法
10 . 过氧化钙晶体(CaO2⋅8H2O,微溶于水,不溶于乙醇、乙醚)是重要的化学品,常用作杀菌剂、防腐剂、化妆品的添加剂等。实验室以石灰石(含有少量铁、硅的氧化物)为原料制备CaO2的实验流程如下:
(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、 溶液沉钙等步骤。
溶液沉钙等步骤。
①“调pH除铁”后,需用如图所示的热抽滤装置除去 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是___________ 。 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为___________ 。
(2)“制备”过程所用装置如下图所示:___________ ,若用乙装置制备NH3,,写出反应的化学方程式:___________ 。
②仪器X的名称为___________ 。
③“制备” 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是___________ 。生成 的离子方程式为
的离子方程式为___________ ;CaCl2与H2O2直接反应不易发生,制备时加入适量氨水有利于CaO2生成,其原因可能是___________ 。
(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。

(1)由石灰石制备纯CaCO3的过程需经过盐酸溶解、H2O2溶液氧化、调pH除铁、
 溶液沉钙等步骤。
溶液沉钙等步骤。①“调pH除铁”后,需用如图所示的热抽滤装置除去
 ,相比普通过滤装置,热抽滤装置的优点是
,相比普通过滤装置,热抽滤装置的优点是
 溶液沉钙”反应的离子方程式为
溶液沉钙”反应的离子方程式为(2)“制备”过程所用装置如下图所示:

②仪器X的名称为
③“制备”
 需在冰水浴中进行,温度需控制在0℃,可采取的方法是
需在冰水浴中进行,温度需控制在0℃,可采取的方法是 的离子方程式为
的离子方程式为(3)产品中CaO2含量测定。高锰酸钾滴定法原理为在酸性条件下,CaO2与稀酸反应生成H2O2,用标准酸性KMnO4溶液滴定所生成的H2O2,以确定CaO2含量。下列关于滴定分析的说法,错误的是___________(填字母)。
| A.滴定时应一直观察滴定管中溶液体积的变化 |
| B.当滴入半滴酸性KMnO4溶液后,溶液颜色从无色刚好变为浅红色,且半分钟内不变色,表示已经到达滴定终点 |
| C.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测定结果偏小 |
| D.读取KMnO4溶液体积时,滴定前俯视读数,滴定后仰视读数,则测定结果偏大 |
您最近一年使用:0次



