解题方法
1 . NiS难溶于水,易溶于稀酸,可利用沉淀转化的原理除去镍电解液中的铜离子,NiS在潮湿的空气中可转化为磁式硫化高镍 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:______ 。
(2)装置图中,仪器a的名称为______ ,装置Ⅱ中的试剂为______ 。
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭 、
、 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在______ (填“b”或“c”)处。______ (用化学方程式结合文字作答)。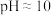 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
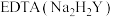 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为______ %。
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度______ (填“偏低”、“偏高”或“不影响”)。
 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
(2)装置图中,仪器a的名称为
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭
 、
、 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在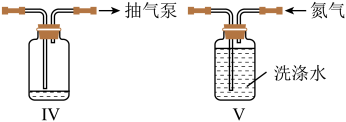

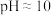 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
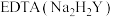 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。①样品的纯度为
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度
您最近一年使用:0次
2 . 下列事实不能用平衡移动原理解释的是
A.由 、 、 、 、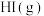 组成的平衡体系通过缩小体积加压后颜色变深 组成的平衡体系通过缩小体积加压后颜色变深 |
B.重铬酸钾溶液中存在: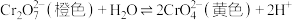 ,若滴加少量 ,若滴加少量 溶液,溶液由橙色变黄色 溶液,溶液由橙色变黄色 |
C.实验室用排饱和食盐水的方法收集 |
| D.开启啤酒瓶后,马上泛起大量泡沫 |
您最近一年使用:0次
2023-06-27更新
|
452次组卷
|
4卷引用:云南省部分名校2022-2023学年高二下学期6月联考化学试题
云南省部分名校2022-2023学年高二下学期6月联考化学试题云南省三校2024届高三上学期备考实用性联考(一)化学试题(已下线)化学平衡状态 平衡移动(已下线)化学(北京卷02)-2024年高考押题预测卷
名校
解题方法
3 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | T℃压缩装有 混合气体(已达平衡)的容器,气体颜色加深 混合气体(已达平衡)的容器,气体颜色加深 | 平衡向生成 的方向移动 的方向移动 |
| B | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| C | 向某溶液中滴加稀硫酸,将产生的气体通入品红溶液,品红褪色 | 该溶液中含有 |
| D | T℃用pH试纸测得 的 的 溶液pH约为9, 溶液pH约为9, 的 的 溶液pH约为8 溶液pH约为8 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气( 和
和 的混合气体)
的混合气体)
是碳化学的重要原料,焦炭与水蒸气在刚性密闭容器中会发生如下两个反应:
i.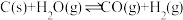
ii.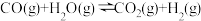
下表是几种物质的标准生成热(由对应稳定单质生成 某种物质的焓变叫做该物质的标准生成热)。
某种物质的焓变叫做该物质的标准生成热)。
(1)反应i的焓变
___________ 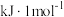 ,
,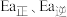 分别表示该反应正、逆反应的活化能,则
分别表示该反应正、逆反应的活化能,则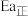
___________ 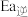 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
(2)若在绝热恒容容器中仅发生反应ii,则下列事实能说明反应达到平衡状态的是___________。
(3)已知反应ii的正反应速率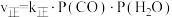 ,逆反应速率
,逆反应速率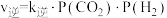 ,
, 分别为正、逆反应速率常数,
分别为正、逆反应速率常数,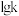 (k表示
(k表示 或
或 )与温度
)与温度 的关系如图所示,其中直线a、b分别表示
的关系如图所示,其中直线a、b分别表示 随温度的变化。升高温度,反应ii的平衡常数K
随温度的变化。升高温度,反应ii的平衡常数K___________ (填“变大”或“变小”或“不变”)。
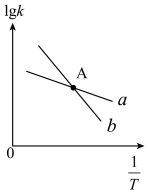
(4)在上图A点对应的温度下,向某刚性密闭容器中加入足量焦炭和一定量水蒸气,同时发生反应i和反应ii,已知起始时容器内压强为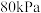 ,10分钟后体系达到平衡状态,容器内压强变为
,10分钟后体系达到平衡状态,容器内压强变为 。平衡时
。平衡时 的分压
的分压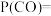
___________  ,平衡时水蒸气的转化率为
,平衡时水蒸气的转化率为___________  。
。
Ⅱ.和 制备
制备 ,可实现的资源化利用,涉及的反应如下:
,可实现的资源化利用,涉及的反应如下:
主反应: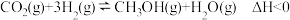
副反应: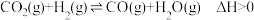
将反应物混合气体按进料比 通入反应装置中,选择合适的催化剂,发生上述反应。
通入反应装置中,选择合适的催化剂,发生上述反应。
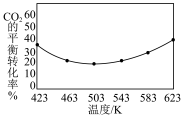
(5)不同温度下, 的平衡转化率如图所示,温度高于
的平衡转化率如图所示,温度高于 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是___________ 。
 和
和 的混合气体)
的混合气体)是碳化学的重要原料,焦炭与水蒸气在刚性密闭容器中会发生如下两个反应:
i.
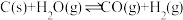
ii.
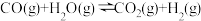
下表是几种物质的标准生成热(由对应稳定单质生成
 某种物质的焓变叫做该物质的标准生成热)。
某种物质的焓变叫做该物质的标准生成热)。| 物质 | 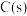 |  |  |  |
标准生成热/ | 0.0 |  | 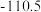 | 0.0 |

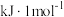 ,
,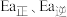 分别表示该反应正、逆反应的活化能,则
分别表示该反应正、逆反应的活化能,则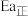
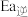 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。(2)若在绝热恒容容器中仅发生反应ii,则下列事实能说明反应达到平衡状态的是___________。
| A.容器内气体的压强不变 | B.容器内温度不变 |
| C.容器内气体的密度不再改变 | D.容器内气体的平均相对分子质量不变 |
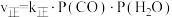 ,逆反应速率
,逆反应速率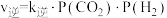 ,
, 分别为正、逆反应速率常数,
分别为正、逆反应速率常数,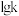 (k表示
(k表示 或
或 )与温度
)与温度 的关系如图所示,其中直线a、b分别表示
的关系如图所示,其中直线a、b分别表示 随温度的变化。升高温度,反应ii的平衡常数K
随温度的变化。升高温度,反应ii的平衡常数K
(4)在上图A点对应的温度下,向某刚性密闭容器中加入足量焦炭和一定量水蒸气,同时发生反应i和反应ii,已知起始时容器内压强为
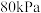 ,10分钟后体系达到平衡状态,容器内压强变为
,10分钟后体系达到平衡状态,容器内压强变为 。平衡时
。平衡时 的分压
的分压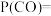
 ,平衡时水蒸气的转化率为
,平衡时水蒸气的转化率为 。
。Ⅱ.和
 制备
制备 ,可实现的资源化利用,涉及的反应如下:
,可实现的资源化利用,涉及的反应如下:主反应:
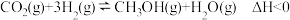
副反应:
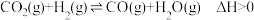
将反应物混合气体按进料比
 通入反应装置中,选择合适的催化剂,发生上述反应。
通入反应装置中,选择合适的催化剂,发生上述反应。(5)不同温度下,
 的平衡转化率如图所示,温度高于
的平衡转化率如图所示,温度高于 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是
您最近一年使用:0次
名校
5 . 下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集氯气 |
B.工业上合成氮反应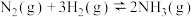  选择500℃ 选择500℃ |
C. 、 、 、HI平衡混合气体加压后颜色加深 、HI平衡混合气体加压后颜色加深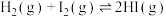 |
D. 氧化成 氧化成 ,往往需要使用催化剂 ,往往需要使用催化剂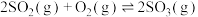 |
您最近一年使用:0次
名校
6 . 关于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的临界温度会降低 |
| C.恒容条件下,通入He和Ar组成的混合气体,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的CO2气体来提高 转化率并增大生成物 转化率并增大生成物 的浓度 的浓度 |
您最近一年使用:0次
2023-05-05更新
|
359次组卷
|
7卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题
云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试(理科)化学试题陕西省西安市长安区第一中学2022-2023学年高一下学期第二次质量检测化学试题新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题湖北省黄冈市黄梅国际育才高级中学2023-2024学年高二上学期12月月考化学试题
7 . 从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用作酸、碱指示剂:HIn(溶液,红色) H+(溶液)+In-(溶液,黄色),在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是
H+(溶液)+In-(溶液,黄色),在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是
 H+(溶液)+In-(溶液,黄色),在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是
H+(溶液)+In-(溶液,黄色),在上述溶液中加入适量下列物质,最终能使指示剂显黄色的是| A.盐酸 | B.NaHCO3溶液 | C.NaHSO4溶液 | D.NaClO(固体) |
您最近一年使用:0次
2022-12-13更新
|
162次组卷
|
4卷引用:云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
名校
8 . 在恒温恒容条件下,可逆反应2A(?)⇌2B(g)+C(?),若随着温度升高(物质状态不发生改变),气体密度变大,则下列判断正确的是
| A.A和C可以一个是固体、一个是液体 |
| B.A和C可以都是气体 |
| C.若A为气体,则正反应一定是吸热反应 |
| D.其他条件不变,平衡后压缩容器体积,B的浓度一定比原平衡大 |
您最近一年使用:0次
2022-10-18更新
|
95次组卷
|
2卷引用:云南省马关县第一中学校2022-2023学年高二下学期期末考试化学试题
名校
9 . 下列反应达到平衡后,升高温度可以使混合气体平均相对分子质量增大的是
A.H2(g)+I2(g)  2HI(g) ΔH<0 2HI(g) ΔH<0 |
B.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
C.N2(g)+3H2(g)  2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
D.2SO3(g)  2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
您最近一年使用:0次
10 . 随着可燃冰开采领域的不断扩大,我国已处于世界绝对领先地位。将甲烷((CH4)催化转化为有价值的化学工业品一直是我国化学工作 者的研究热点。最近徐君团队研发出了一种Au在ZSM-5分子筛上催化氧化甲烷生产CH3OH和CH3COOH的技术,该技术涉及的反应如下:
反应Ⅰ 2CH4(g)+O2(g) 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;
反应Ⅱ 2CH4(g)+2O2(g) CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
请回答下列问题:
(1)部分化学键的键能数据如下表所示:
则C-O的键能为_______ kJ·mol-1。
(2)反应II在热力学上进行的趋势很大,原因为_______ 。除降低温度外,能同时提高CH3OH和CH3COOH的平衡产率的措施为_______ (任答一条)。
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为_______ mol·L-1 (用含a、b、v的代数式表示,要求化简,下同),该温度下反应II的平衡常数为_______ 。
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):
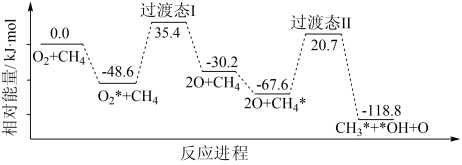
该反应进程中,O2的解离是_______ (填“吸热”或“放热”)的反应,该过程的反应速率_______ (填“大于”或“小于”)CH4的活化反应的反应速率。
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:
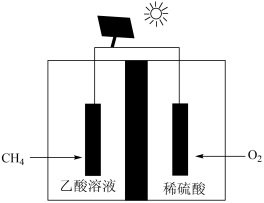
通入CH4的电极反应式为_______ 该装置工作时发生的能量转化形式为_______ (不考虑热能的转化)。
反应Ⅰ 2CH4(g)+O2(g)
 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;反应Ⅱ 2CH4(g)+2O2(g)
 CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。请回答下列问题:
(1)部分化学键的键能数据如下表所示:
| 化学键 | O=O | C-H | O-H |
| 键能E/kJ·mol-1 | 498 | 414 | 390.8 |
则C-O的键能为
(2)反应II在热力学上进行的趋势很大,原因为
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):

该反应进程中,O2的解离是
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:

通入CH4的电极反应式为
您最近一年使用:0次
2022-05-31更新
|
267次组卷
|
2卷引用:云南省澄江县第一中学2023届高三下学期3月月考化学试题



