解题方法
1 . 苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用如下反应来制备: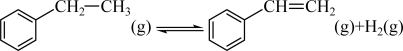 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
下列说法正确的是
 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。| 10min | 20min | 30min | 40min | 50min | |
| 甲 | 20.5% | 39.0% | 54.5% | 60.0% | 60.0% |
| 乙 | 23.5% | 44.5% | 61.0% | 66.8% | x |
| 丙 | 25.0% | 45.5% | 63.8% | 74.0% | 80.0% |
A.20min内,乙苯的平均反应速率 从大到小的顺序是丙>乙>甲 从大到小的顺序是丙>乙>甲 |
| B.若其他条件不变,把容器甲改为恒容容器,则平衡转化率变小 |
C.T1℃时,该反应的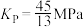 |
| D.50min时,容器丙中的反应已达到平衡状态 |
您最近半年使用:0次
解题方法
2 . Ⅰ.在密闭容器中充入2molN2和6molH2,容器体积为5L,在一定温度下催化反应N2(g)+3H2(g) 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
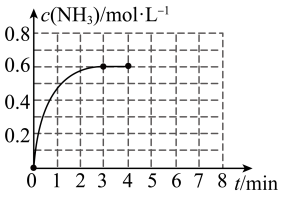
(1)①前3min内平均反应速率:v(H2)=______ ;
②平衡时,N2的转化率为_______ ;反应前后压强之比P前:P后=______ 。
③在此温度下,上述反应平衡常数K=______ 。
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(2)根据反应①与②可推导出K3=________ (用K1、K2表示);△H3_____ 0(用“>”或“<”表示);
(3)下列图像符合反应③的是_______。
 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
(1)①前3min内平均反应速率:v(H2)=
②平衡时,N2的转化率为
③在此温度下,上述反应平衡常数K=
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3 | K3 | |||
(2)根据反应①与②可推导出K3=
(3)下列图像符合反应③的是_______。
A.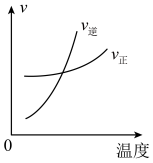 | B.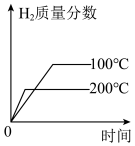 |
C.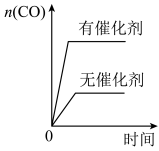 | D.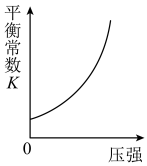 |
您最近半年使用:0次
解题方法
3 .  的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。
Ⅰ.利用 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:
反应①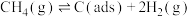

反应②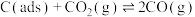

有关物质的相对能量与反应历程的变化如图所示[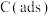 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应 能自发进行的条件为
能自发进行的条件为_______ 。
(2)总反应速率由反应_______ (填“①”或“②”)决定,增加 的浓度,
的浓度,_______ (填“能”或“不能”)显著提升总反应的速率。
Ⅱ.工业上可利用 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:
反应③

反应④
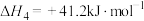
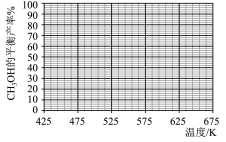
在5MPa的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。

(3)在425℃~675℃范围内(其他条件不变), 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:_______ ,_______ 。
(4)下列说法正确的是_______(填字母)。
(5)反应④在545K时的平衡常数
_______ 。
(6)结合上图,在下图中画出 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线_______ (标出B点坐标)。
 的资源化利用对碳循环经济技术的发展具有重要意义。
的资源化利用对碳循环经济技术的发展具有重要意义。Ⅰ.利用
 和
和 制备合成气(CO、
制备合成气(CO、 ),反应分两步进行:
),反应分两步进行:反应①
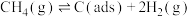

反应②
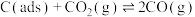

有关物质的相对能量与反应历程的变化如图所示[
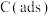 为吸附性活性炭]:
为吸附性活性炭]:
(1)总反应
 能自发进行的条件为
能自发进行的条件为(2)总反应速率由反应
 的浓度,
的浓度,Ⅱ.工业上可利用
 生产燃料甲醇。该过程发生下列反应:
生产燃料甲醇。该过程发生下列反应:反应③


反应④

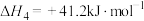
在5MPa的恒压反应器中,按照
 投料,测得体系中平衡时
投料,测得体系中平衡时 和CO的选择性及
和CO的选择性及 的平衡转化率随温度的变化如图所示(选择性:转化的
的平衡转化率随温度的变化如图所示(选择性:转化的 中生成
中生成 或CO的百分比)。
或CO的百分比)。
(3)在425℃~675℃范围内(其他条件不变),
 的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:
的平衡转化率随温度升高发生变化,写出该变化规律并分析原因:(4)下列说法正确的是_______(填字母)。
| A.曲线Ⅱ代表CO的选择性随温度的变化 |
B.温度越低,越有利于工业生产 |
C.上述反应条件下, 的平衡转化率等于 的平衡转化率等于 的平衡转化率 的平衡转化率 |
D.原料气中掺入适量CO能提高 的产率 的产率 |
(5)反应④在545K时的平衡常数

(6)结合上图,在下图中画出
 的平衡产率随温度的变化曲线
的平衡产率随温度的变化曲线
您最近半年使用:0次
4 .  的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。
Ⅰ.热化学法处理 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是___________ 。
(2)该反应的正逆反应速率可分别表示为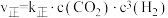 ,
,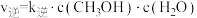 ,其中
,其中 、
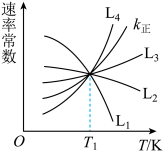
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“ ”或“
”或“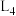 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在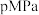 下,将
下,将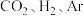 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
___________  。
。
(4)实际合成反应时,也会有 等生成。在恒压条件下
等生成。在恒压条件下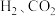 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:

①合成 最适宜的温度为
最适宜的温度为___________
②在 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是___________ 。
Ⅱ.回收利用工业废气中的 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
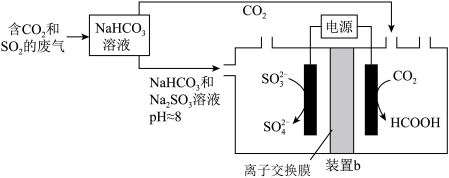
(5)反应后装置b中溶液
___________ (填“增大”、“减小”或“不变”),装置b中的总反应的离子方程式为___________ 。
 的资源化利用是实现碳中和的重要途径。
的资源化利用是实现碳中和的重要途径。Ⅰ.热化学法处理
 。
。 加氢制
加氢制 的反应为:
的反应为:
(1)该反应能自发进行的主要原因是
(2)该反应的正逆反应速率可分别表示为
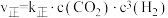 ,
,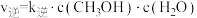 ,其中
,其中 、
、 为速率常数。如图所示能够代表
为速率常数。如图所示能够代表 的曲线为
的曲线为 ”“
”“ ”“
”“ ”或“
”或“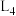 ”);若该反应的化学平衡常数
”);若该反应的化学平衡常数 ,那么发生该反应的温度
,那么发生该反应的温度 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)在
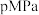 下,将
下,将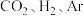 按物质的量之比为
按物质的量之比为 充入密闭容器,
充入密闭容器, 的平衡转化率为
的平衡转化率为 ,此时平衡常数
,此时平衡常数
 。
。(4)实际合成反应时,也会有
 等生成。在恒压条件下
等生成。在恒压条件下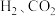 的体积比为
的体积比为 反应时,在催化剂作用下反应相同时间所测得的
反应时,在催化剂作用下反应相同时间所测得的 选择性和产率随温度的变化如图所示:
选择性和产率随温度的变化如图所示:
①合成
 最适宜的温度为
最适宜的温度为②在
 范围内随着温度的升高,
范围内随着温度的升高, 的产率迅速升高的原因是
的产率迅速升高的原因是Ⅱ.回收利用工业废气中的
 和
和 ,实验原理示意图如下。
,实验原理示意图如下。
(5)反应后装置b中溶液

您最近半年使用:0次
名校
解题方法
5 . 完成下列问题
(1)已知 和
和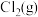 反应过程中能量变化如图所示:
反应过程中能量变化如图所示:
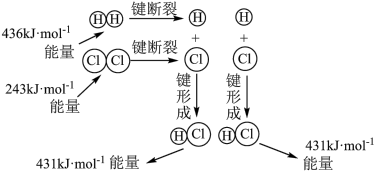
写出此反应的热化学方程式_____ 。
(2)已知 时,
时, 的电离平衡常数为:
的电离平衡常数为: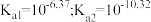 ,用离子方程式解释
,用离子方程式解释 溶液呈碱性的原因
溶液呈碱性的原因_____ ,计算 时
时 溶液中
溶液中 的水解平衡常数
的水解平衡常数
_____ 。
(3)氢气用于工业合成氨 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
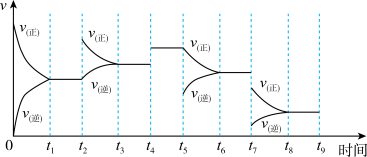
下列说法正确的是_____。
(1)已知
 和
和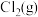 反应过程中能量变化如图所示:
反应过程中能量变化如图所示:
写出此反应的热化学方程式
(2)已知
 时,
时, 的电离平衡常数为:
的电离平衡常数为: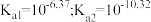 ,用离子方程式解释
,用离子方程式解释 溶液呈碱性的原因
溶液呈碱性的原因 时
时 溶液中
溶液中 的水解平衡常数
的水解平衡常数
(3)氢气用于工业合成氨
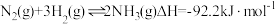 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
下列说法正确的是_____。
A. 时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率 时刻改变的条件是增加反应物浓度,增加活化分子百分数,加快了反应速率 |
B.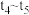 时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率 时刻改变的条件是加入催化剂,催化剂可降低活化能,加快了反应速率 |
C. 时刻改变条件可能为降压 时刻改变条件可能为降压 |
D. 时刻 时刻 的转化率最大 的转化率最大 |
您最近半年使用:0次
名校
解题方法
6 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)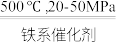 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 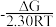 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
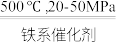 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
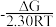 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
名校
7 . 某密闭容器中含有X和Y,同时发生以下两个反应:① ;②
;② 。反应①的正反应速率
。反应①的正反应速率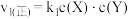 ,反应②的正反应速率
,反应②的正反应速率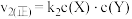 ,其中
,其中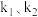 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度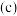 随时间
随时间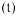 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
 ;②
;② 。反应①的正反应速率
。反应①的正反应速率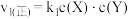 ,反应②的正反应速率
,反应②的正反应速率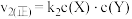 ,其中
,其中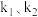 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度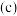 随时间
随时间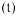 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
A. 时,正反应速率 时,正反应速率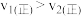 |
B.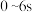 内,X的平均反应速率 内,X的平均反应速率 |
C.若升高温度, 时容器中 时容器中 的比值减小 的比值减小 |
| D.反应①的活化能大于反应② |
您最近半年使用:0次
2024-03-08更新
|
358次组卷
|
3卷引用:2024届河北省各市高三下学期一模联考化学试题
名校
解题方法
8 . 图像对应的叙述正确的是
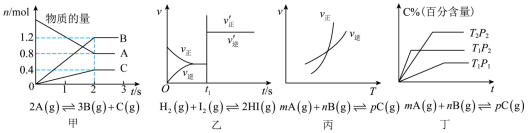

A.图甲:A的平衡转化率为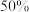 |
| B.图丙:对图中反应升高温度,该反应平衡常数减小 |
C.图乙: 时刻改变的条件只能是加入催化剂 时刻改变的条件只能是加入催化剂 |
| D.图丁:该正向反应在任何温度下都能自发进行 |
您最近半年使用:0次
解题方法
9 . 向一个固定体积的密闭容器充入2molA和1molB,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
(1)用A表示2分钟内平均反应速率为_______ 。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为_______ (填“吸热”或“放热”)反应。
(3)增大B的转化率,可采取的措施是_______ (用序号填空)
① 加入A ② 升高温度 ③ 加压 ④ 再加入1.6molA+0.8molB ⑤ 将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是_______ ;若升高温度时,请将反应速率变化情况画在c-d处_______ 。

 3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。(1)用A表示2分钟内平均反应速率为
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(3)增大B的转化率,可采取的措施是
① 加入A ② 升高温度 ③ 加压 ④ 再加入1.6molA+0.8molB ⑤ 将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是

您最近半年使用:0次
名校
10 .  下,分别向恒为
下,分别向恒为 的恒温密闭容器甲、恒为
的恒温密闭容器甲、恒为 的绝热密闭容器乙中加入
的绝热密闭容器乙中加入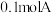 和
和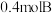 ,发生反应
,发生反应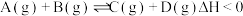 ,两容器中
,两容器中 的转化率随时间的变化如图所示。下列说法正确的是
的转化率随时间的变化如图所示。下列说法正确的是
 下,分别向恒为
下,分别向恒为 的恒温密闭容器甲、恒为
的恒温密闭容器甲、恒为 的绝热密闭容器乙中加入
的绝热密闭容器乙中加入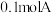 和
和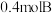 ,发生反应
,发生反应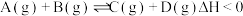 ,两容器中
,两容器中 的转化率随时间的变化如图所示。下列说法正确的是
的转化率随时间的变化如图所示。下列说法正确的是
A.若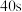 后加入催化剂,则曲线Ⅰ中 后加入催化剂,则曲线Ⅰ中 的平衡转化率会增大 的平衡转化率会增大 |
| B.曲线Ⅰ、Ⅱ对应反应的平衡常数:K(Ⅰ))>K(Ⅱ) |
C. 点的 点的 大于 大于 点的 点的 |
D.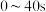 内,曲线Ⅱ中 内,曲线Ⅱ中 的平均反应速率 的平均反应速率 |
您最近半年使用:0次
2024-02-24更新
|
460次组卷
|
3卷引用:广东省2024届高三下学期2月份大联考 化学试题



