1 . 乙烯、丙烯是石油产业的核心,工业上可利用甲醇制备乙烯、丙烯,所涉及的反应如下:
主反应: ;
;
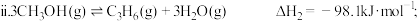
副反应: 。
。
回答下列问题:
(1)已知相关化学键的键能数据如下:

_______  。
。
(2)下列关于反应 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。
(3)T℃时,在压强恒定的相同容器中填装催化剂,以恒定的流速通入 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。_______ 。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是_______ 。
(4)只研究温度对反应的影响,向压强恒定为 的密闭容器中通入
的密闭容器中通入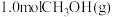 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为_______ 。
② 时,
时, 的平衡转化率为
的平衡转化率为_______ 。
③ 时,反应
时,反应 的平衡常数
的平衡常数
_______  (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)若反应ⅲ的速率方程为 ,其中
,其中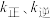 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数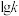 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数
_______ 。
主反应:
 ;
;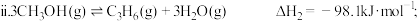
副反应:
 。
。回答下列问题:
(1)已知相关化学键的键能数据如下:
| 化学键 | C-H | C-O | C=C | O-H |
键能 | 413 | 351 | 615 | 463 |

 。
。(2)下列关于反应
 的说法正确的是_______(填字母)。
的说法正确的是_______(填字母)。| A.主反应均为熵增反应 |
| B.乙烯和丙烯的体积分数相等,说明体系达到了平衡状态 |
| C.及时将水蒸气液化并分离,有利于提高甲醇的平衡转化率 |
| D.其他条件相同,反应i分别在恒容和恒压条件下进行,前者甲醇的平衡转化率更高 |
(3)T℃时,在压强恒定的相同容器中填装催化剂,以恒定的流速通入
 ,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
,测得甲醇的转化率与乙烯和丙烯的选择性(选择性:转化的甲醇中生成乙烯和丙烯的百分比)与反应时间的关系如图所示。
②3h后乙烯和丙烯的选择性均明显下降,可能的原因是
(4)只研究温度对反应的影响,向压强恒定为
 的密闭容器中通入
的密闭容器中通入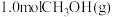 只发生反应
只发生反应 和
和 ,经过相同时间
,经过相同时间 ,乙烯和丙烯的物质的量随温度的变化如图所示。
,乙烯和丙烯的物质的量随温度的变化如图所示。
 前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为
前,乙烯和丙烯的物质的量随温度升高逐渐增大的原因为②
 时,
时, 的平衡转化率为
的平衡转化率为③
 时,反应
时,反应 的平衡常数
的平衡常数
 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压
(列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。(5)若反应ⅲ的速率方程为
 ,其中
,其中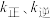 分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数
分别表示正、逆反应速率常数,只与温度有关。如图为反应ⅲ的速率常数的对数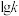 与温度的倒数
与温度的倒数 之间的关系,则
之间的关系,则 时,反应ⅲ的化学平衡常数
时,反应ⅲ的化学平衡常数

您最近一年使用:0次
名校
解题方法
2 .  甲烷化是实现“碳中和”“碳达峰”的有效手段。该过程的总反应为
甲烷化是实现“碳中和”“碳达峰”的有效手段。该过程的总反应为
 ,此反应可理解为分两步完成,反应过程如下:
,此反应可理解为分两步完成,反应过程如下:
①
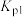 ;
;
②

回答下列问题:
(1) 甲烷化的技术核心是催化剂的选择。图甲是两种不同催化剂条件下反应相同时间,
甲烷化的技术核心是催化剂的选择。图甲是两种不同催化剂条件下反应相同时间, 转化率和
转化率和 选择性随温度的变化。
选择性随温度的变化。___________ ,使用的合适温度为___________ 。
(2)在某温度下,向恒容密闭容器中充入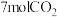 和
和 ,初始压强为
,初始压强为 ,反应经
,反应经 达到平衡,此时
达到平衡,此时 ,
, ,则总反应的
,则总反应的
___________  。该温度下反应①的
。该温度下反应①的
___________ (用平衡分压代替平衡浓度);在该平衡体系,若保持温度不变压缩容器的容积, 的物质的量
的物质的量___________ (填“增加”“减小”或“不变”)。
(3)为研究反应过程的热效应,一定温度范围内对上述反应的平衡常数 进行计算,得
进行计算,得 的线性关系如图乙。则
的线性关系如图乙。则 温度下
温度下
___________ 。
(4)恒压、 时,
时, 和
和 按物质的量之比
按物质的量之比 投料,经图丙的反应过程(主要产物已标出)可实现
投料,经图丙的反应过程(主要产物已标出)可实现 的高效转化。
的高效转化。___________ (填序号)。
A. 可循环利用,
可循环利用, 不可循环利用
不可循环利用
B.过程ii 吸收
吸收 可促使
可促使 氧化
氧化 反应的平衡正向移动
反应的平衡正向移动
C.过程ii产生的 最终未被
最终未被 吸收,在过程ⅲ被排出
吸收,在过程ⅲ被排出
②过程ii平衡后通入 ,保持恒压条件,测得一段时间内
,保持恒压条件,测得一段时间内 物质的量上升,根据过程iii,结合平衡移动原理,解释
物质的量上升,根据过程iii,结合平衡移动原理,解释 物质的量上升的原因:
物质的量上升的原因:___________ 。
 甲烷化是实现“碳中和”“碳达峰”的有效手段。该过程的总反应为
甲烷化是实现“碳中和”“碳达峰”的有效手段。该过程的总反应为
 ,此反应可理解为分两步完成,反应过程如下:
,此反应可理解为分两步完成,反应过程如下:①

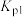 ;
;②


回答下列问题:
(1)
 甲烷化的技术核心是催化剂的选择。图甲是两种不同催化剂条件下反应相同时间,
甲烷化的技术核心是催化剂的选择。图甲是两种不同催化剂条件下反应相同时间, 转化率和
转化率和 选择性随温度的变化。
选择性随温度的变化。
(2)在某温度下,向恒容密闭容器中充入
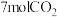 和
和 ,初始压强为
,初始压强为 ,反应经
,反应经 达到平衡,此时
达到平衡,此时 ,
, ,则总反应的
,则总反应的
 。该温度下反应①的
。该温度下反应①的
 的物质的量
的物质的量(3)为研究反应过程的热效应,一定温度范围内对上述反应的平衡常数
 进行计算,得
进行计算,得 的线性关系如图乙。则
的线性关系如图乙。则 温度下
温度下
(4)恒压、
 时,
时, 和
和 按物质的量之比
按物质的量之比 投料,经图丙的反应过程(主要产物已标出)可实现
投料,经图丙的反应过程(主要产物已标出)可实现 的高效转化。
的高效转化。
A.
 可循环利用,
可循环利用, 不可循环利用
不可循环利用B.过程ii
 吸收
吸收 可促使
可促使 氧化
氧化 反应的平衡正向移动
反应的平衡正向移动C.过程ii产生的
 最终未被
最终未被 吸收,在过程ⅲ被排出
吸收,在过程ⅲ被排出②过程ii平衡后通入
 ,保持恒压条件,测得一段时间内
,保持恒压条件,测得一段时间内 物质的量上升,根据过程iii,结合平衡移动原理,解释
物质的量上升,根据过程iii,结合平衡移动原理,解释 物质的量上升的原因:
物质的量上升的原因:
您最近一年使用:0次
解题方法
3 . 工业合成氨是人类科学技术的一项重大突破,我国目前氨的生产能力位居世界首位。合成氨反应为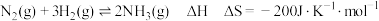 。回答下列问题:
。回答下列问题:
(1)已知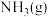 和
和 的燃烧热(
的燃烧热( )分别为
)分别为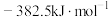 和
和 ,则合成氨反应的
,则合成氨反应的
_______ ;合成氨反应的逆过程能自发进行的最低温度为_______  。
。
(2)在合成氨过程中,需要不断分离出氨的原因为_______ (填字母)。
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为 的恒容密闭容器中模拟工业合成氨,充入
的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为
的总物质的量为 ,容器内起始压强为标准压强
,容器内起始压强为标准压强 ,容器内各组分的物质的量分数与反应时间
,容器内各组分的物质的量分数与反应时间 的关系如图所示:
的关系如图所示:_______ (填物质名称)的物质的量分数的变化情况。
② 内,平均反应速率
内,平均反应速率
_______  。
。
③达平衡时容器内压强为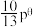 ,则标准平衡常数
,则标准平衡常数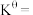
_______ [对于反应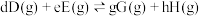 ,标准平衡常数
,标准平衡常数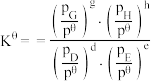 ,其中
,其中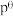 为标准压强,
为标准压强, 、
、 、
、 、
、 为各组分的平衡分压,分压
为各组分的平衡分压,分压 总压
总压 物质的量分数]。
物质的量分数]。
(4)利用热再生氨电池可实现 电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的
电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的 电镀废液,向甲室中加入足量氨气后电池开始工作。
电镀废液,向甲室中加入足量氨气后电池开始工作。_______ 。
②理论上每转移 电子,乙室中溶液的质量变化为
电子,乙室中溶液的质量变化为_______ g。
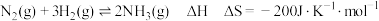 。回答下列问题:
。回答下列问题:(1)已知
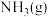 和
和 的燃烧热(
的燃烧热( )分别为
)分别为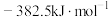 和
和 ,则合成氨反应的
,则合成氨反应的
 。
。(2)在合成氨过程中,需要不断分离出氨的原因为
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为
 的恒容密闭容器中模拟工业合成氨,充入
的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为
的总物质的量为 ,容器内起始压强为标准压强
,容器内起始压强为标准压强 ,容器内各组分的物质的量分数与反应时间
,容器内各组分的物质的量分数与反应时间 的关系如图所示:
的关系如图所示: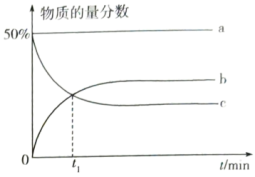
②
 内,平均反应速率
内,平均反应速率
 。
。③达平衡时容器内压强为
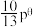 ,则标准平衡常数
,则标准平衡常数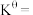
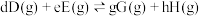 ,标准平衡常数
,标准平衡常数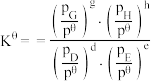 ,其中
,其中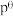 为标准压强,
为标准压强, 、
、 、
、 、
、 为各组分的平衡分压,分压
为各组分的平衡分压,分压 总压
总压 物质的量分数]。
物质的量分数]。(4)利用热再生氨电池可实现
 电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的
电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的 电镀废液,向甲室中加入足量氨气后电池开始工作。
电镀废液,向甲室中加入足量氨气后电池开始工作。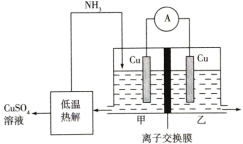
②理论上每转移
 电子,乙室中溶液的质量变化为
电子,乙室中溶液的质量变化为
您最近一年使用:0次
名校
解题方法
4 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.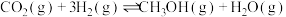
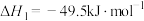
Ⅱ.

Ⅲ.

回答下列问题:
(1)
___________ kJ⋅mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
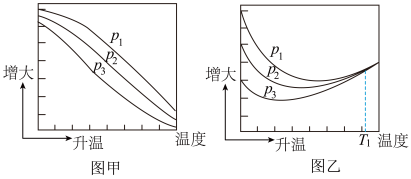
(3)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知: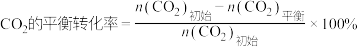
CH3OH的平衡产率=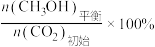
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
(5)甲醇燃料电池中甲醇在___________ (填“正”或“负”)极发生反应,酸性条件下其正极的电极反应式为___________ 。
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为___________ 。
Ⅰ.
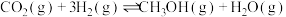
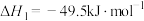
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中
 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为(3)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:
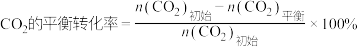
CH3OH的平衡产率=
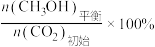
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
(5)甲醇燃料电池中甲醇在
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为
您最近一年使用:0次
2024-03-16更新
|
237次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题
2024·广西·模拟预测
名校
解题方法
5 . 实验室用以下装置(夹持和水浴加热装置略)制备环己酮缩乙二醇。
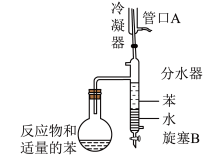

| A.以共沸体系带出水促使反应正向进行 |
| B.当观察到分水器中苯层液面高于支管口时,必须打开旋塞B将水放出 |
| C.管口A是冷凝水的进水口 |
| D.根据带出水的体积可估算反应进度 |
您最近一年使用:0次
2023-12-20更新
|
2150次组卷
|
8卷引用:河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题
河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题(已下线)化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题(已下线)热点19 化学微型实验福建省泉州市永春一中、培元中学、石光中学、季延中学2023-2024学年高三下学期第二次联合考试化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题
6 . 下列措施会使平衡向左移动的是
| A.恒温时,增大平衡体系N2(g)+3H2(g)⇌2NH3(g)的压强 |
| B.恒压下,降低平衡体系H2(g)+I2(g)⇌2HI(g) ΔH<0的温度 |
| C.向FeCl3+3KSCN⇌Fe(SCN)3+3KCl中加入少量固体KCl |
| D.恒温恒压下向平衡体系N2(g)+3H2(g)⇌2NH3(g)中充入氦气 |
您最近一年使用:0次
2024-01-16更新
|
214次组卷
|
3卷引用:河南省济源高级中学2022-2023学年高二下学期3月月考 化学试卷
名校
解题方法
7 . 海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:___________ ,此反应中SO2做___________ (填氧化剂或还原剂)。
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+_______________
当有3molBr2参加反应,发生转移的电子的物质的量为___________ 。
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
②关于该反应下列说法不正确的是___________ 。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下: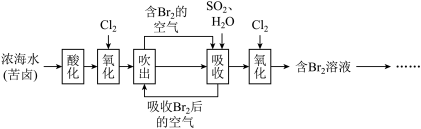
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+________
当有3molBr2参加反应,发生转移的电子的物质的量为
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

②关于该反应下列说法不正确的是
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
您最近一年使用:0次
2023-07-20更新
|
112次组卷
|
5卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题
河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题湖南省张家界市2022-2023学年高一下学期期末考试化学试题安徽师范大学附属中学2023-2024学年高二上学期开学考试化学试题(已下线)综合02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)名校期末好题汇编-化学与可持续发展(非选择题)
名校
8 . 向一恒容密闭容器中加入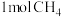 和一定量的
和一定量的 ,发生反应
,发生反应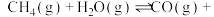
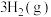 。
。 的平衡转化率按不同投料比
的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法正确的是
随温度的变化曲线如图所示。下列说法正确的是

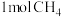 和一定量的
和一定量的 ,发生反应
,发生反应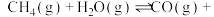
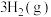 。
。 的平衡转化率按不同投料比
的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法正确的是
随温度的变化曲线如图所示。下列说法正确的是
A. |
B.反应速率: |
C.点a、b、c对应的平衡常数: |
D.反应温度为 ,当容器内压强不变时,反应达到平衡状态 ,当容器内压强不变时,反应达到平衡状态 |
您最近一年使用:0次
2023-07-12更新
|
603次组卷
|
2卷引用:河南省驻马店市2022-2023学年高二下学期期末考试化学试题
名校
9 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与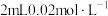 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与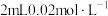 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。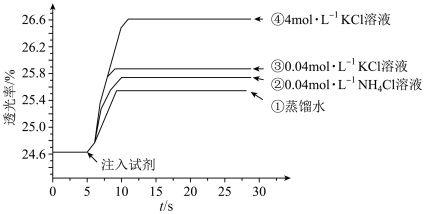
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
363次组卷
|
7卷引用:河南省南阳市2023-2024学年高二上学期期中考试化学试题
10 . 丙烯酸是非常重要的化工原料之一,由甘油催化转化生成丙烯酸的过程为:甘油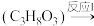 丙烯醛
丙烯醛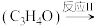 丙烯酸
丙烯酸 。
。
已知:反应Ⅰ: (活化能)
(活化能)
反应Ⅱ: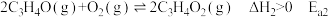 (活化能)
(活化能)
甘油在常压下沸点为290℃,工业生产选择反应温度为300℃常压下进行。下列说法错误的是
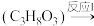 丙烯醛
丙烯醛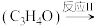 丙烯酸
丙烯酸 。
。已知:反应Ⅰ:
 (活化能)
(活化能)反应Ⅱ:
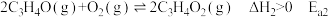 (活化能)
(活化能)甘油在常压下沸点为290℃,工业生产选择反应温度为300℃常压下进行。下列说法错误的是
A.当 的体积分数保持不变,说明反应达到平衡状态 的体积分数保持不变,说明反应达到平衡状态 |
| B.固体催化剂一定时,增大其表面积可提高化学反应速率,增大甘油的平衡转化率 |
C.丙烯醛有毒,为了工业生产安全可选择能大幅降低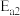 且对 且对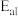 几乎无影响的催化剂 几乎无影响的催化剂 |
| D.若改变条件增大反应Ⅱ的平衡常数,反应Ⅱ一定向正反应方向移动 |
您最近一年使用:0次
2023-04-23更新
|
171次组卷
|
2卷引用:河南省开封市五校2023-2024学年高二上学期期末联考 化学试题



