乙酸俗称醋酸,是一种重要的化工原料。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:_____ 。
②已知B为六配位离子,画出B的结构示意图_____ 。
③根据反应④,写出E生成CH3COOH的化学方程式_____ 。
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g) C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
Ⅱ.CH3COOH(g)+C2H5OH(g) CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
Ⅲ.CH3COOH(g)+H2(g) CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知: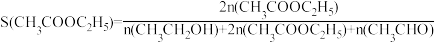
①CH3CHO(g)+H2(g) C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=_____ kJ·mol-1。
②图中表示乙酸的转化率随温度变化的曲线是_____ 。当温度低于340℃时,随着温度的升高,CH3COOC2H5选择性变大的原因是_____ 。_____ (任写一条)。
④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=_____ (保留2位小数)。
(1)1968年,Monsanto以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸,反应历程如下图所示:

②已知B为六配位离子,画出B的结构示意图
③根据反应④,写出E生成CH3COOH的化学方程式
(2)乙酸在催化剂的作用下和氢气反应可生成乙醇,反应体系主要发生如下反应:
Ⅰ.CH3COOH(g)+2H2(g)
 C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1
C2H5OH(g)+H2O(g) ΔH1=-44.2kJ·mol-1Ⅱ.CH3COOH(g)+C2H5OH(g)
 CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1
CH3COOC2H5(g)+H2O(g) ΔH2=-18.4kJ·mol-1Ⅲ.CH3COOH(g)+H2(g)
 CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1
CH3CHO(g)+H2O(g) ΔH3=+24.5kJ·mol-1在200kPa反应条件下,将n(H2)∶n(CH3COOH)=10∶1的混合气进行上述反应。平衡时乙酸的转化率、产物的选择性S随温度变化如下图所示。
已知:
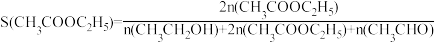
①CH3CHO(g)+H2(g)
 C2H5OH(g)的ΔH=
C2H5OH(g)的ΔH=②图中表示乙酸的转化率随温度变化的曲线是

④恒温恒压条件下,向初始体积为1L的体积可变密闭容器中通入2molH2和1molCH3COOH,发生上述反应,达到平衡时容器的体积变为0.8L,S(CH3COOC2H5)=S(CH3CHO),n(H2)=0.7mol。反应Ⅱ的平衡常数K=
更新时间:2024-05-23 17:40:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I.在水溶液中橙红色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+。现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
+2H+。现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈___________ 色,因为___________ 。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__ 方向移动(“正”或“逆”)。
II.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)⇌CO2(B)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。请回答下列有关问题。

(3)该反应的△H___________ 0(填“<”、“>”或“=”)。
(4)在T2时,若反应体系处于状态D,则此时v正___________ v逆(填“<”、“>”或“=”)。
(5)在T3时,可逆反应C(s)+2NO(g)⇌CO2(g)+N2(g)在密闭容器中达平衡,只改变下列条件,一定既能加快反应速度,又能增大平衡时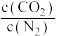 的值是___________。
的值是___________。
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+。现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
+2H+。现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。(1)向上述溶液中加入浓硫酸溶液,溶液呈
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向
II.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)⇌CO2(B)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。请回答下列有关问题。

(3)该反应的△H
(4)在T2时,若反应体系处于状态D,则此时v正
(5)在T3时,可逆反应C(s)+2NO(g)⇌CO2(g)+N2(g)在密闭容器中达平衡,只改变下列条件,一定既能加快反应速度,又能增大平衡时
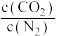 的值是___________。
的值是___________。| A.加入一定量C | B.减小容器容积 | C.升高温度 | D.加入一定量的CO2 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】将一定量的NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,各物质的浓度随时间的变化如图1所示,请回答下列问题:

(1)图1中,曲线_______ (填“X”或“Y”)表示NO2浓度随时间的变化情况,前10min内v(NO2)=_______ mol/(L· min);
(2)下列选项中不能说明该反应已达到平衡状态的是____ (填选项字母)
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为______________________ ,该反应的平衡常数K=_____________ ;
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1______ w2(填“>”“=”或“<”)
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)________________


(1)图1中,曲线
(2)下列选项中不能说明该反应已达到平衡状态的是
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均相对分子质量不随时间变化而改变
(3)反应进行到10min时,共吸收热量22.76kJ,则该反应的热化学反应方程式为
(4)反应进行到20min时,再向容器内充入一定量的NO2,10min后达到新平衡,此时测得c(NO2)=0.9mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中的NO2的体积分数为w2,则w1
②请在图2中画出20min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”,且要体现出始状态与末状态要用具体浓度)

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如图:
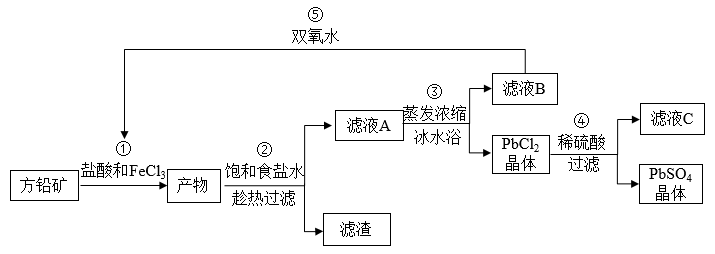
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) PbCl
PbCl (aq)△H>0
(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7。
(1)过程①中可以加快反应速率和提高原料利用率的方法是___ 、___ (写出2种即可)。
(2)①中生成淡黄色沉淀的离子方程式是___ ,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____ 。
(3)用化学平衡移动的原理解释③中使用冰水浴的原因是___ 。
(4)上述流程中可循环利用的物质有___ 。
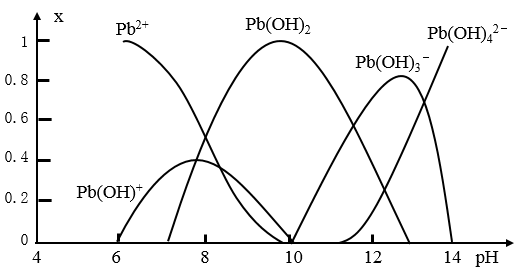
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造
成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH) 、Pb(OH)
、Pb(OH) 。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为____ 。
(6)用铅蓄电池电解浓度较大的CuCl2溶液,两极均用石墨做电极,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=___ mol·L-1(已知:Cu(OH)2的Ksp=2.2×10-20)。

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq)
 PbCl
PbCl (aq)△H>0
(aq)△H>0③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7。
(1)过程①中可以加快反应速率和提高原料利用率的方法是
(2)①中生成淡黄色沉淀的离子方程式是
(3)用化学平衡移动的原理解释③中使用冰水浴的原因是
(4)上述流程中可循环利用的物质有
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造
成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)
 、Pb(OH)
、Pb(OH) 。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
(6)用铅蓄电池电解浓度较大的CuCl2溶液,两极均用石墨做电极,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=_______ kJ·mol-1。
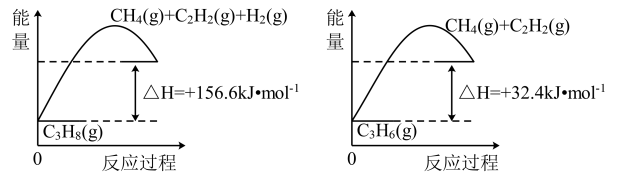
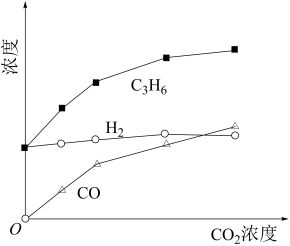
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为_______ (用化学方程式表示)。
(3)已知Arrhenius 经验公式为Rlnk=RlnA- (Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为
(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为_______ J·mol-1,当其实验数据发生变化如图中b线所示,则可能的原因是_______ 。

(4)工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
该温度下,若平衡时HCl的体积分数为10%。此时CH2=CHCH3的转化率为_______ 。反应①的压力平衡常数Kp=_______ kPa-1(保留小数点后2位)。
(5)一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。
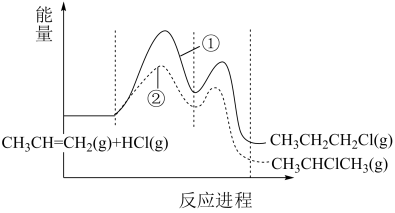
保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是_______。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=

(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为

(3)已知Arrhenius 经验公式为Rlnk=RlnA-
 (Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为
(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为
(4)工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 58 | 58 |
(5)一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。

保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是_______。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】利用甲醇和水蒸气重整可为燃料电池提供氢气。回答下列问题:
(1)甲醇和水蒸气重整时,未使用催化剂和使用催化剂两种反应进程中能量的变化曲线a和b如图所示。

①反应的热化学方程式为___________ 。
②b过程第Ⅱ步反应为___________ (填“放热”或“吸热”)反应
(2)为探究反应条件对反应平衡的影响,将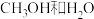 按物质的量之比为1:1充入恒容密闭容器中进行实验,
按物质的量之比为1:1充入恒容密闭容器中进行实验, 代表压强或温度。
代表压强或温度。 的平衡转化率随
的平衡转化率随 的变化关系如图所示。
的变化关系如图所示。

①X代表的物理量是___________ 。
②判断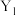
___________ 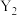 (填“>”或“<”),理由是
(填“>”或“<”),理由是___________ 。
③在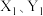 条件下,设平衡时容器内的总压强为
条件下,设平衡时容器内的总压强为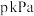 ,该反应的平衡常数
,该反应的平衡常数
___________ [对于气相反应,用某组分B的平衡分压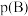 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,其中
,其中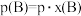 ,
,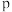 为平衡总压强,
为平衡总压强,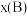 为平衡系统中B的物质的量分数,列出计算式即可]。
为平衡系统中B的物质的量分数,列出计算式即可]。
(3)甲醇和水蒸气重整过程中,存在副反应: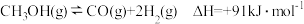 。
。
CO易使主反应的催化剂中毒,研究温度和水/甲醇投料比对甲醇平衡转化率及重整气中CO物质的量分数的影响,结果如图所示。

①该反应适合的反应条件为___________ ,原因是___________ 。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是___________ 。
(1)甲醇和水蒸气重整时,未使用催化剂和使用催化剂两种反应进程中能量的变化曲线a和b如图所示。

①反应的热化学方程式为
②b过程第Ⅱ步反应为
(2)为探究反应条件对反应平衡的影响,将
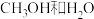 按物质的量之比为1:1充入恒容密闭容器中进行实验,
按物质的量之比为1:1充入恒容密闭容器中进行实验, 代表压强或温度。
代表压强或温度。 的平衡转化率随
的平衡转化率随 的变化关系如图所示。
的变化关系如图所示。
①X代表的物理量是
②判断
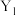
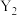 (填“>”或“<”),理由是
(填“>”或“<”),理由是③在
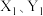 条件下,设平衡时容器内的总压强为
条件下,设平衡时容器内的总压强为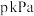 ,该反应的平衡常数
,该反应的平衡常数
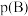 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,其中
,其中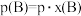 ,
,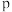 为平衡总压强,
为平衡总压强,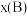 为平衡系统中B的物质的量分数,列出计算式即可]。
为平衡系统中B的物质的量分数,列出计算式即可]。(3)甲醇和水蒸气重整过程中,存在副反应:
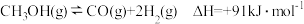 。
。CO易使主反应的催化剂中毒,研究温度和水/甲醇投料比对甲醇平衡转化率及重整气中CO物质的量分数的影响,结果如图所示。

①该反应适合的反应条件为
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】我国向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。
Ⅰ.CO2加氢可以合成甲醇,该过程主要发生如下反应:
反应①:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应②:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
反应③:CO(g)+2H2(g) CH3OH(g) △H3
CH3OH(g) △H3
(1)反应②的活化能Ea(正)______ Ea(逆)(填“大于”“小于”或“等于”)。相关键能数据如表,则△H1=______ kJ•mol-1。若K1、K2、K3分别表示反应①、反应②、反应③的平衡常数,则K3=______ (用含K1、K2的代数式表示)。
(2)某温度下,初始压强为p,容积为2L的恒容密闭容器中充入2mol CO2、3mol H2,只发生反应①、②,平衡时CO2的转化率为50%,体系内剩余1mol H2,反应②的平衡常数K=______ 。
Ⅱ.清洁能源的开发利用是实现“碳中和”的途径,乙醇—水催化重整可获得H2。其主要反应为:
反应①:C2H5OH(g)+3H2O=2CO2(g)+6H2(g) △H=+173.3kJ•mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
在1.0×105Pa、n始(C2H5OH):n始(H2O)=1:3时,若仅考虑上述反应,平衡时CO2和CO的生成选择性及H2的产率随温度的变化如图所示。CO的选择性=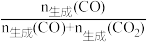 ×100%
×100%

(3)图中表示平衡时CO2的选择性及H2的产率随温度的变化的曲线分别是曲线______ 、曲线______ (填“①”、“②”或“③”)。400℃以后,H2的产率随温度变化的原因是______ 。
(4)光催化甲烷重整技术也是研究热点。以Rh/SrTiO3为光催化剂,光照时,价带失去电子并产生空穴(h+,具有强氧化性),CO2在导带获得电子生成CO和O2-,价带上CH4直接转化为CO和H2,反应机理如图所示:

当价带产生1mol空穴(h+)时,在Rh表面生成的CO数目为______ NA;价带上的电极反应式可表示为______ 。
Ⅰ.CO2加氢可以合成甲醇,该过程主要发生如下反应:
反应①:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应②:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1反应③:CO(g)+2H2(g)
 CH3OH(g) △H3
CH3OH(g) △H3(1)反应②的活化能Ea(正)
| 化学键 | H-H | C≡O | O-H | C=O |
| 键能/(kJ•mol-1) | 436 | 1071 | 464 | 803 |
Ⅱ.清洁能源的开发利用是实现“碳中和”的途径,乙醇—水催化重整可获得H2。其主要反应为:
反应①:C2H5OH(g)+3H2O=2CO2(g)+6H2(g) △H=+173.3kJ•mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
在1.0×105Pa、n始(C2H5OH):n始(H2O)=1:3时,若仅考虑上述反应,平衡时CO2和CO的生成选择性及H2的产率随温度的变化如图所示。CO的选择性=
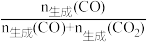 ×100%
×100%
(3)图中表示平衡时CO2的选择性及H2的产率随温度的变化的曲线分别是曲线
(4)光催化甲烷重整技术也是研究热点。以Rh/SrTiO3为光催化剂,光照时,价带失去电子并产生空穴(h+,具有强氧化性),CO2在导带获得电子生成CO和O2-,价带上CH4直接转化为CO和H2,反应机理如图所示:

当价带产生1mol空穴(h+)时,在Rh表面生成的CO数目为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】钛被视为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”,钛和钛的化合物在航天、化工、建筑、医疗中都有着广泛的用途。回答下列问题:
(1)基态钛原子核外有___________ 种能量不同的电子,其价电子排布式为___________ ;
(2)钛与卤素形成的化合物TiX4熔点如下表:
它们熔点差异的原因_____________________ ;
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①Ti(BH4)3中所含元素电负性由小到大的顺序为___________ ;
②TiCl4的空间结构为___________ ;
③LiBH4由Li+和BH 构成,BH
构成,BH 中B原子的杂化类型是
中B原子的杂化类型是___________ ;
④LiBH4不存在___________ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,已知该晶体的晶胞参数为423.5 pm。用Al掺杂TiN后晶胞参数不变,其晶胞结构如图所示,距离Ti最近的Al有___________ 个,掺杂Al后的晶体密度是TiN晶体密度的___________ 倍(保留三位小数)。
(1)基态钛原子核外有
(2)钛与卤素形成的化合物TiX4熔点如下表:
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点℃ | 377 | -24 | 38.3 | 153 |
(3)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①Ti(BH4)3中所含元素电负性由小到大的顺序为
②TiCl4的空间结构为
③LiBH4由Li+和BH
 构成,BH
构成,BH 中B原子的杂化类型是
中B原子的杂化类型是④LiBH4不存在
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,已知该晶体的晶胞参数为423.5 pm。用Al掺杂TiN后晶胞参数不变,其晶胞结构如图所示,距离Ti最近的Al有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式______________ 。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是_______ 原子。
(3)磷化硼的晶体类型是________ ,B原子的杂化方式是_______ ,每生成1molBP,共形成_______ molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P____ B(填“>”、“<”)
(5)BBr3分子中,键角为_______________ ,为__________ (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是________________ 。
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是
(3)磷化硼的晶体类型是
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P
(5)BBr3分子中,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】(1)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为整合物。一种 配合物的结构如图甲所示,
配合物的结构如图甲所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有_______  ,该螯合物中N的杂化方式有
,该螯合物中N的杂化方式有_______ 种。

(2)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系 的晶胞结构如图乙所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
的晶胞结构如图乙所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
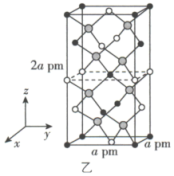
一个晶胞中有_______ 个 ,找出距离
,找出距离 最近的
最近的
_______ (用分数坐标表示)。 晶体中与单个
晶体中与单个 键合的
键合的 有
有_______ 个。
 配合物的结构如图甲所示,
配合物的结构如图甲所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有 ,该螯合物中N的杂化方式有
,该螯合物中N的杂化方式有
(2)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系
 的晶胞结构如图乙所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
的晶胞结构如图乙所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
| 坐标 原子 | x | y | z |
 | 0 | 0 | 0 |
 | 0 | 0 | 0.5 |
 | 0.25 | 0.25 | 0.125 |
 ,找出距离
,找出距离 最近的
最近的
 晶体中与单个
晶体中与单个 键合的
键合的 有
有
您最近一年使用:0次



