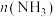1 . 氙及其化合物在工业生产中有重要用途。
(1)1962年,化学家巴特利特合成了氙的第一个化合物 ,其在熔化时电离出
,其在熔化时电离出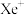 和
和 。Xe和
。Xe和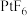 混合制得
混合制得 的反应可以表示如下:
的反应可以表示如下: )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能, 的晶格能为
的晶格能为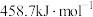 。
。
②Xe的第一电离能为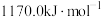 。
。
③
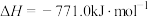 。
。
根据以上信息,计算反应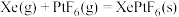

___________  。
。
(2)不久,在三个不同实验室里又分别合成了 、
、 、
、 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为___________ ,中心原子的价层电子对数为___________ ,晶体密度为___________  。
。 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
已知:分压=总压×该组分物质的量分数;
对于反应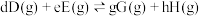
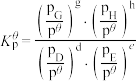
其中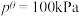 ,
,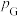 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。
①
___________ 0(填“>”或“<”)。为提高平衡混合物中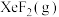 的含量,应
的含量,应___________ 投料比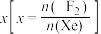 (填“增大”或“减小”)。
(填“增大”或“减小”)。
②673K时充入23.77molXe和 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:
则 平衡转化率
平衡转化率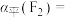
___________ (保留三位有效数字),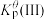
___________ 。
(1)1962年,化学家巴特利特合成了氙的第一个化合物
 ,其在熔化时电离出
,其在熔化时电离出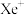 和
和 。Xe和
。Xe和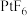 混合制得
混合制得 的反应可以表示如下:
的反应可以表示如下: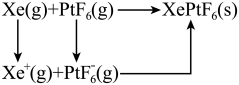
 )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能, 的晶格能为
的晶格能为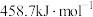 。
。②Xe的第一电离能为
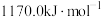 。
。③

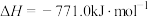 。
。根据以上信息,计算反应
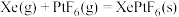

 。
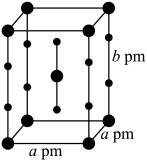
。(2)不久,在三个不同实验室里又分别合成了
 、
、 、
、 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为 。
。
 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
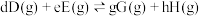
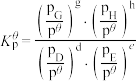
其中
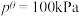 ,
,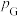 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。标准压强平衡常数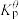 反应平衡 | 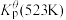 | 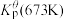 |
反应I: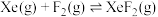  | 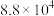 | 360 |
反应II: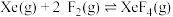  | ||
反应III: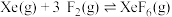  | 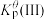 |

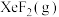 的含量,应
的含量,应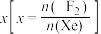 (填“增大”或“减小”)。
(填“增大”或“减小”)。②673K时充入23.77molXe和
 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:| 化学式 |  |  |  |
| 物质的量/mol | 3.60 | 19.80 | 0.36 |
 平衡转化率
平衡转化率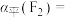
您最近半年使用:0次
名校
解题方法
2 . 一定温度下,在2L的恒容密闭容器中,通入 和
和 ,反应过程中的部分数据如下表所示,下列说法不正确的是
,反应过程中的部分数据如下表所示,下列说法不正确的是
 和
和 ,反应过程中的部分数据如下表所示,下列说法不正确的是
,反应过程中的部分数据如下表所示,下列说法不正确的是n/mol t/min |
|
|
|
0 | 2 | 6 | 0 |
5 | 0.8 | ||
10 | 1.4 | ||
15 | 4.2 |
A.前5min内 的反应速率为 的反应速率为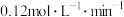 |
B.反应达到平衡时, 的转化率为30% 的转化率为30% |
| C.该反应进行到10分钟时未达到平衡状态 |
| D.在容器通入一定量的氦气,反应速率不变 |
您最近半年使用:0次
3 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
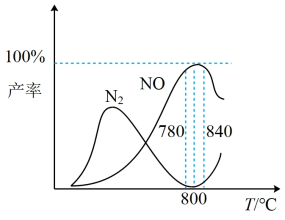
有关物质产率与温度的关系如图。_________ 。
6.工业上采用物料比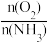 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
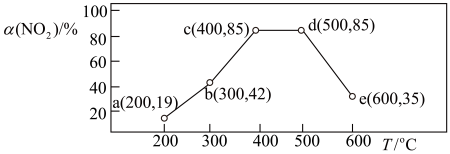
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。
6.工业上采用物料比
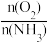 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点
您最近半年使用:0次
名校
解题方法
4 . 按要求填空
(1)少量铁溶于稀硝酸的化学方程式为_____________________ 。
(2) 通入
通入 溶液的离子反应方程式为
溶液的离子反应方程式为_______________________ 。
(3)铜和浓硫酸的化学方程式为___________________________ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是__________ 。
(4)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是________________________________________________________ 。_______________________ 。
②2min内Y的转化率为___________________ 。
(1)少量铁溶于稀硝酸的化学方程式为
(2)
 通入
通入 溶液的离子反应方程式为
溶液的离子反应方程式为(3)铜和浓硫酸的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(4)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是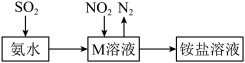

②2min内Y的转化率为
您最近半年使用:0次
名校
解题方法
5 . I、一定温度时,在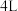 密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:________________ , 时刻M的转化率为
时刻M的转化率为________________ 。
(2)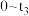 时间内用M表示的化学反应速率为
时间内用M表示的化学反应速率为________  /(
/(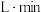 ).
).
(3)下列能表示上述反应达到化学平衡状态的是________(填编号)。
Ⅱ、一定条件下,在容积为 的密闭容器中发生反应:
的密闭容器中发生反应: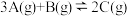 。开始时加入
。开始时加入 、
、 、
、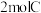 ,在
,在 末测得C的物质的量是
末测得C的物质的量是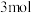 。
。
(4)用B的浓度变化表示反应的平均速率:________________ 。
(5)在 末,A的浓度为
末,A的浓度为________________ 。
(6)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①充入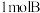 ,化学反应速率
,化学反应速率________________ ;
②将容器的容积变为 ,化学反应速率
,化学反应速率________________ ;
③升高温度,化学反应速率________________ 。
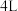 密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:
 时刻M的转化率为
时刻M的转化率为(2)
 时间内用M表示的化学反应速率为
时间内用M表示的化学反应速率为 /(
/( ).
).(3)下列能表示上述反应达到化学平衡状态的是________(填编号)。
A. | B.M与N的物质的量之比保持不变 |
| C.容器中压强保持不变 | D.混合气体密度保持不变 |
Ⅱ、一定条件下,在容积为
 的密闭容器中发生反应:
的密闭容器中发生反应: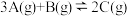 。开始时加入
。开始时加入 、
、 、
、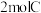 ,在
,在 末测得C的物质的量是
末测得C的物质的量是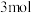 。
。(4)用B的浓度变化表示反应的平均速率:
(5)在
 末,A的浓度为
末,A的浓度为(6)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①充入
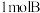 ,化学反应速率
,化学反应速率②将容器的容积变为
 ,化学反应速率
,化学反应速率③升高温度,化学反应速率
您最近半年使用:0次
2024高三下·全国·专题练习
6 . 雾霾主要成分为灰尘、SO2、NOx和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①T1___________ T2(填“<"、“>”或“无法确定”),该反应的 H
H___________ 0(填“<”或“>”)。
②0~25min内乙容器中反应的平均速率:v(NO2)=___________ 。
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为___________ ,平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
(1)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:

| 容器 | 甲 | 乙 |
| 温度/K | T1 | T2 |
| 容积/L | 2 | |
| 起始充入量 | 4molNO2和2molO3 | |
 H
H②0~25min内乙容器中反应的平均速率:v(NO2)=
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为
您最近半年使用:0次
7 . 工业上以1,4-丁二醇(BD)为原料催化脱氢制备γ-丁内酯(BL),其副反应产物为四氢呋喃( ,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
| 温度/℃ | 220 | 240 | 250 | 255 |
| BL/% | 60.2 | 84.6 | 92.6 | 95.2 |
| THF/% | 1.2 | 1.8 | 1.9 | 2.1 |
| BuOH/% | 0.2 | 0.3 | 0.4 | 0.6 |
已知:HO(CH2)4OH(g,BD)
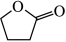 (g,BL)+2H2(g) ΔH>0
(g,BL)+2H2(g) ΔH>0
| A.220℃,2h时n(BL)=9.03×10-3mol,则BD的总转化率为37.5% |
| B.250℃,2h时n(BD)+n(BL)+n(THF)+n(BuOH)<4×10-2mol |
| C.255℃,2h时n(BL)=1.5×10-2mol,则0~2h内υ(H2)主反应=1.5×10-2mol·L−1·h−1 |
| D.由表中数据可知,220~255℃,催化剂活性、选择性均随着温度的升高而提高 |
您最近半年使用:0次
名校
8 . 已知反应2CH3OH(g) CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
 CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400。此温度下,在2L的密闭容器中充入amol CH3OH,反应到某时刻测得各组分的浓度如下表。下列说法错误的是| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 0.44 | 0.6 | 0.6 |
| A.a=1.64 |
| B.此时刻v正>v逆 |
| C.若起始时加入2amolCH3OH,则达到平衡时CH3OH的转化率不变 |
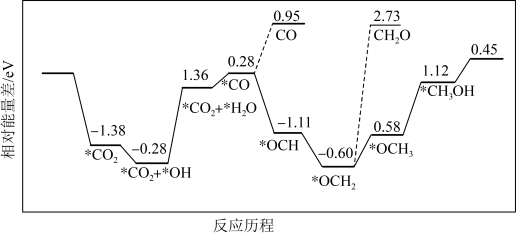
| D.CO2与H2合成原料甲醇反应历程如图所示,要使合成甲醇的反应速率加快,主要是降低*CO+*OH→*CO+*H2O的能量变化 |
您最近半年使用:0次
解题方法
9 . 某温度下,在2L恒容密闭容器中投入4mol 发生如下反应
发生如下反应
 有关数据如下:
有关数据如下:
下列说法错误的是
 发生如下反应
发生如下反应
 有关数据如下:
有关数据如下:| 时间段/min |  的平均生成速率/ 的平均生成速率/ |
| 0-1 | 0.4 |
| 0-2 | 0.3 |
| 0-3 | 0.2 |
A.30秒时, 的浓度大于 的浓度大于 |
B.0-1min内, 的反应速率为 的反应速率为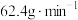 |
C.2min30秒时 物质的量等于2.8mol 物质的量等于2.8mol |
D.当 的体积百分数不变时,说明此反应达到了平衡状态 的体积百分数不变时,说明此反应达到了平衡状态 |
您最近半年使用:0次
解题方法
10 . 将氨水逐滴加入 的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数
的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数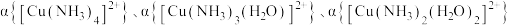 、
、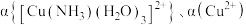 随
随 的变化曲线如图.下列说法正确的是
的变化曲线如图.下列说法正确的是
 的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数
的硫酸铜溶液中,测得混合液中五种微粒的物质的量分数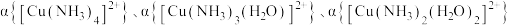 、
、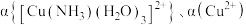 随
随 的变化曲线如图.下列说法正确的是
的变化曲线如图.下列说法正确的是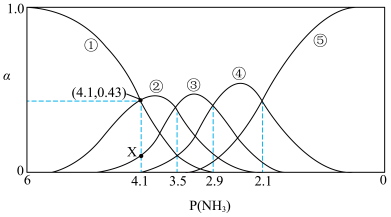
A.图中X点坐标为 |
B.曲线④表示 随 随 变化的曲线 变化的曲线 |
C. 值从小到大过程中, 值从小到大过程中,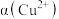 逐渐增大,溶液的蓝色逐渐变深 逐渐增大,溶液的蓝色逐渐变深 |
D.反应 的平衡常数 的平衡常数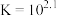 |
您最近半年使用:0次