1 . 砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)As元素与N元素同族,画出As原子的原子结构示意图:______
(2)下列关于第VA族元素及其化合物的说法不正确的是______ (填序号)
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.第VA族元素都是非金属元素
(3)已知:①4As(s)+5O2(g)=2As2O5(s) ΔH1
②As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH2
H2(g)+2O2(g)=H3AsO4(s) ΔH2
③氢气的燃烧热 ΔH3
则As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH4=______ 。
(4)在一定温度下,向某容器中加入一定量的Na3AsO3、I2和NaOH溶液,发生反应: +I2+2OH-
+I2+2OH-
 +2I-+H2O,
+2I-+H2O, 的转化率[α(
的转化率[α( )]与时间的关系如图所示。
)]与时间的关系如图所示。

①E点:v正______ (填“>”“<”或“=”,下同)v逆;E点的v逆______ G点的v正。
②下列情况表明该反应达到平衡状态的是______ (填字母)。
a.2v正(I-)=v逆(AsO ) b.溶液颜色不再变化
) b.溶液颜色不再变化
c.溶液的pH不再变化 d.溶液中 不再变化
不再变化
(5)某化学兴趣小组同学欲探究可逆反应:AsO +I2+2OH-
+I2+2OH- AsO
AsO +2I-+H2O。设计图甲所示装置。实验操作及现象:按图甲装置加入试剂并连接装置,电流由C2流入C1.当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图乙所示。
+2I-+H2O。设计图甲所示装置。实验操作及现象:按图甲装置加入试剂并连接装置,电流由C2流入C1.当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图乙所示。
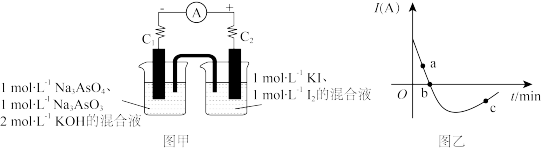
写出图乙中c点对应图甲装置的正极反应式______ 。
(6)反应AsH3(g)+H2(g) AsH5(g),下图为在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,按等物质的量投料,使用同质量的不同催化剂(α、β)催化时,AsH3的转化率与温度的关系。
AsH5(g),下图为在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,按等物质的量投料,使用同质量的不同催化剂(α、β)催化时,AsH3的转化率与温度的关系。
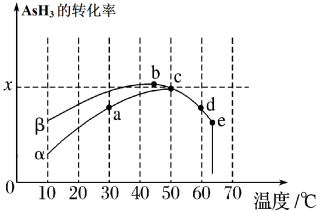
①a、b、c、d四点中,达到平衡状态的是______ 。
②已知起始压强为P0,50 ℃时,在α催化剂中,AsH3转化反应的平衡常数Kp=______ (用含x的代数式表示)。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③使用α催化剂催化时a到c变化过程的原因______ 。
(1)As元素与N元素同族,画出As原子的原子结构示意图:
(2)下列关于第VA族元素及其化合物的说法不正确的是
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.第VA族元素都是非金属元素
(3)已知:①4As(s)+5O2(g)=2As2O5(s) ΔH1
②As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH2
H2(g)+2O2(g)=H3AsO4(s) ΔH2③氢气的燃烧热 ΔH3
则As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH4=
(4)在一定温度下,向某容器中加入一定量的Na3AsO3、I2和NaOH溶液,发生反应:
 +I2+2OH-
+I2+2OH-
 +2I-+H2O,
+2I-+H2O, 的转化率[α(
的转化率[α( )]与时间的关系如图所示。
)]与时间的关系如图所示。
①E点:v正
②下列情况表明该反应达到平衡状态的是
a.2v正(I-)=v逆(AsO
 ) b.溶液颜色不再变化
) b.溶液颜色不再变化c.溶液的pH不再变化 d.溶液中
 不再变化
不再变化(5)某化学兴趣小组同学欲探究可逆反应:AsO
 +I2+2OH-
+I2+2OH- AsO
AsO +2I-+H2O。设计图甲所示装置。实验操作及现象:按图甲装置加入试剂并连接装置,电流由C2流入C1.当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图乙所示。
+2I-+H2O。设计图甲所示装置。实验操作及现象:按图甲装置加入试剂并连接装置,电流由C2流入C1.当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图乙所示。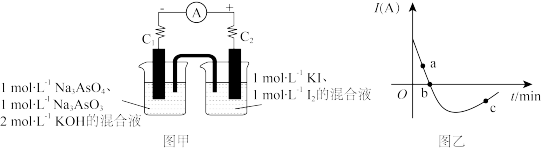
写出图乙中c点对应图甲装置的正极反应式
(6)反应AsH3(g)+H2(g)
 AsH5(g),下图为在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,按等物质的量投料,使用同质量的不同催化剂(α、β)催化时,AsH3的转化率与温度的关系。
AsH5(g),下图为在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,按等物质的量投料,使用同质量的不同催化剂(α、β)催化时,AsH3的转化率与温度的关系。
①a、b、c、d四点中,达到平衡状态的是
②已知起始压强为P0,50 ℃时,在α催化剂中,AsH3转化反应的平衡常数Kp=
③使用α催化剂催化时a到c变化过程的原因
您最近半年使用:0次
解题方法
2 . 某研究性学习小组设计实验探究元素周期律和化学反应速率。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
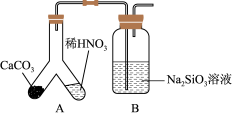
①A中反应现象为____ ,验证碳的非金属性比氮的___ (填“强”或“弱”)。
②B中反应现象为____ ,验证碳的非金属性比硅的___ (填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____ (填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______ (填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______ 试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)⇌H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
①实验1中,在10~20 min内,v(HI)=__________ mol•L-1•min-l。
②0~20 min内,实验2比实验1的反应速率______ (填“快”或“慢”),其原因可能是_______________ 。
③实验3比实验2的反应达到平衡时间_________ (填“长”或“短”),其原因是_________________________________________ 。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。

①A中反应现象为
②B中反应现象为
③结论:同一周期从左到右元素非金属性逐渐
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)⇌H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
| 实验序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=
②0~20 min内,实验2比实验1的反应速率
③实验3比实验2的反应达到平衡时间
您最近半年使用:0次
名校
解题方法
3 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果由国际知名学术期刊《科学》在线发表,因此CO2的捕集及其资源化利用成为科学家研究的重要课题。
I.二氧化碳合成“合成气”
(1)捕获的高浓度CO2能与CH4制备合成气(CO、H2),该过程主要涉及以下反应:
①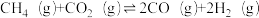 ;△H1
;△H1
②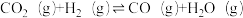 ;△H2
;△H2
③ ;△H3
;△H3
④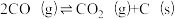 ;△H4
;△H4
根据盖斯定律,反应①的△H1=_____________ (写出代数式即可)。
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图1所示。阴极发生的反应为____________ ;
每转移1mol电子,阳极生成____________ L气体(标准状况)。
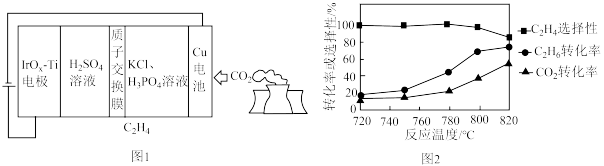
(3)以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
A.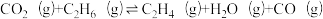 ;
; (主反应)
(主反应)
B.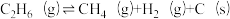 ;
;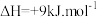 (副反应)
(副反应)
其中,反应A的反应历程可分为如下两步:
A. ;△H1(反应速率较快)
;△H1(反应速率较快)
B. ;
;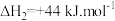 (反应速率较慢)
(反应速率较慢)
相比于提高c(C2H6),则提高c(CO2)对反应A速率影响更大,原因是____________ 。
向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂KFeMn/Si2性能的影响如图2所示,工业生产综合各方面的因素,反应选择800℃的原因是____________ 。
Ⅲ.二氧化碳合成甲醇
主反应: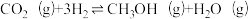 ;
;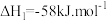
副反应: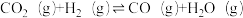 ;
;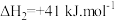
某一刚性容器中充入1molCO2和3molH2,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图3所示。已知:CH3OH选择性=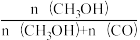
(4)240℃平衡时,生成的CH3OH的物质的量是____________ 。

Ⅳ、新型二氧化碳固定法
(5)某课题组设计一种新型的固定CO2方法,如图4所示。若原料用 ,则产物为
,则产物为____________ 。
I.二氧化碳合成“合成气”
(1)捕获的高浓度CO2能与CH4制备合成气(CO、H2),该过程主要涉及以下反应:
①
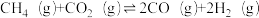 ;△H1
;△H1②
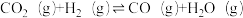 ;△H2
;△H2③
 ;△H3
;△H3④
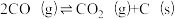 ;△H4
;△H4根据盖斯定律,反应①的△H1=
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图1所示。阴极发生的反应为
每转移1mol电子,阳极生成
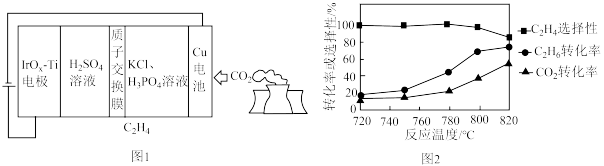
(3)以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
A.
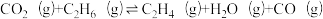 ;
; (主反应)
(主反应)B.
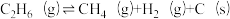 ;
;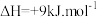 (副反应)
(副反应)其中,反应A的反应历程可分为如下两步:
A.
 ;△H1(反应速率较快)
;△H1(反应速率较快)B.
 ;
;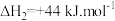 (反应速率较慢)
(反应速率较慢)相比于提高c(C2H6),则提高c(CO2)对反应A速率影响更大,原因是
向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂KFeMn/Si2性能的影响如图2所示,工业生产综合各方面的因素,反应选择800℃的原因是
Ⅲ.二氧化碳合成甲醇
主反应:
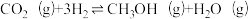 ;
;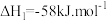
副反应:
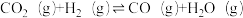 ;
;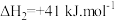
某一刚性容器中充入1molCO2和3molH2,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图3所示。已知:CH3OH选择性=
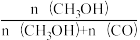
(4)240℃平衡时,生成的CH3OH的物质的量是

Ⅳ、新型二氧化碳固定法
(5)某课题组设计一种新型的固定CO2方法,如图4所示。若原料用
 ,则产物为
,则产物为
您最近半年使用:0次
4 . 二氧化钼(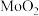 )是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
(1)已知:
①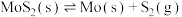

②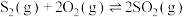

③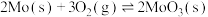

则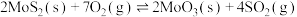 的
的
___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应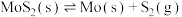 。
。
①下列说法正确的是___________ (填序号)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时 (g)的浓度为1.4mol/L,充入一定量的
(g)的浓度为1.4mol/L,充入一定量的 (g),反应再次达到平衡,
(g),反应再次达到平衡, (g)浓度
(g)浓度___________ (填“>”“<”或“=”)1.4mol/L。
(3)在2L恒容密闭容器中充入1.0mol (g)和1.5mol
(g)和1.5mol  (g),若仅发生反应:
(g),若仅发生反应: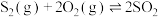
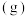 ,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,
,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内, (g)的反应速率为
(g)的反应速率为___________  。
。
(4)在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: 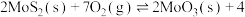

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
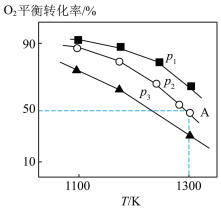
①比较 、
、 、
、 的大小:
的大小:___________ 。
②若在 为7.0kPa下,初始通入7.0mol
为7.0kPa下,初始通入7.0mol  ,则A点平衡常数
,则A点平衡常数
___________ 。(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(5) 可采用“电解法”制备,装置如图所示。
可采用“电解法”制备,装置如图所示。
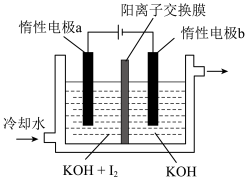
①写出电解时阴极的电极反应式:___________ 。
②电解过程中通过阳离子交换膜的离子主要为___________ 。
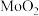 )是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:(1)已知:
①
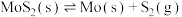

②
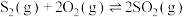

③
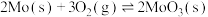

则
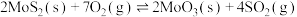 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。(2)若在恒温恒容条件下,仅发生反应
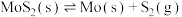 。
。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
 (g)的浓度为1.4mol/L,充入一定量的
(g)的浓度为1.4mol/L,充入一定量的 (g),反应再次达到平衡,
(g),反应再次达到平衡, (g)浓度
(g)浓度(3)在2L恒容密闭容器中充入1.0mol
 (g)和1.5mol
(g)和1.5mol  (g),若仅发生反应:
(g),若仅发生反应: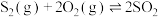
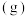 ,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,
,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内, (g)的反应速率为
(g)的反应速率为 。
。(4)在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: 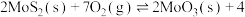

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
①比较
 、
、 、
、 的大小:
的大小:②若在
 为7.0kPa下,初始通入7.0mol
为7.0kPa下,初始通入7.0mol  ,则A点平衡常数
,则A点平衡常数
(5)
 可采用“电解法”制备,装置如图所示。
可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式:
②电解过程中通过阳离子交换膜的离子主要为
您最近半年使用:0次
2023-08-14更新
|
206次组卷
|
2卷引用:贵州省六校联盟2024届高三开学实用性联考(一)化学试题
5 . 合成氨对人类生存具有重大意义,反应为: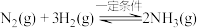
(1) 的空间结构是
的空间结构是_______ 。
(2)传统合成氨工艺是将 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入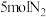 、
、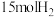 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
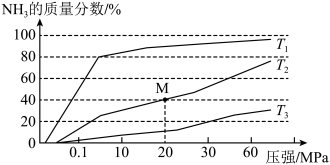
①温度 、
、 、
、 大小关系是
大小关系是_______ 。
②M点的平衡常数K=_______ (可用分数表示)。
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入 ,b处通入
,b处通入 。
。
①该装置中的能量转化形式是:_______ 能转化为_______ 能。
②导线中电子移动方向是_______ (填“a→b”或“b→a”)。
③相比传统工业合成氨,该方法的优点有_______ (任写一点)。
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
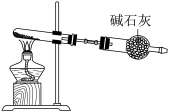
已知: 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
(5)温度为 时,将
时,将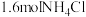 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:
①4~7min,HCl的平均反应速率为_______ 。
②其它条件不变,9min后,向容器中加入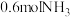 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,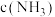
_______ (填“增大”、“减小”或“不变”)。
③下列描述中,可以表明该反应达到化学平衡状态的是_______ 。
A.容器中固体质量不变
B.容器中 的含量不变
的含量不变
C.容器中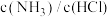 的比值不变
的比值不变
D.容器中气体压强不变
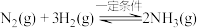
(1)
 的空间结构是
的空间结构是(2)传统合成氨工艺是将
 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入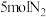 、
、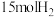 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
①温度
 、
、 、
、 大小关系是
大小关系是②M点的平衡常数K=
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入
 ,b处通入
,b处通入 。
。①该装置中的能量转化形式是:
②导线中电子移动方向是
③相比传统工业合成氨,该方法的优点有
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知:
 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
A. | B. | C. | D. |
 时,将
时,将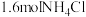 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:| t/min | 2 | 4 | 7 | 9 |
 | 0.4 | 0.5 | 0.6 | 0.6 |
②其它条件不变,9min后,向容器中加入
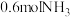 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,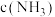
③下列描述中,可以表明该反应达到化学平衡状态的是
A.容器中固体质量不变
B.容器中
 的含量不变
的含量不变C.容器中
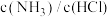 的比值不变
的比值不变 D.容器中气体压强不变
您最近半年使用:0次
名校
6 . 甲醇是重要的化工原料,又可作燃料,工业上可利用CO2来生产燃料甲醇。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
①500℃时测得反应i在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)___ (填“>”“=”或“<”)v(逆)。
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是___ (填序号)。
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g) CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为___ 。
②CH3OH(g)的平衡转化率为___ 。
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=___ (以分压表示,分压=总压×物质的量分数)。
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。
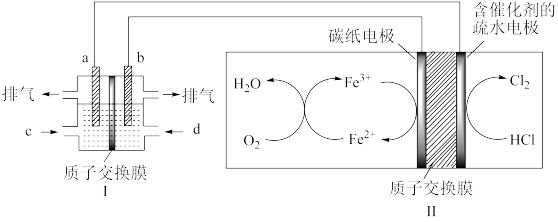
①b极的电极反应式为:___ 。
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2___ L。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
| 化学反应 | 化学平衡常数 | 温度(℃) | ||
| 500 | 700 | 800 | ||
i.3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H1 CH3OH(g)+H2O(g)△H1 | K1 | 2.5 | 0.58 | 0.38 |
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②CH3OH(g)的平衡转化率为
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。

①b极的电极反应式为:
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2
您最近半年使用:0次
7 . 氮的氧化物(如 、
、 、
、 等)应用很广,一定条件下可以相互转化。
等)应用很广,一定条件下可以相互转化。
(1)已知: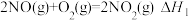
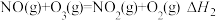

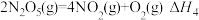
则反应 的
的
_______ 。
(2) 与
与 之间存在反应
之间存在反应 。将一定量的
。将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率 随温度变化如图1所示:
随温度变化如图1所示:
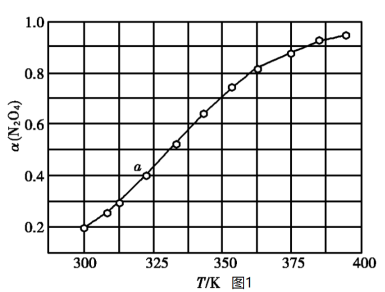
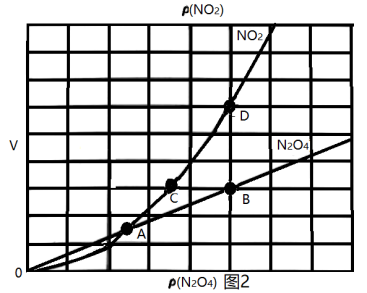
①图1中a点对应温度下,已知 的起始压强
的起始压强 为
为 ,计算该温度下反应的平衡常数
,计算该温度下反应的平衡常数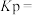
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
②由图1推测 正向是
正向是_______ (填“吸热反应”或“放热反应”),说明理由:_______ 。
③对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强存在关系:
的消耗速率与自身压强存在关系: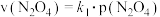 ,
,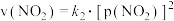 。其中,
。其中, 、
、 是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是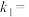
_______ ,在图2标出的点中,指出能表示反应达到平衡状态的点是:_______ 。
(3)以 为原料可以制得新型绿色硝化剂
为原料可以制得新型绿色硝化剂 ,原理是先将
,原理是先将 转化为
转化为 ,然后采用电解法制备
,然后采用电解法制备 ,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b.
,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b. 和无水硝酸,则左室中电极反应式为
和无水硝酸,则左室中电极反应式为_______ 。
 、
、 、
、 等)应用很广,一定条件下可以相互转化。
等)应用很广,一定条件下可以相互转化。(1)已知:
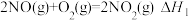
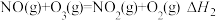

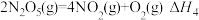
则反应
 的
的
(2)
 与
与 之间存在反应
之间存在反应 。将一定量的
。将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率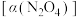 随温度变化如图1所示:
随温度变化如图1所示:


①图1中a点对应温度下,已知
 的起始压强
的起始压强 为
为 ,计算该温度下反应的平衡常数
,计算该温度下反应的平衡常数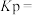
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。②由图1推测
 正向是
正向是③对于反应
 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强存在关系:
的消耗速率与自身压强存在关系: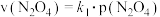 ,
,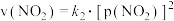 。其中,
。其中, 、
、 是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是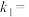
(3)以
 为原料可以制得新型绿色硝化剂
为原料可以制得新型绿色硝化剂 ,原理是先将
,原理是先将 转化为
转化为 ,然后采用电解法制备
,然后采用电解法制备 ,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b.
,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b. 和无水硝酸,则左室中电极反应式为
和无水硝酸,则左室中电极反应式为
您最近半年使用:0次
2021·全国·模拟预测
8 . CO、NOx、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为_______ (填“吸热”或“放热”)反应。
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快_______ (填“是”或“否”),原因是_______ 。
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m= ]的关系如图所示。
]的关系如图所示。
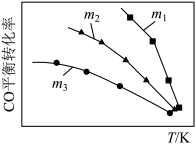
①比较m1、m2、m3的大小:_______ 。
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为_______ 。
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为_______ 。
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是_______ ,B电极的电极反应式为_______ ,经过一段时间后,若乙中C、D两电极产生的气体体积相等(相同条件下),则加入下列_______ 物质可使溶液复原。
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。
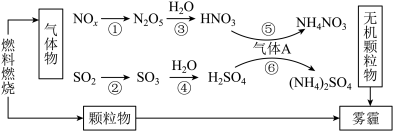
①下列说法中不正确的是_______ 。
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:_______ 。
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
 ]的关系如图所示。
]的关系如图所示。
①比较m1、m2、m3的大小:
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。

①下列说法中不正确的是
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:
您最近半年使用:0次
9 . 中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式__________________ 。
(2)H2S分解反应2H2S(g) 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:

①在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是___________ 。
②在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为___________ 。
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数,列出含p的代数式)。
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
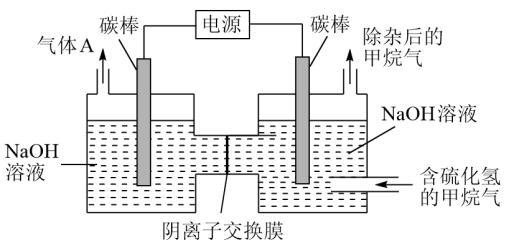
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中左端碳棒上的电极反应式为_____ ,右池中的c(NaOH):c(Na2S)_____ (填“增大”、“ 基本不变”或“减小)。
已知:常温下,HCN的电离常数Ka=4.9×10-10,H2S的电离常Ka1=1.3×10−7,Ka2=7.0×10−15,Ksp(MnS)=1.4×10−15
(4)常温下,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_______________ 。
(5)常温下,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=_____ 。
| 物质 | 燃烧热(kJ/mol) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.5 |
(2)H2S分解反应2H2S(g)
 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
①在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是
②在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中左端碳棒上的电极反应式为
已知:常温下,HCN的电离常数Ka=4.9×10-10,H2S的电离常Ka1=1.3×10−7,Ka2=7.0×10−15,Ksp(MnS)=1.4×10−15
(4)常温下,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为
(5)常温下,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L−1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=
您最近半年使用:0次
10 . 碘及其化合物在人类活动中占有重要地位。已知反应H2(g)+I2(g) 2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
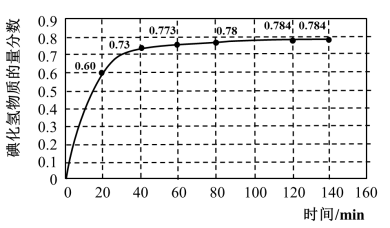
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20min内的平均速率 (HI)=
(HI)=_________ kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率a(H2)=___________ %
(3)上述反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,k逆/k正_________ (填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是_________________________________ 。
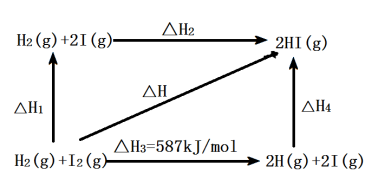
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,图中的△H2=______ kJ·mol-1。
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如图所示。

①阴极电极反应式为___________ 。
②阳膜和阴膜分别只允许阳离子、阴离子通过,则B膜为___________ 膜。
 2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20min内的平均速率
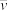 (HI)=
(HI)=(2)反应达平衡时,H2的转化率a(H2)=
(3)上述反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,k逆/k正
(4)降低温度,平衡可能逆向移动的原因是
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,图中的△H2=

(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如图所示。

①阴极电极反应式为
②阳膜和阴膜分别只允许阳离子、阴离子通过,则B膜为
您最近半年使用:0次
2020-09-24更新
|
73次组卷
|
2卷引用:山西省运城市2021届高三上学期9月调研考试化学试题



