名校
1 . 甲醇是重要的化工原料,又可作燃料,工业上可利用CO2来生产燃料甲醇。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
①500℃时测得反应i在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)___ (填“>”“=”或“<”)v(逆)。
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是___ (填序号)。
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g) CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为___ 。
②CH3OH(g)的平衡转化率为___ 。
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=___ (以分压表示,分压=总压×物质的量分数)。
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。
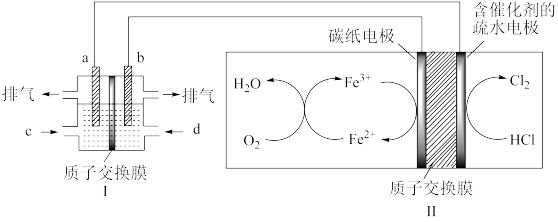
①b极的电极反应式为:___ 。
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2___ L。
(1)已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
| 化学反应 | 化学平衡常数 | 温度(℃) | ||
| 500 | 700 | 800 | ||
i.3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H1 CH3OH(g)+H2O(g)△H1 | K1 | 2.5 | 0.58 | 0.38 |
②下列措施能使反应i的平衡体系中n(CH3OH)增大的是
A.将H2O(g)从体系中分离出去B.恒容时充人He(g),使体系压强增大
C.升高温度D.恒容时再充入1molH2(g)
(2)200℃时,甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②CH3OH(g)的平衡转化率为
③反应开始时,容器内的起始压强为P0,求该反应在200℃时的平衡常数Kp=
(3)某研究小组用以酸性介质为电解质的甲醇-氧气燃料电池,电解HCl气体,制备高纯度氯气,其装置如图,其中a、b均为惰性电极。

①b极的电极反应式为:
②理论上,当燃料电池消耗16gCH3OH标准状况下能制备Cl2
您最近一年使用:0次
2021·全国·模拟预测
2 . CO、NOx、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为_______ (填“吸热”或“放热”)反应。
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快_______ (填“是”或“否”),原因是_______ 。
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m= ]的关系如图所示。
]的关系如图所示。
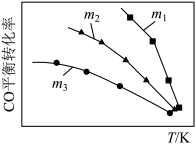
①比较m1、m2、m3的大小:_______ 。
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为_______ 。
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为_______ 。
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是_______ ,B电极的电极反应式为_______ ,经过一段时间后,若乙中C、D两电极产生的气体体积相等(相同条件下),则加入下列_______ 物质可使溶液复原。
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。
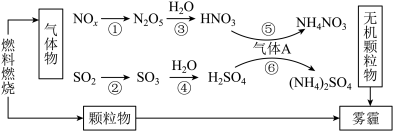
①下列说法中不正确的是_______ 。
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:_______ 。
(1)研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示。

①Fe++N2O→FeO++N2的反应为
②若反应在恒容密闭容器中进行,温度越高,反应速率是否越快
(2)利用反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
 ]的关系如图所示。
]的关系如图所示。
①比较m1、m2、m3的大小:
②若m=2,反应达平衡时,NO的转化率为60%,N2的体积分数为
③若反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的正、逆反应速率可表示为v正=k正·c2(NO)·c2(CO);v逆=k逆·c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。一定温度下,在体积为1L的容器中加入2 mol NO和2 mol CO发生上述反应,测得CO和CO2物质的量浓度相等时v正:v逆=160:1,平衡常数K为
(3)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,则A极通入的气体是
A.CuO B.CuCO3 C.Cu(OH)2

(4)研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。

①下列说法中不正确的是
a.化石燃料的燃烧与雾霾的形成有关 b.A是形成无机颗粒物的催化剂
c.雾霾中只有颗粒物 d.涉及的6个反应中只有2个氧化还原反应
②农村家庭常用燃料蜂窝煤,在制备蜂窝煤时常加CaO,请简述加CaO的作用:
您最近一年使用:0次
3 . 氮的氧化物(如 、
、 、
、 等)应用很广,一定条件下可以相互转化。
等)应用很广,一定条件下可以相互转化。
(1)已知: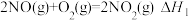
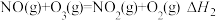

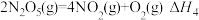
则反应 的
的
_______ 。
(2) 与
与 之间存在反应
之间存在反应 。将一定量的
。将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率 随温度变化如图1所示:
随温度变化如图1所示:
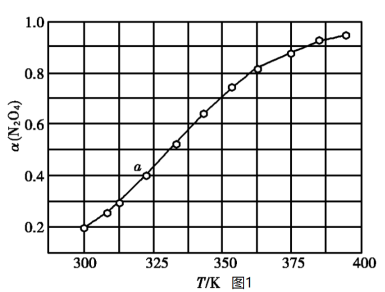
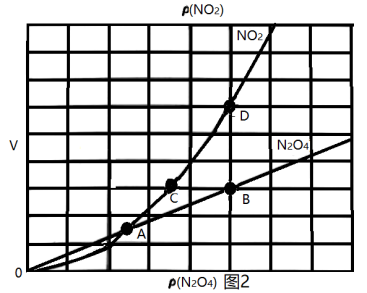
①图1中a点对应温度下,已知 的起始压强
的起始压强 为
为 ,计算该温度下反应的平衡常数
,计算该温度下反应的平衡常数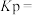
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
②由图1推测 正向是
正向是_______ (填“吸热反应”或“放热反应”),说明理由:_______ 。
③对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强存在关系:
的消耗速率与自身压强存在关系: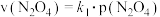 ,
,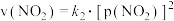 。其中,
。其中, 、
、 是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是
_______ ,在图2标出的点中,指出能表示反应达到平衡状态的点是:_______ 。
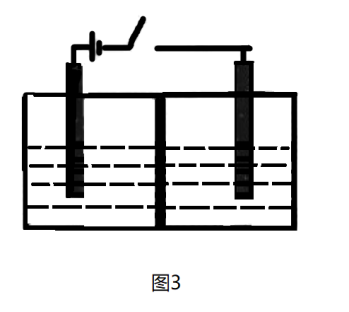
(3)以 为原料可以制得新型绿色硝化剂
为原料可以制得新型绿色硝化剂 ,原理是先将
,原理是先将 转化为
转化为 ,然后采用电解法制备
,然后采用电解法制备 ,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b.
,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b. 和无水硝酸,则左室中电极反应式为
和无水硝酸,则左室中电极反应式为_______ 。
 、
、 、
、 等)应用很广,一定条件下可以相互转化。
等)应用很广,一定条件下可以相互转化。(1)已知:
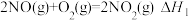
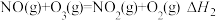

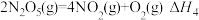
则反应
 的
的
(2)
 与
与 之间存在反应
之间存在反应 。将一定量的
。将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率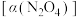 随温度变化如图1所示:
随温度变化如图1所示:


①图1中a点对应温度下,已知
 的起始压强
的起始压强 为
为 ,计算该温度下反应的平衡常数
,计算该温度下反应的平衡常数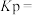
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留至小数点后一位)。②由图1推测
 正向是
正向是③对于反应
 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强存在关系:
的消耗速率与自身压强存在关系: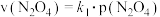 ,
,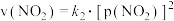 。其中,
。其中, 、
、 是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下,
是与反应及温度有关的常数。相应的速率-压强关系如图2所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是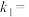
(3)以
 为原料可以制得新型绿色硝化剂
为原料可以制得新型绿色硝化剂 ,原理是先将
,原理是先将 转化为
转化为 ,然后采用电解法制备
,然后采用电解法制备 ,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b.
,其装置如图3所示,两端电极为石墨电极,中间隔膜只允许离子通过,不允许水分子通过。已知两室中加入的试剂分别为:a.硝酸;b. 和无水硝酸,则左室中电极反应式为
和无水硝酸,则左室中电极反应式为
您最近一年使用:0次
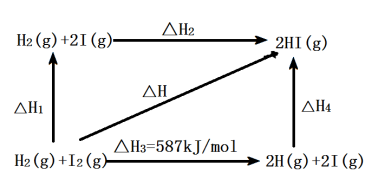
4 . 碘及其化合物在人类活动中占有重要地位。已知反应H2(g)+I2(g) 2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
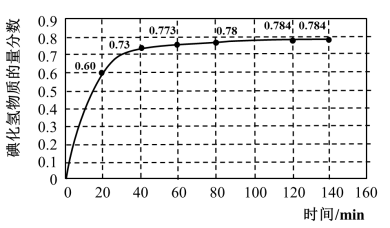
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20min内的平均速率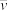 (HI)=
(HI)=_________ kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率a(H2)=___________ %
(3)上述反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,k逆/k正_________ (填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是_________________________________ 。
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,图中的△H2=______ kJ·mol-1。
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如图所示。

①阴极电极反应式为___________ 。
②阳膜和阴膜分别只允许阳离子、阴离子通过,则B膜为___________ 膜。
 2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g)△H=-11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
(1)若反应开始时气体混合物的总压为p kPa,则反应在前20min内的平均速率
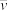 (HI)=
(HI)=(2)反应达平衡时,H2的转化率a(H2)=
(3)上述反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,k逆/k正
(4)降低温度,平衡可能逆向移动的原因是
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,图中的△H2=

(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如图所示。

①阴极电极反应式为
②阳膜和阴膜分别只允许阳离子、阴离子通过,则B膜为
您最近一年使用:0次
2020-09-24更新
|
73次组卷
|
2卷引用:陕西省汉中市2022届高三第一次校际联考化学试题



